电感耦合等离子体质谱法测定拉考沙胺注射液中10种杂质元素
欧阳婷,曾祥盛,罗恒真,廖祝元
(江西青峰药业有限公司药物研发中心,赣州341000)
为保障药品安全、有效、质量可控,人用药物注册技术要求国际协调会议(ICH)对化学药物中杂质元素提出了研究要求与控制策略,从2018 年1 月1日开始正式实施杂质元素指导原则(Q3D),要求已授权上市及新注册申请上市的化学药品必须满足杂质元素限度要求。2017年6月,中国国家食品药品监督管理总局正式成为ICH 成员。因此,我国研发及产业化的化学药品中杂质元素应按ICH 相关指导原则(USP42-NF37)开展研究与质量控制[1-3]。
拉考沙胺注射液已在欧洲、美国等地上市,用于治疗成人、青少年和4岁以上儿童患者继发性或非继发性部分发作型癫痫[4-5]。本工作采用ICH Q3D中方法2a项,明确拉考沙胺注射液中元素每日摄入量的通用允许含量限值,并制定质量标准。
本工作在文献[6-9]的基础上建立了电感耦合等离子体质谱法(ICP-MS)测定拉考沙胺注射液中锂、钒、钴、镍、铜、砷、镉、锑、汞、铅等10种杂质元素的分析方法,通过对产品中杂质元素的定量控制,确保产品中杂质元素控制在规定限度范围内,制定科学的质量标准,并将超过杂质元素含量限额30%的元素纳入药品质量标准进行管控。
1 试验部分
1.1 仪器与试剂
Agilent 7800 型电感耦合等离子体质谱仪;Milli-Q 型超纯水系统。
砷、镉、汞、铅、金标准储备溶液:1 000 mg·L-1。
钒、钴、镍标准储备溶液:含100 mg·L-1钒、50 mg·L-1钴、200 mg·L-1镍。
锂、铜、锑标准储备溶液:含550 mg·L-1锂、3 000 mg·L-1铜、1 200 mg·L-1锑。
金标准溶液:10 mg·L-1,移取1 000 mg·L-1的金标准储备溶液1 m L置于100 m L容量瓶中,用5%(体积分数,下同)硝酸溶液稀释至刻度,摇匀,作为测定过程中汞元素的稳定剂。
稀释剂:将10 mg·L-1金标准溶液0.5 m L 加入至1 L的5%硝酸溶液中,混匀。
内标溶液:含2.5 mg·L-1锝、1.0 mg·L-1钪、0.5 mg·L-1锗、0.5 mg·L-1铟、0.5 mg·L-1铋,以5%硝酸溶液为介质。
混合标准溶液:分别移取适量的各元素标准储备溶液置于100 m L 容量瓶中,用稀释剂配制成含0.22 mg·L-1锂、0.04 mg·L-1钒、0.02 mg·L-1钴、0.08 mg·L-1镍、1.2 mg·L-1铜、0.06 mg·L-1砷、0.01 mg·L-1镉、0.48 mg·L-1锑、0.01 mg·L-1汞、0.02 mg·L-1铅的混合标准溶液。
混合标准溶液系列:分别移取混合标准溶液0,1,2,5,10,20 m L,置于不同的100 m L容量瓶中,用稀释剂稀释至刻度,摇匀。
阳性对照溶液:移取拉考沙胺注射液样品1 m L和混合标准溶液5 m L,置于100 m L 容量瓶中,用稀释剂溶解并稀释至刻度,摇匀。
对照品溶液:移取混合标准溶液5 m L,置于100 m L容量瓶中,用稀释剂稀释至刻度,摇匀。
硝酸为优级纯;试验用水为超纯水(电阻率大于18 MΩ·cm)。
1.2 仪器工作条件
射频功率1 550 W;蠕动泵转速0.3 r·s-1;等离子气流量15 L·min-1,辅助气流量1 L·min-1,载气流量1.01 L·min-1;重复3次;扫描100次;样品提升时间60 s;样品稳定时间55 s。
1.3 试验方法
每支拉考沙胺注射液净重20.35 g,规格为每20 m L 200 mg。
移取拉考沙胺注射液样品1.0 m L置于100 m L容量瓶中,加入稀释剂溶解并稀释至刻度,摇匀,作为样品溶液,按仪器工作条件进行测定,目标元素7Li、51V、59Co、60Ni、63Cu、75As、114Cd、121Sb、202Hg、208Pb 对应的内标同位素依次为45Sc、45Sc、69Ge、69Ge、69Ge、69Ge、115In、127Te、209Bi、209Bi。
2 结果与讨论
2.1 待测元素之间的干扰
按照仪器工作条件对空白溶液、对照品溶液、样品溶液、阳性对照溶液进行测定,考察待测元素之间的干扰情况,结果见表1,回收率为阳性对照溶液的响应值与样品溶液响应值的差值除以对照品溶液响应值,再乘以100%。

表1 待测元素之间的干扰情况Tab.1 Interference among the elements to be determined
由表1可知:各待测元素之间均无干扰。
2.2 标准曲线和检出限
按仪器工作条件对加入内标的混合标准溶液系列进行测定,并绘制标准曲线。10种元素的线性范围、线性回归方程和相关系数见表2。
连续测定11次空白溶液,以3倍标准偏差除以标准曲线斜率计算方法的检出限(3s/k),以10倍标准偏差除以标准曲线斜率计算方法的测定下限(10s/k),结果见表2。
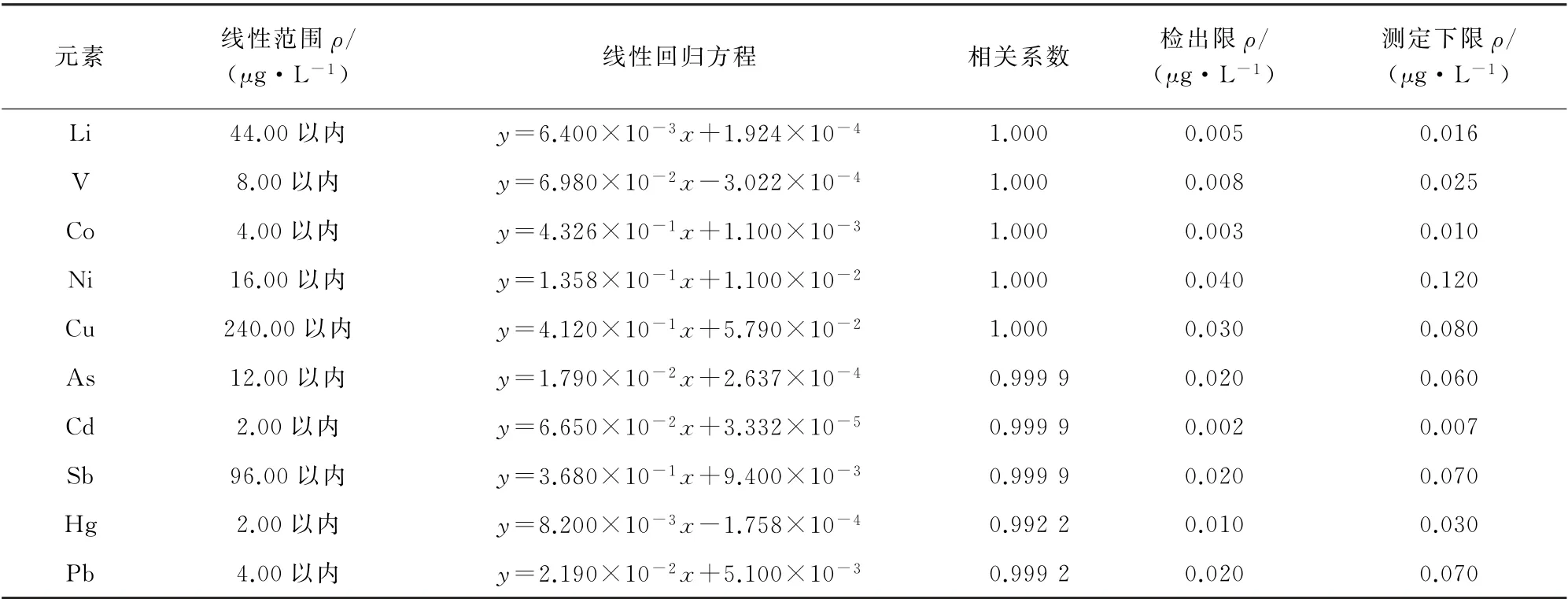
表2 线性范围、线性回归方程、相关系数、检出限和测定下限Tab.2 Linearity ranges,linear regression equations,correlation coefficients,detection limits and lower limits of determination
2.3 准确度和精密度
按试验方法对空白拉考沙胺注射液样品进行加标回收试验,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
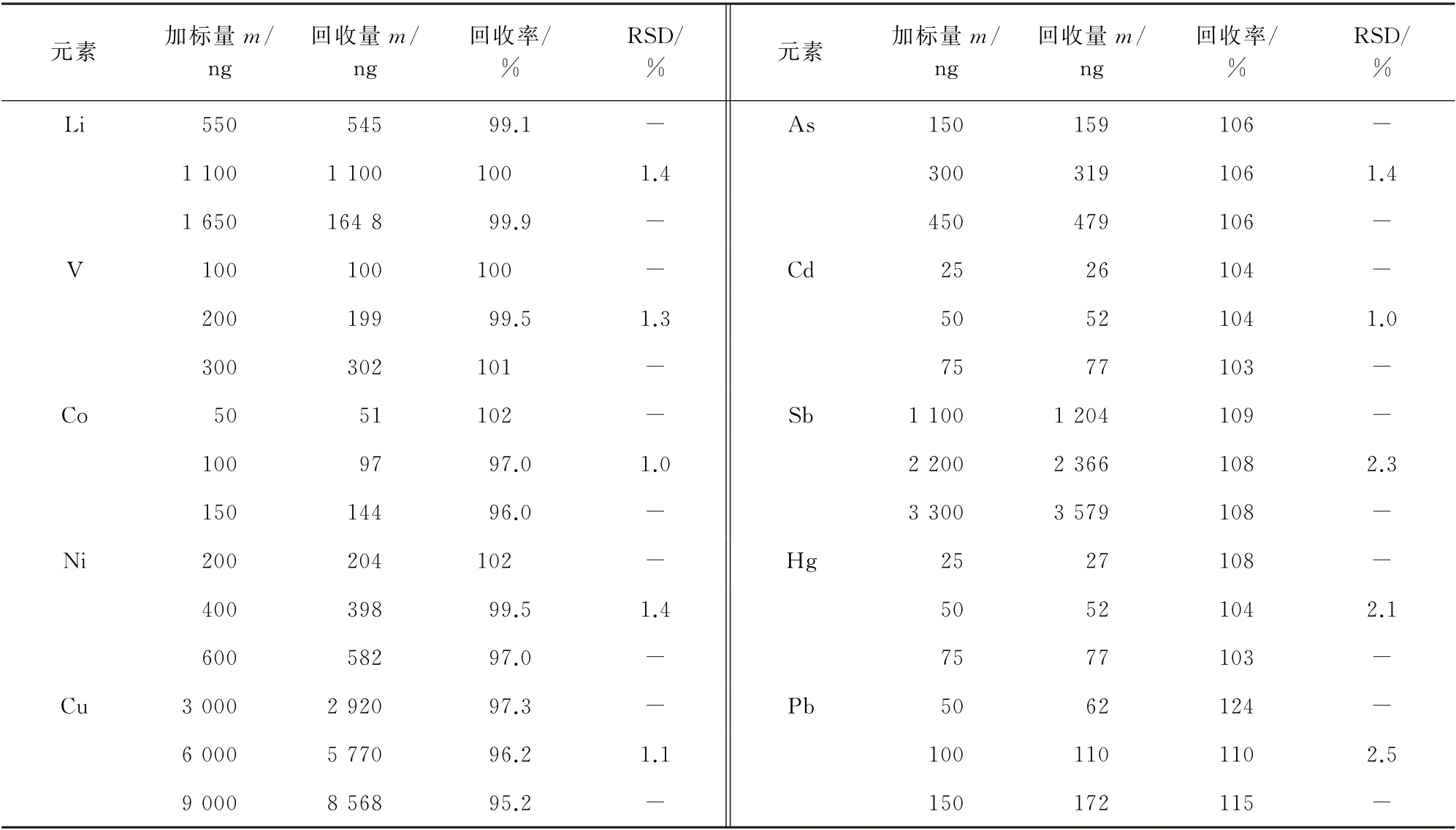
表3 准确度和精密度试验结果(n=6)Tab.3 Results of tests for accuracy and precision(n=6)
由表3可知:回收率为95.2%~124%,RSD 为1.0%~2.5%。
2.4 样品分析
按试验方法对6批次商业拉考沙胺注射液样品进行分析,结果见表4。

表4 样品分析结果Tab.4 Analytical results of the samples μg·L-1
由表4可知:在多批次拉考沙胺注射液中,除铅外,其余杂质元素水平均低于杂质元素含量限度的30%;砷在某些批次样品中的含量接近其含量限度的30%。为确保用药安全,将砷与铅含量一并订入拉考沙胺注射液质量标准,限度分别定为80,40μg·L-1。低于含量限度30%的杂质元素,可不列入质量标准。
2.5 风险评估与质量控制
欧洲、美国的药品说明书中适应症患者的拉考沙胺注射液每日最大推荐剂量分别为600,400 mg。为控制用药安全风险,采用欧洲药品说明书中的每日最大推荐剂量。
从催化剂及无机试剂、原料药、辅料、生产工艺及设备、容器及密闭系统、工艺用水等6个方面,对拉考沙胺注射液中杂质元素的来源进行风险评估,风险评估结果见表5。
通过风险评估和每日最大推荐剂量,重点关注由容器及密闭系统引入的潜在杂质元素砷和铅,结合Q3D 要求,确定拉考沙胺注射液中各杂质元素的每日允许暴露量与各杂质元素含量限度,见表6。
拉考沙胺注射液为注射剂,在质量控制及临床应用过程中,应密切关注其中的杂质元素在人体内富集所导致的潜在性风险,并对多种杂质元素潜在的来源实施过程控制。如果在药品生命周期中发生原料药合成路线、辅料供应商、制剂工艺、设备、容器密封系统或设施等变更,药品或组分的变更(这些变更可能潜在地影响拉考沙胺注射液中杂质元素的含量),应对风险评估进行重新评价,已建立的杂质元素控制方法也需重新确定。

表5 拉考沙胺注射液中杂质元素来源的风险评估结果Tab.5 Results of risk assessment of the source of impurity elements in Lacosamide injection
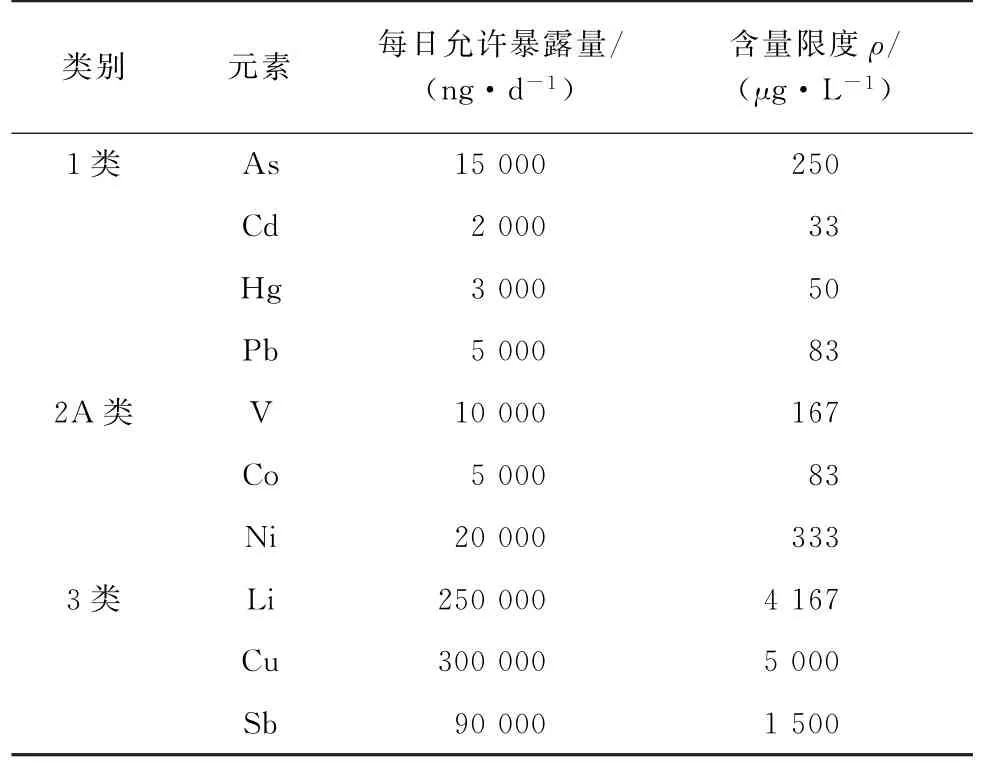
表6 每日允许暴露量与含量限度Tab.6 Daily permissible exposure and limit of content
本工作采用ICP-MS 测定拉考沙胺注射液中10种杂质元素的含量。本方法结合生产过程中杂质元素控制策略,并通过药品质量生命周期管理,可从源头控制产品中的杂质元素,提高用药安全水平。

