姜黄素-聚甲基丙烯酸甲酯纳米粒子的制备及对肺癌A549细胞的影响
单秋杰,詹小兰,李玉
(浙江省荣军医院药剂科,嘉兴 314000)
近年来,纳米材料应用于癌症治疗取得了显著进展[1-2]。肺癌是我国癌性死亡的主要原因之一,其发病率和病死率也已经跃居各种恶性肿瘤首位[3]。研究报道已有多种天然产物用于治疗癌症,其中姜黄素(curcumin,Cur)可预防膀胱癌、软腭癌、胃肠道癌、子宫颈癌、肺癌和皮肤癌等的癌前病变,并已证实其与恶性肿瘤的治疗反应有关[4]。然而,由于姜黄素的低水溶性和低生物利用度等缺点导致其疗效并不理想[5]。为了提高姜黄素的治疗和预防作用,设计先进的药物输送系统,如纳米载体输送,具有疏水核心及亲水外壳的纳米载体有助于疏水药物的溶解和安全制备[6]。研究表明纳米粒子(nanoparticles,NPs)在不同类型的肿瘤治疗中发挥作用[5,7]。在不同类型的疏水性聚合物中,具有生物相容性的聚甲基丙烯酸甲酯(poly methyl methacrylate,PMMA)由于其耐化学水解、非手性、药物高渗透性和无毒性等而被广泛应用于药物递送[8]。本研究采用微乳液聚合法制备PMMA NPs,并用生物粘附聚合物聚丙烯酸(poly acrylic acid,PAA)对Cur-PMMA NPs的表面进行功能化,评估功能化Cur-PMMA NPs对肺癌A549细胞的药物摄取和细胞活性。
1 材料与方法
1.1材料 PMMA(P141444)、PAA(P131657)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS,S108347)、2,2′-偶氮二异丁腈(2,2′-azo diisobutyronitrile,AIBN,A104255)和姜黄素(C110685)购自阿拉丁;噻唑蓝(tertrazolium blue,MTT)购自碧云天生物技术公司(C0009);人肺腺癌A549细胞系购自于中国科学院上海细胞生物研究所细胞库。
1.2姜黄素-PMMA NPs的制备及功能化 PMMA NPs采用微乳液聚合法制备,NPs 在恒定搅拌和70 ℃氮气保护条件下进料,将AIBN 26.6 mg和SDS7.766 mg混合加入含超纯水20 mL的三颈圆底烧瓶中,逐滴加入PMMA,并保持上述反应参数过夜进行聚合过程,生成NPs。用N,N-二甲基甲酰胺为溶剂配制浓度为1.0 mmol·L-1的姜黄素溶液,将PMMA NPs用超纯水稀释10倍,取2 mL置于透析膜中,逐渐加入姜黄素,直到膜袋外测得姜黄素。从420 nm波长的紫外-可见光吸收峰中估算出姜黄素的含量,用于确定载药率和包封率,公式如下:
NPs中姜黄素的Wt=加入总姜黄素的Wt-游离姜黄素的Wt


轻微搅拌NPs,添加0.01%PAA来对姜黄素 NPs进行表面功能化,并在25 ℃下保持4 h。
1.3特性检测 采用电位分析仪ZS90(Malvern仪器有限公司,Malvern,英国),扫描电子显微镜(scanning electron microscope,SEM,德国Zeiss,Oberkochen),透射电子显微镜(transmission electron microscopy,TEM)和傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR;RX1,珀金埃尔默股份有限公司)对PMMA NPs、Cur-PMMA NPs和PAA-Cur-PMMA NPs进行动态光散射(dynamic light scattering,DLS)。
为了比较Cur-PMMA-NP在不同介质中的体外释放率,在falcon试管中,将Cur-PMMA-NP 1.5 mL分别添加到1.5 mL PBS(pH值 7.4)、0.9%氯化钠溶液和胎牛血清中,并在37 ℃下孵化10 d,对药物释放情况进行检测。根据设定时间点,将样品以3000 r·min-1离心,弃去上清液,将姜黄素溶于乙醇3 mL中,记录420 nm波长处的吸光度。
为了判断A549细胞系的药物摄取,将5组细胞(对照组、PMMA- NPs组、游离姜黄素组、Cur-PMMA NPs组和PAA-Cur-PMMA NPs组)置于6孔组织培养板中的盖玻片上,并在37 ℃下孵育培养到一定密度,然后将它们暴露于50 μg·mL-1的尼罗红标记的PMMA NPs下,用荧光显微镜观察尼罗红标记的PMMA- NPs和PAA-PMMA NPs。
1.4体外抑制肿瘤细胞 MTT法检测姜黄素,PMMA NPs,Cur-PMMA NPs和PAA-Cur-PMMA NPs对A549细胞活性的影响。将每孔2×103个细胞接种在96孔板中,并用12.5,25,50和100 μg·mL-1浓度的姜黄素和含等剂量姜黄素的Cur-PMMA NPs和PAA-Cur-PMMA NPs进行处理。在24,48和72 h时,估算与未处理的对照细胞相比的细胞抑制率。
2 结果
2.1NPs表征 通过DLS证实,PMMA NPs和Cur-PMMA NPs的粒径为(192.66±5.00)和(199.16±9.00) nm,且没有发生聚集。PAA-Cur-PMMA NPs的粒径为(205±7.00) nm,PMMA NPs中姜黄素的相应载药率和包封率分别为6.0%和93.0%。与姜黄素相反,由于聚合粒子的包封率很高,姜黄素 NPs产生了高溶解度。根据Cur-PMMA NPs的SEM图像和PMMA NPs,Cur-PMMA NPs和PAA-Cur-PMMA NPs的TEM图像,可以看出粒子呈球形并且具有与DLS数据相似的粒径,在PAA涂层后可见模糊涂层(图1)。
2.2NPs药物释放PMMA NPs在PBS、0.9%氯化钠溶液和血清中的药物释放情况见图2。在PBS(40%)和0.9%氯化钠溶液(20%)条件下,姜黄素在5 h内爆发释放,随后释放平缓,在185 h内释放达83.0%。在血清中观察到高持续和控制释放,其中在150 h内释放40%,240 h内释放75.0%。
2.3细胞摄取 与游离尼罗红染料组相比,尼罗红标记的NP样品内化迅速(图3)。30 min内,Cur-PMMA NPs和PAA-Cur-PMMA NPs处理的细胞内可观察到明亮的荧光,游离姜黄素与之相比,可见非常低的荧光,NPs对照细胞未显示荧光。
2.4体外抗癌活性 对PAA-Cur-PMMA NPs、Cur-PMMA NPs、游离姜黄素和NPs的体外抗癌活性进行评估。结果显示,在24 h,游离姜黄素的细胞活性半数抑制率浓度(IC50)>100 μg·mL-1,而Cur-PMMA NPs的IC50浓度<12.5 μg·mL-1。在一定时间内(72 h),Cur-PMMA NPs细胞抑制具有剂量和时间依赖性,且显著高于游离姜黄素。24 h内,PAA-Cur-PMMA NPs表现出最大限度的细胞抑制,且在超过24 h细胞完全抑制(图4,5)。
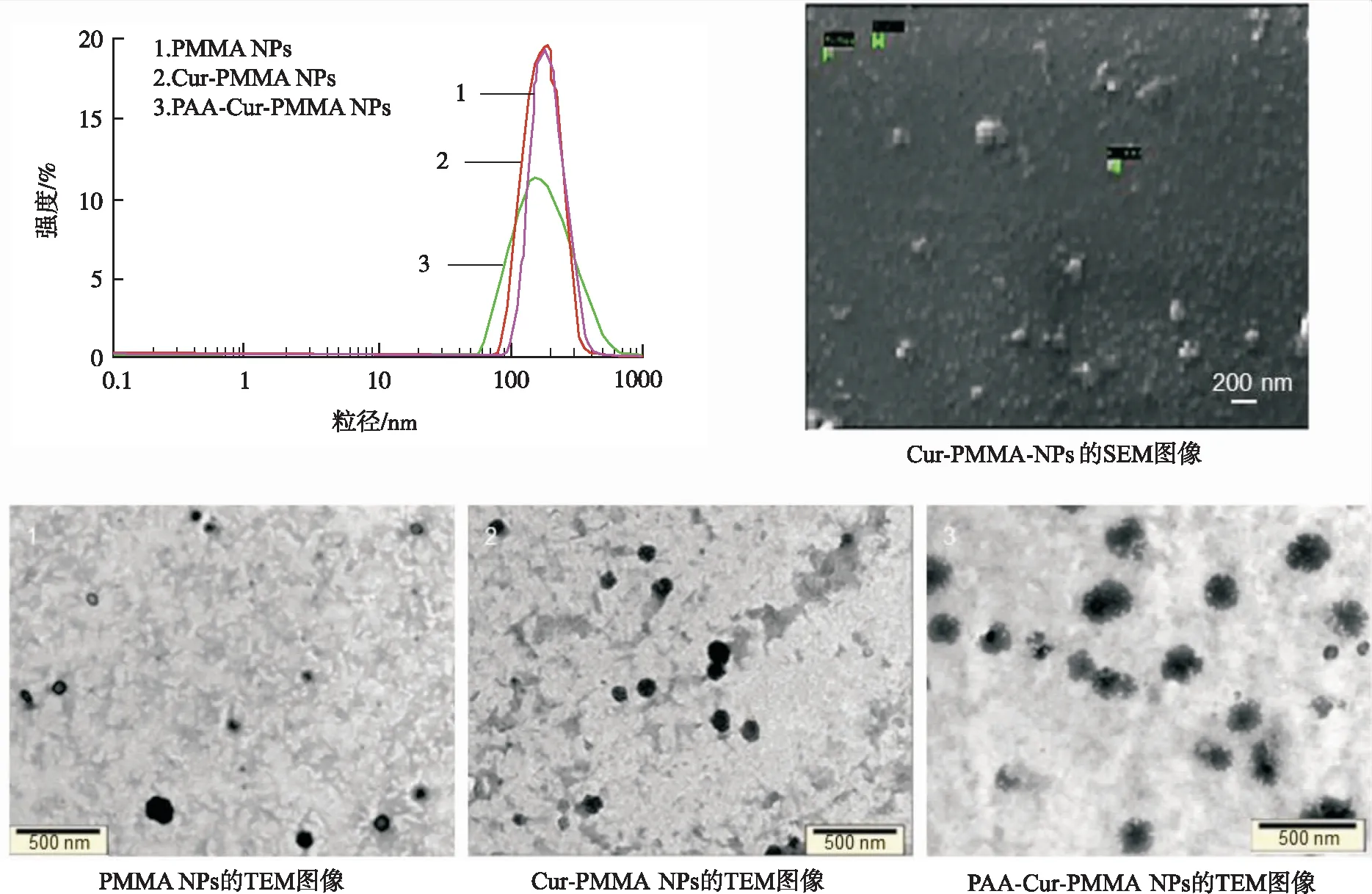
图1 NPs的表征
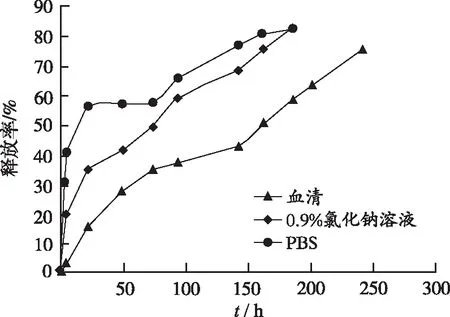
图2 NPs在PBS、0.9%氯化钠溶液和血清中姜黄素的释放曲线
Fig.2ReleaseprofileofcurcumininPBS,0.9%chloridesodiumsolutionorserum
3 讨论
姜黄素是一种对肺癌、膀胱癌等多种肿瘤细胞具有抗癌活性的植物化学成分,且无明显毒副作用,已有报道姜黄素对非小细胞肺癌A549细胞的抗肿瘤活性[3,9]。姜黄素与化疗药物联合应用是预防和治疗肿
瘤研究的热点之一,在临床化疗中具有抗癌,逆转耐药及减毒多重作用,有助于提高化疗疗效。但由于姜黄素稳定性和溶解性低,限制了其临床应用[5]。纳米药物制剂技术解决姜黄素的稳定性和溶解性低的问题,对于姜黄素的应用意义明显。为此,利用药物输送系统,提高姜黄素的稳定性和生物利用度,降低药物的毒性,笔者使用PMMA纳米粒子来包载姜黄素。为进一步增强和延长药物作用,采用PAA对NPs的表面进行了功能化处理,以保证NPs在病灶的停留时间更长。通过DLS证实,成功制备了Cur-PMMA NPs,该粒子大小均匀,呈球形,无明显的团聚现象,在PAA涂层后可见模糊涂层。本研究中,PMMA NPs表现出较高的载药率和包封率,说明PMMA与姜黄素分子具有良好的亲和力。
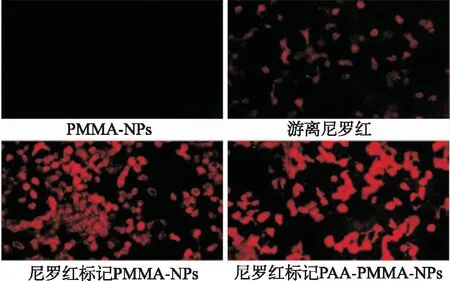
图3 NPs细胞摄取荧光图像
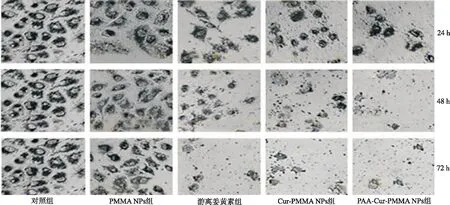
图4 5组A549细胞对NPs的摄取效果
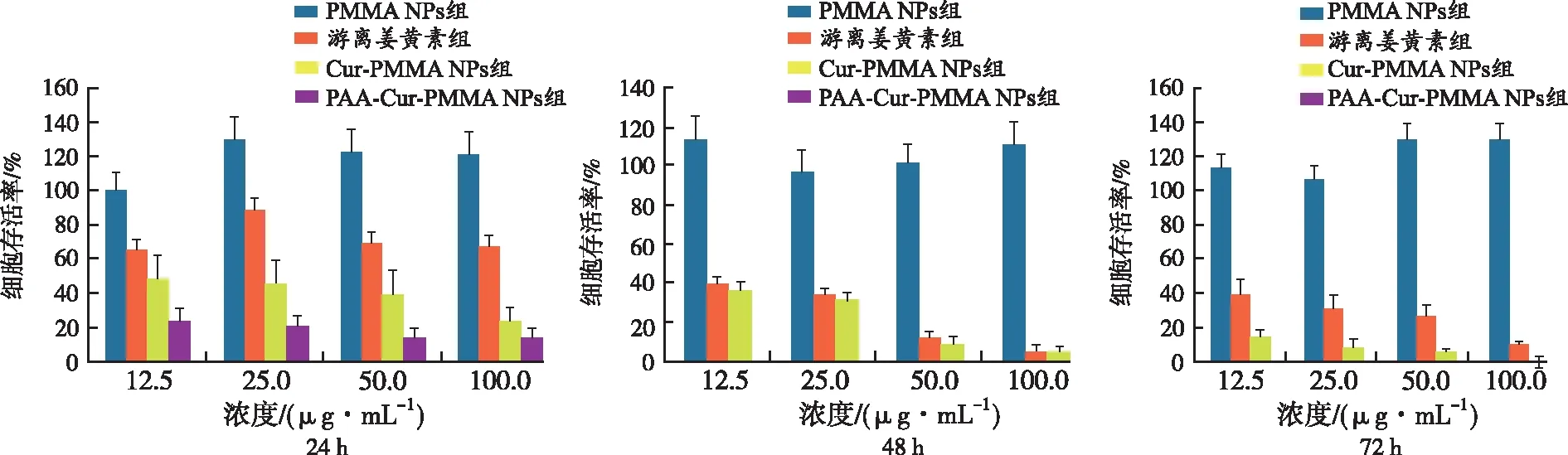
图5 4组A549细胞在不同时间内的活性比较
由于制剂在体内施用后到达癌细胞所需的时间,药物的持续释放将比快速释放的制剂更有利[10]。姜黄素是一种不稳定的化合物,在体内药物生物利用度低下。体外药物释放实验结果显示Cur-PMMA纳米粒在血清中的缓释效果较好,使得血清中姜黄素的持续释放可以使药物在要求的位点持续可用。
此外,本研究通过荧光显微镜观察包载尼罗红荧光染料的NPs的细胞摄取情况,证实了Cur-PMMA NPs具有更高的细胞摄取行为,Cur-PMMA NPs的摄取可确保细胞内的释放,具有良好的靶向作用,从而使肿瘤细胞快速有效地死亡。细胞活性检测也显示,Cur-PMMA NPs的抑制细胞活性比姜黄素更好。本研究显示,纳米技术适合有效的局部药物控制释放,是提高难溶性药物疗效的一种有效途径,有助于其在癌症治疗中的应用。

