采用不同介质溶出曲线评价自制奥美沙坦酯片的质量*
苗彩云,陈江飞
(1.宁波市妇女儿童医院药剂科,宁波 315012;2.宁波市第一医院药学部,宁波 315010)
奥美沙坦酯由日本三共制药公司研制开发,2002年5月以商品名Benicar在美国上市,用于治疗高血压。该药为选择性血管紧张素Ⅱ(Ang Ⅱ)1型(AT1)受体拮抗药,通过选择性阻断AngⅡ与血管平滑肌AT1受体的结合而阻断AngⅡ的收缩血管作用。我国于2006年上市,由第一三共制药(上海)有限公司生产,商品名“傲坦”,上市剂型为片剂,规格为20和40 mg。
奥美沙坦酯具有弱碱性(pKa=4.3)和高亲脂性,口服生物利用度约29%[1],水中的平衡溶解度仅为12.55 mg·L-1[2],属于生物药剂学分类系统中的Ⅱ类药物,溶出是影响其吸收的限速步骤[3],因此溶出度实验技术不仅是评价口服固体制剂内在质量的一种重要手段,在多种pH值溶出介质中溶出曲线的测定更是评估不同来源同一制剂内在质量差异的可靠手段[4]。笔者以原研药“傲坦”为参比制剂,考察自制奥美沙坦酯片在4种溶出介质中的溶出行为,并采用相似因子法对自制产品作质量评价,为改进奥美沙坦酯片处方质量提供依据。
1 仪器与试药
1.1仪器 RC806D溶出实验仪(天津市天大天发科技有限公司);UV2450型紫外-可见分光光度计(日本岛津公司);AB204-E电子天平(瑞士METTLER TOLEDO公司,感量:0.01 mg)。
1.2试药 奥美沙坦酯片参比制剂[商品名:傲坦,第一三共制药(上海)有限公司,批号:120080,120150];奥美沙坦酯自制片[奥美沙坦酯20 mg(原料分别过筛孔内径150和75 μm筛和微粉化),羟丙纤维素、微晶纤维素、低取代羟丙纤维素、乳糖、硬脂酸镁、包衣粉];奥美沙坦酯对照品(中国食品药品检定研究院,批号:100864-200601);乙腈为色谱纯,十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、盐酸、醋酸、醋酸钠、磷酸二氢钾等均为分析纯;水为纯化水。
2 方法与结果
2.1溶液的配制
2.1.1溶出介质 按照《普通口服固体制剂溶出度实验技术指导原则》[5]配制4种溶出介质,分别为pH值1.0盐酸溶液、pH值4.5醋酸盐缓冲液(含0.2%SDS)、pH值6.8磷酸盐缓冲液和水(含0.1% SDS)。
2.1.2对照品溶液 取奥美沙坦酯对照品约20 mg,精密称定,置100 mL量瓶中,加乙腈-水(60:40)适量,超声溶解,稀释至刻度,摇匀,作为储备液。精密量取5 mL,置100 mL量瓶中,加相应溶出介质稀释至刻度,摇匀,作为对照品溶液。
2.2方法学考察
2.2.1检测波长的确定 取空白辅料适量,用“2.1.1”项下4种溶出介质溶解,制成相应溶出介质的空白辅料溶液,另取“2.1.2”项下对照品溶液适量,按照紫外-可见分光光度法,在波长200~400 nm范围内进行扫描,介质pH值1.0盐酸溶液和醋酸盐缓冲液(含0.2%SDS)中奥美沙坦酯在251 nm处有较强吸收峰,而pH值6.8磷酸盐缓冲液和水(含0.1%SDS)在258 nm处,空白辅料在该两处波长均无吸收,分别选择不同介质以251和258 nm作为检测波长。
2.2.2线性关系考察 精密量取适量奥美沙坦酯储备液置于100 mL量瓶中,用“2.1.1”项下4种溶出介质稀释至刻度,摇匀。取上述溶液适量,按照紫外-可见分光光度法,测吸光度。以奥美沙坦酯质量浓度(X)为横坐标,吸光度(Y)为纵坐标进行线性回归,结果见表1,在4.026~16.104 μg·mL-1范围内呈良好线性关系。
表1 不同溶出介质线性回归方程
Tab.1Linearregressionequationofdifferentdissolutionmedia

溶出介质检测波长/nm回归方程R2pH值1.0盐酸溶液251Y=0.036 5X-0.003 40.999 9pH值4.5醋酸盐缓冲液251Y=0.037 0X+0.003 80.999 9 (含0.2%SDS)pH值6.8磷酸盐缓冲液258Y=0.043 5X+0.003 40.999 8水(含0.1%SDS)258Y=0.039 8X+0.001 01.000 0
2.2.3精密度实验 取“2.1.2”项下对照品溶液适量,照紫外-可见分光光度法,重复测定6次,RSD分别为0.17%,0.16%,0.31%,0.26%,表明仪器精密度良好。
2.2.4稳定性实验 取“2.1.2”项下对照品溶液适量,分别于室温下放置0,2,4,6,8 h时,测吸光度,RSD分别为0.63%,0.41%,0.40%,0.39%,表明奥美沙坦酯在4种溶出介质中室温下8 h内稳定性良好。
2.2.5回收率实验 取“2.1.2”项下对照品溶液适量,称取按处方比例的空白辅料置100 mL量瓶中,用“2.1.1”项下4种溶出介质超声溶解并稀释至刻度,摇匀,作为供试品溶液。照紫外-可见分光光度法,测吸光度,并计算回收率及RSD,结果见表2。
2.3溶出度测定 参照奥美沙坦酯片(YBH06992006)质量标准溶出度项下的方法,按照溶出度测定法(《中华人民共和国药典》2015年版二部附录X C第二法),分别量取经脱气处理的“2.1.1”项下4种溶出介质1000 mL,待溶出介质温度恒定在(37.0±0.5) ℃,设置转速50 r·min-1,将奥美沙坦片置6个溶出杯中(分2次投入),自供试品接触溶出介质起计时,根据《普通口服固体制剂溶出度实验技术指导原则》和实际溶出情况,分别于5,10,15,20,30,45,60 min取样10 mL(同时补充同温等量空白溶出介质),经孔径0.45 μm微孔滤膜滤过。按照紫外-可见分光光度法测定吸光度,计算各时间点的累积溶出度,绘制溶出曲线,结果见图1~4。
2.4溶出曲线相似性评价 根据《普通口服固体制剂溶出度实验技术指导原则》,采用相似因子(f2)来比较溶出曲线,评价自制片与参比制剂体外溶出行为的相似性。在pH值6.8磷酸盐缓冲液中,自制片(粒径150 μm)与2批参比制剂(批号:120080,120150)比较的f2值分别为36.32和32.94;自制片(粒径75 μm)与2批参比制剂(批号:120080,120150)比较的f2值分别为44.19和39.53,而自制片(微粉化)与2批参比制剂(批号120080,120150)比较的f2值均大于50。自制片(微粉化)与参比制剂在pH值1.0盐酸溶液的15 min溶出度均超过85%,在另外3种溶出介质中f2值均大于50。结果表明,奥美沙坦酯自制片(微粉化)与参比制剂在4种溶出介质中的溶出曲线相似。
3 讨论
奥美沙坦酯几乎不溶于水,减小原料药粒径能加快溶出,是影响制剂溶出行为的关键因素。笔者分别将奥美沙坦酯原料过100目(粒径约150 μm)、200目(粒径约75 μm)和微粉化(粒径约15 μm)制成片剂,通过溶出度评价指标进行处方筛选,由于在pH值6.8磷酸盐缓冲液中能满足漏槽条件,可用于奥美沙坦酯片溶出度的测定和处方筛选[6-7]。在pH值6.8磷酸盐缓冲液中,自制片(粒径约75 μm)、自制片(粒径约150 μm)60 min的溶出度分别为75.98%和82.84%,与参比制剂比较f2值均小于50,表明奥美沙坦酯片在原料粒径>75 μm时溶出曲线不同于原研制剂,而将原料微粉化后控制粒径约15 μm,具有相似的溶出行为。严相平等[6]考察了奥美沙坦酯片处方工艺对溶出度的影响,结果显示原料粒径的影响最关键,与本研究结果基本一致,该报道中研究者认为需要控制粒径d(0.9)、d(0.5)和d(0.1)小于10.0,3.5,0.6 μm,本研究中的微粉化原料d(0.9)、d(0.5)和d(0.1)分别为15.51,5.97,0.93 μm,30 min溶出率为87.17%,同样实现与原研制剂相似的溶出曲线。
表2 奥美沙坦酯在不同溶出介质中回收率实验结果
Tab.2Resultsofrecoverytestofolmesartarmedoxomilindifferentdissolutionmedia
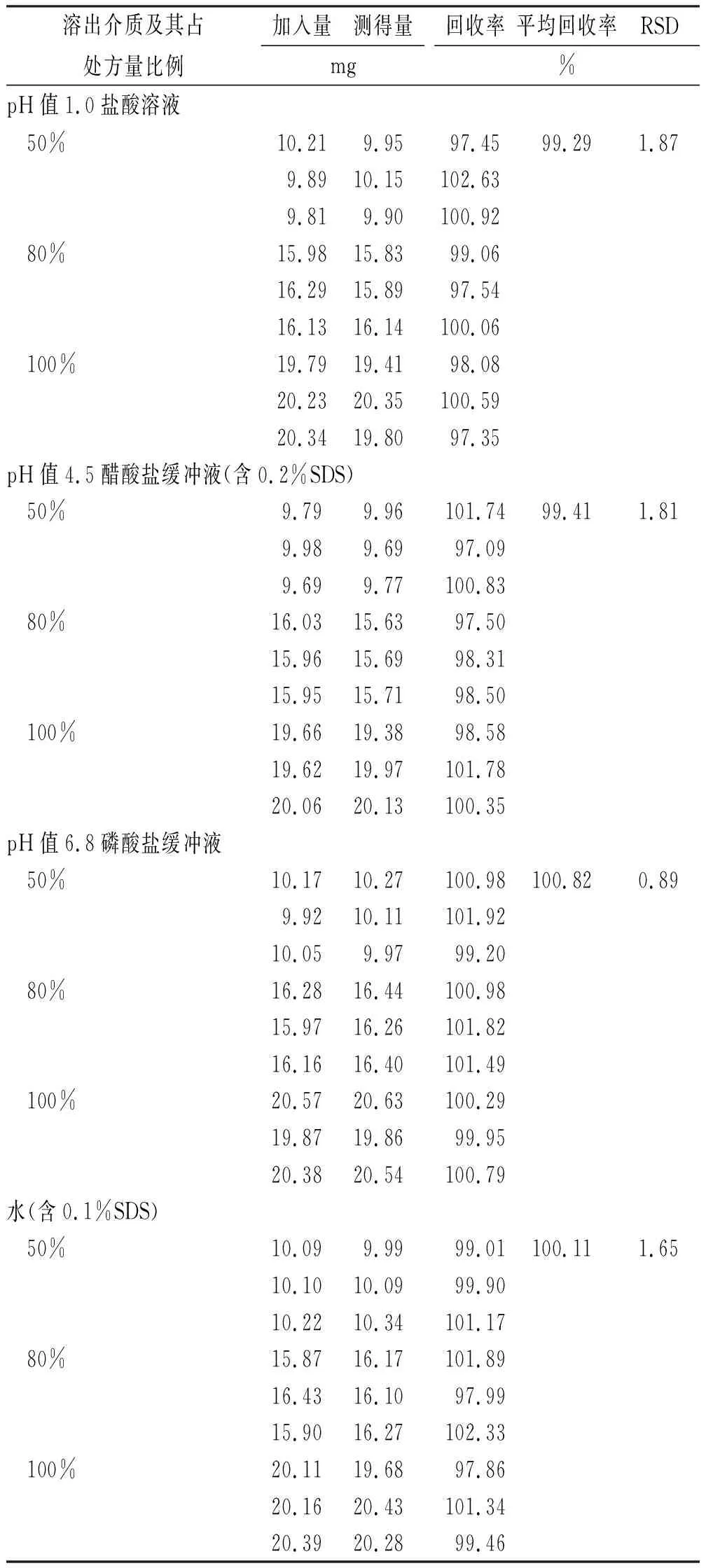
溶出介质及其占处方量比例加入量测得量mg回收率平均回收率RSD%pH值1.0盐酸溶液 50%10.219.9597.4599.291.879.8910.15102.639.819.90100.92 80%15.9815.8399.0616.2915.8997.5416.1316.14100.06 100%19.7919.4198.0820.2320.35100.5920.3419.8097.35pH值4.5醋酸盐缓冲液(含0.2%SDS) 50%9.799.96101.7499.411.819.989.6997.099.699.77100.83 80%16.0315.6397.5015.9615.6998.3115.9515.7198.50 100%19.6619.3898.5819.6219.97101.7820.0620.13100.35pH值6.8磷酸盐缓冲液 50%10.1710.27100.98100.820.899.9210.11101.9210.059.9799.20 80%16.2816.44100.9815.9716.26101.8216.1616.40101.49 100%20.5720.63100.2919.8719.8699.9520.3820.54100.79水(含0.1%SDS) 50%10.099.9999.01100.111.6510.1010.0999.9010.2210.34101.17 80%15.8716.17101.8916.4316.1097.9915.9016.27102.33 100%20.1119.6897.8620.1620.43101.3420.3920.2899.46
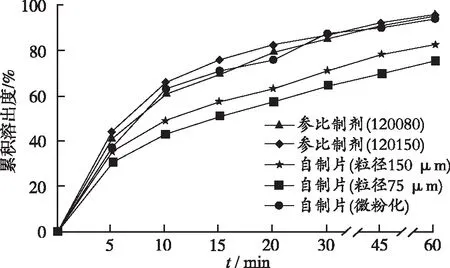
图1 自制样品与参比制剂在pH值6.8磷酸盐缓冲液中的溶出曲线
Fig.1Dissolutioncurveofself-preparedandreferencesamplesinphosphatebuffersolutionatpH6.8
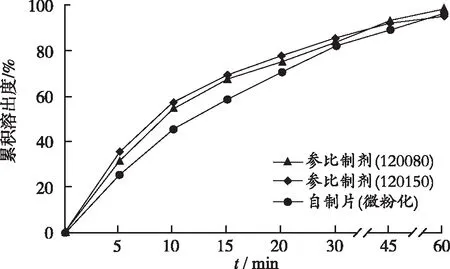
图2 自制样品与参比制剂在水(含0.1% SDS)中的溶出曲线
Fig.2Dissolutioncurveofself-preparedandreferencesamplesinwater(containing0.1%SDS)
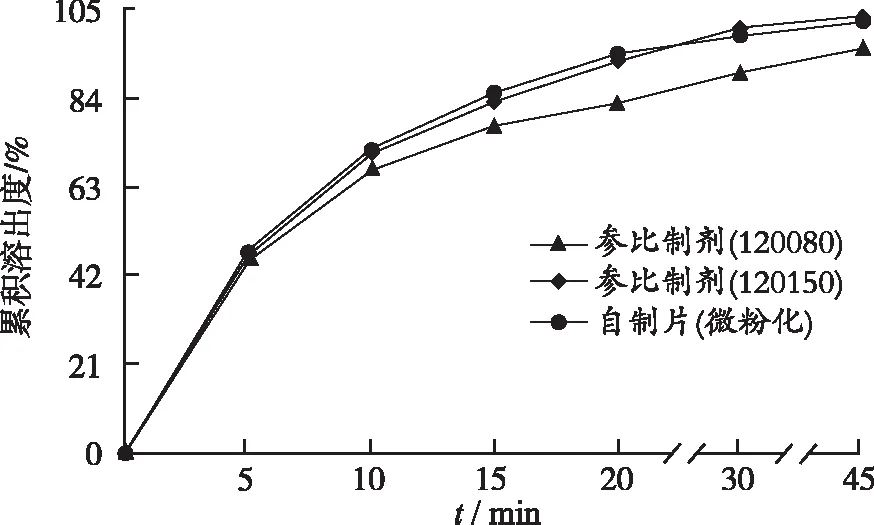
图3 自制样品与参比制剂在pH值4.5醋酸盐缓冲液(含0.2%SDS)中的溶出曲线
Fig.3Dissolutioncurveofself-preparedandreferencesamplesinHAcbuffersolutionatpH4.5(containing0.2%SDS)
图4 自制样品与参比制剂在pH值1.0盐酸溶液中的溶出曲线
Fig.4Dissolutioncurveofself-preparedandreferencesamplesinHClsolutionatpH1.0
进一步考察在另3种介质中的溶出行为,由于奥美沙坦酯几乎不溶于水,其溶解度对pH值有依赖性,pH值在0~2内随着pH值降低急剧增大,中性介质条件下溶解最少[2]。自制片(微粉化)和参比制剂在pH值1.0盐酸溶液中溶出较快,10 min溶出率超过95%,表明为不具有区分力的溶出曲线[8]。奥美沙坦酯在水和pH值4.5醋酸盐缓冲液中达不到漏槽条件,120 min的溶出率低于60%[6,9],本研究考察了这2种介质中加入不同浓度表面活性剂对溶出度影响,确定水、pH值4.5醋酸盐缓冲液分别含0.1%和0.2%的SDS作为溶出介质,无论自制片(微粉化)还是参比制剂45 min的溶出率均达85%,且溶出曲线无拐点和突释,证明为具有分辨力的溶出曲线[8]。
总之,奥美沙坦酯原料粒径是决定制剂溶出的关键因素,本研究将原料微粉化(粒径约15 μm)的自制片在4种溶出介质中具有与原研制剂相似的溶出曲线,说明两者质量一致性较好,但是否能取得体内生物利用度等效尚有待进一步研究。

