薏仁醋酿造液化及糖化工艺优化
方秋野,王毛毛,刘瑶,王如福
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
薏苡(Coixlacryma-jobiL.)属禾本科一年或多年生草本植物,其干燥成熟的种仁被称为薏仁,又名薏米等[1]。薏仁在我国各地及亚洲其他国家均有分布,我国主产区为福建、贵州、江苏、河北、辽宁等地[2]。其中,贵州省的薏仁资源较为丰富,是我国重要的薏仁生长区[3]。作为我国首批公布的药食同源食品之一,薏仁的营养及药用价值极高。著名医药典籍《本草纲目》就曾指出薏仁有“健脾益胃,补肺清热,强筋健骨”之功效[4]。薏仁富含蛋白质、氨基酸、淀粉、维生素、矿物质、脂肪和水溶性纤维等营养成分,以及薏仁内酯、黄酮和三萜类化合物和多糖等功能成分,临床药理研究表明,薏仁具有抗炎、抗肿瘤、降血糖、免疫调节及抑制骨质疏松等多种药理活性[5]。
国内外对于薏仁的研究主要集中在薏仁多糖等功能成分的提取及提取工艺优化等方面[6-9]。长期以来,薏仁的食用方法都以直接蒸煮为主,市面上缺少其深加工制品,加之其本身风味不能被大众完全接受,导致薏仁这一高营养价值谷物的流通和消费受到了极大限制。如今随着科技的飞速发展,对薏仁加工食品的研究与开发日益增加,魏建春等[10]以薏仁、红枣为主料,优化浸提制汁工艺,研制出了一款口感优良、营养丰富的功能型保健饮料,吕峰等[11]通过均匀设计实验优选出最佳的薏仁酒酿造工艺条件等,但针对薏仁发酵前的液化及糖化工艺研究较少。薏仁中含有较多的活性功能成分,若在其发酵产品中能最大程度地保留这些物质,将更有利于实现最终产品的功能化。而液化及糖化是薏仁发酵前的重要环节,同时也是功能成分较易损失的环节,在该阶段的研究中应保证薏仁糖化醪具有较好的发酵性能并且保留更多功能成分,这对薏仁发酵产品品质的提高具有重要的意义。
薏仁直链淀粉含量高,用其作为酿醋不易进行糖化,并使得淀粉利用率低,用薏仁为单一原料进行酿造使得产品口感寡淡,品质不佳。高粱中含有较高淀粉、较低脂肪和适量的蛋白质,是一种很好的酿醋原料[12]。同时,高粱所含支链淀粉含量较高,可促使薏仁较快地进行液化及糖化反应,并提高产酒率,而且酒液中残留的低聚糖和极限糊精较多,口感醇厚[13]。故本试验选择添加一定量的高粱,在降低薏仁醋制品成本和提高产品品质的同时,也改善了其风味和口感,使其更易于被大众接受。本试验旨在确定薏仁液化及糖化的最优工艺,为薏仁醋酿造中的液化及糖化工作提供理论依据。
1 材料与方法
1.1 材料、试剂与设备
1.1.1 材料与试剂
薏仁:产自贵州黔西南州;α-淀粉酶(40000 U/g)、糖化酶(100000 U/g)、芦丁标准品(纯度≥98%):北京索莱宝科技有限公司。
1.1.2 试验设备
DS-1型组织捣碎机 上海昂尼仪器仪表有限公司;THZ-82恒温振荡水浴锅 常州润华电器有限公司;BS210S电子天平 德国赛多利斯集团;722可见分光光度计 上海舜宇恒平科学仪器有限公司;DZTW电子调温电热套 天津工兴实验室仪器有限公司。
1.2 试验方法
1.2.1 工艺流程
薏仁→挑选→清洗→粉碎→糊化→加入耐高温α-淀粉酶→加热灭酶→加入糖化酶→加热灭酶→薏仁糖化醪。
1.2.2 薏仁液化及糖化单因素试验
以还原糖和总黄酮含量为指标,在预试验的基础上设置高粱添加量(0.6,0.7,0.8,0.9,1.0倍)、料水比例(1∶2、1∶3、1∶4、1∶5、1∶6)、α-淀粉酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)、液化温度(70,75,80,85,90 ℃)、液化时间(20,30,40,50,60 min)、糖化酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、糖化温度(50,55,60,65,70 ℃)、糖化时间(20,30,40,50,60 min)8个单因素试验,考察其对糖化终点还原糖及总黄酮含量的影响。
1.2.3 Plackett-Burman试验设计
基于单因素试验结果确定各因素的范围,以薏仁糖化醪还原糖含量为响应值,使用Design-Expert 10软件创建Plackett-Burman试验,对高粱添加量(A)、料水比例(B)、α-淀粉酶添加量(C)、液化温度(D)、液化时间(E)、糖化酶添加量(F)、糖化温度(G)、糖化时间(H)8 个变量进行筛选,另设置3个虚拟变量来衡量试验误差,通过软件分析筛选出对薏仁糖化醪有显著影响的因素。
1.2.4 最陡爬坡试验
基于Plackett-Burman试验筛选出的显著影响因素,以糖化醪还原糖含量为响应值,设计爬坡方向并确定合适的步长,以求高效地逼近各因素的最佳取值范围。
1.2.5 响应面试验设计
基于Plackett-Burman试验和最陡爬坡试验,依据Box-Behnken试验设计原理,选取液化温度、液化时间、糖化酶添加量3个影响显著的因素,以薏仁糖化醪还原糖含量和总黄酮含量为响应值,设计三因素三水平的试验,见表1。
1.2.6 测定方法
总黄酮含量的测定:参考GB/T 19777-2013中的《总黄酮的检测方法》。以芦丁为标准物,NaNO2-Al(NO3)3比色法建立标准曲线回归方程:y=0.4305x-0.0127,R2=0.9947,其中,y为吸光值,x为芦丁质量。芦丁标准曲线见图1。
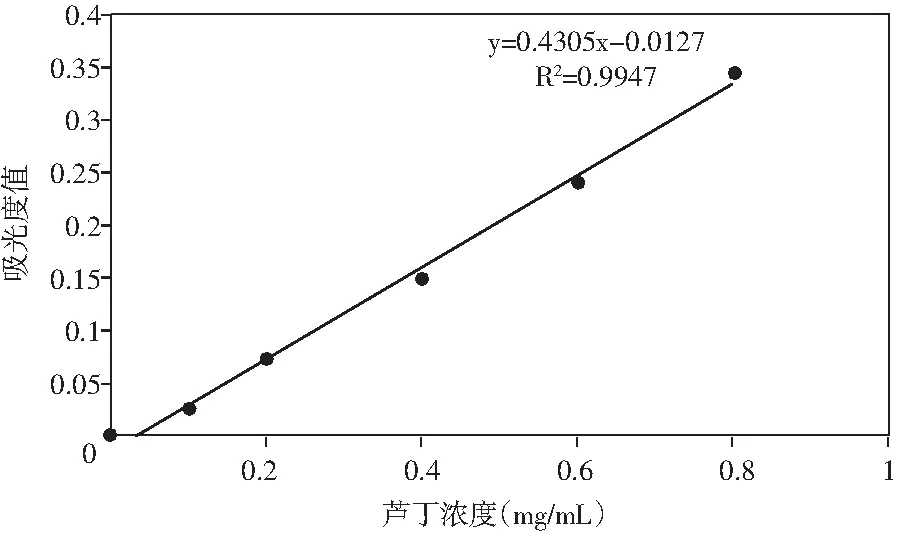
图1 芦丁标准曲线Fig.1 Standard curve of rutin
式中:X为样品中总黄酮(以芦丁计)的含量,mg/100 g;m1为由工作曲线查出(或用回归方程计算)试液中总黄酮(以芦丁计)的质量,mg;m为样品的质量,g。
还原糖的测定:参考GB/T 19777-2013附录D《还原糖的检测方法》。
1.2.7 感官评价
高粱添加量感官评分表见表2。
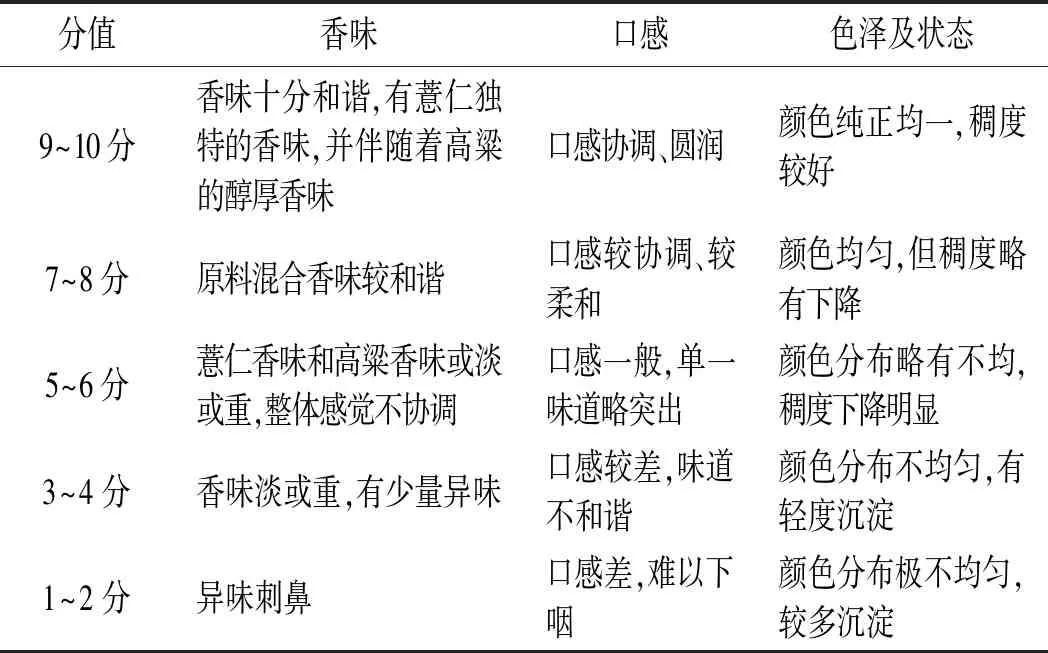
表2 高粱添加量感官评分表Table 2 The sensory scoring table of sorghum additive amount
2 结果与分析
2.1 薏仁液化及糖化单因素试验
2.1.1 高粱添加量的确定
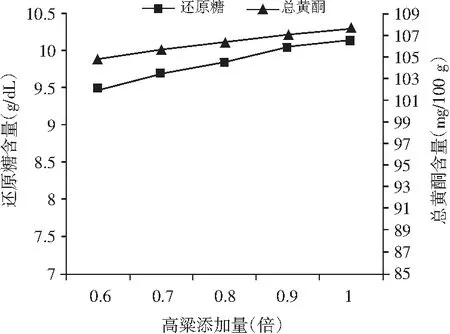
图2 高粱添加量对薏仁糖化醪还原糖及总黄酮含量的影响Fig.2 Effect of sorghum additive amount on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图2可知,糖化醪的还原糖和总黄酮含量随着高粱添加量的增加而呈现平缓增长的趋势。高粱经液化及糖化后产生的醇厚香气能克服纯薏仁糖化醪香气单薄的弱点,但过多的高粱则对混合糖化醪风味产生压制作用,使得糖化醪香气单一,高粱气味突出。
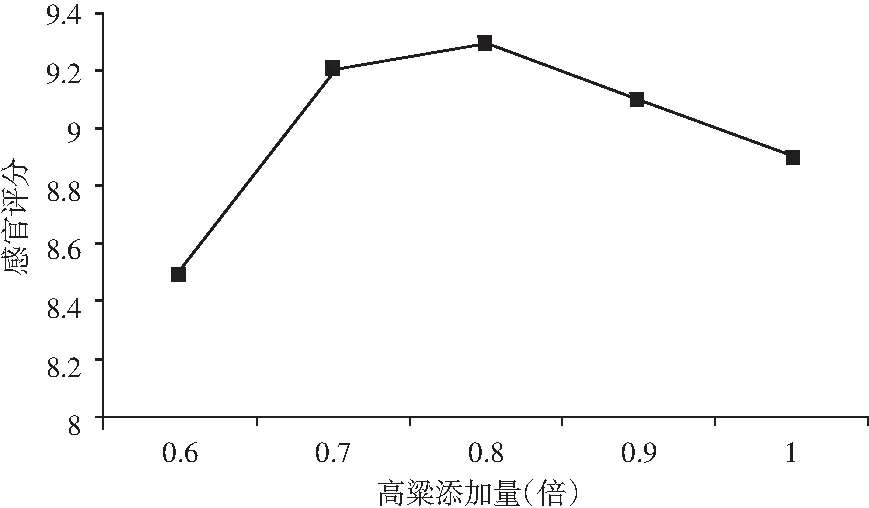
图3 高粱添加量对薏仁糖化醪感官评分的影响Fig.3 Effect of sorghum additive amount on sensory score of coax seed saccharificated mash
由图3可知,高粱添加量为0.8倍时,薏仁糖化醪有较好的感官评分。基于以上综合考虑,选择高粱添加量0.8倍为宜。
2.1.2 料水比的确定
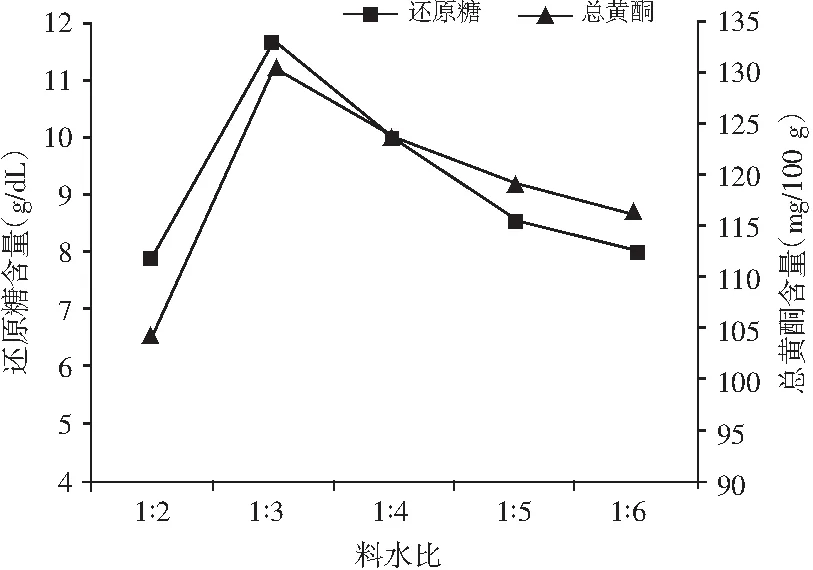
图4 料水比对薏仁糖化醪还原糖及总黄酮含量的影响Fig.4 Effect of material-water ratio on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图4可知,随着水分添加比例的增大,糖化醪还原糖和总黄酮含量呈现先增大后减少的趋势,在料水比为1∶3时取最大值。水分过少,在实验过程中发现糖化醪黏稠,液化困难,还原糖和总黄酮溶出较少,且在生产上也不利于料液的降温和输送[14]。而加水量过多则会导致糖化醪中还原糖和总黄酮浓度较低,不利于后续发酵。故选择料水比为1∶3为宜。
2.1.3 耐高温α-淀粉酶添加量的确定
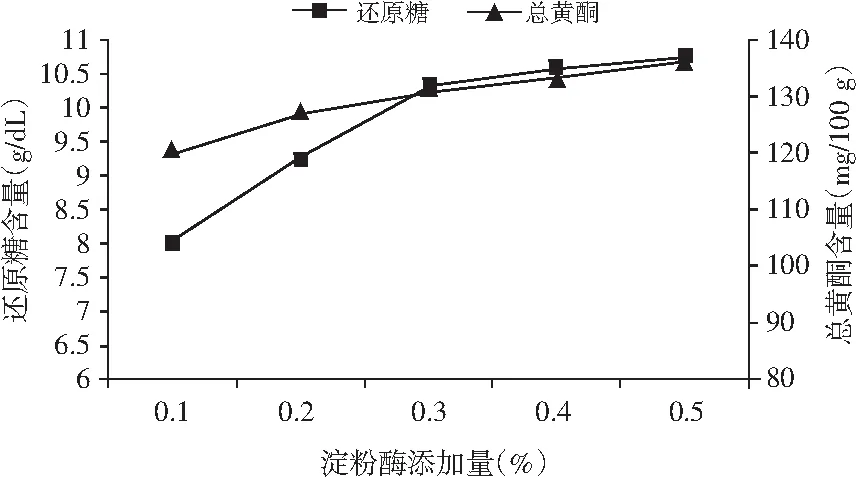
图5 淀粉酶添加量对薏仁糖化醪还原糖及总黄酮含量的影响Fig.5 Effect of α-amylase additive amount on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图5可知,随着淀粉酶添加量的逐渐增多,薏仁糖化醪的还原糖和总黄酮含量迅速增加;但淀粉酶添加量大于0.3%时,还原糖和总黄酮含量基本趋于稳定。这是因为淀粉酶添加量小于0.3%时,淀粉酶质量浓度小于底物质量浓度,糖化反应速率受酶质量影响较大,还原糖和总黄酮含量随着酶量的增大而增加;酶添加量大于0.3%时,随着酶的质量浓度的增加,使得一部分的酶无法与底物接触,从而导致糖化醪还原糖和总黄酮含量基本不再变化。考虑成本因素,选择淀粉酶添加量0.3%为宜。
2.1.4 液化温度的确定
由图6可知,淀粉酶对温度较为敏感,耐高温α-淀粉酶的最适反应温度为80~90 ℃,低于最适温度酶的活力低,不利于其发挥作用,而温度过高又会抑制酶活[15],温度的变化同时也影响着反应速率;薏仁糖化醪还原糖含量受酶活力影响在85 ℃时达到最大值,总黄酮在液化温度的变化过程中,受淀粉酶活力及氧化温度的影响,在80 ℃达到最大值。故选取液化温度80~85 ℃进行下一步试验为宜。
2.1.5 液化时间的确定
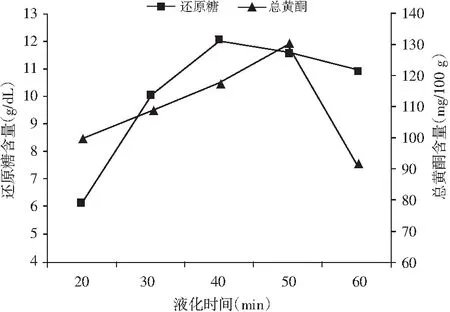
图7 液化时间对薏仁糖化醪还原糖及总黄酮含量的影响Fig.7 Effect of liquefaction time on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图7可知,液化时间对薏仁糖化醪还原糖和总黄酮含量影响均较大,随着液化时间的延长,还原糖和总黄酮呈现先增大后减少的趋势。液化前期底物淀粉浓度较高,此时α-淀粉酶与底物结合充分,使淀粉分子的α-1,4糖苷键断裂,形成小分子的葡萄糖等物质,还原糖含量迅速升高,黄酮类物质也随着液化时间的延长而析出。但较长时间的酶解使还原糖和黄酮结构不稳定发生分解,故选择液化时间40~50 min为宜。
2.1.6 糖化酶添加量的确定
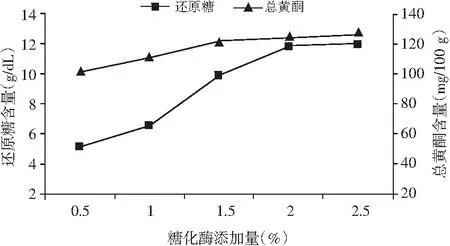
图8 糖化酶添加量对薏仁糖化醪还原糖及总黄酮含量的影响Fig.8 Effect of saccharifying enzyme additive amount on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图8可知,薏仁糖化醪的还原糖和总黄酮含量随着糖化酶添加量的增多而增加,当糖化酶添加量为2.0%时,还原糖含量达到11.8 g/mL,总黄酮含量为123.6 mg/100 g,达到了较高的饱和范围,再继续添加糖化酶量,还原糖和总黄酮含量虽有上升但变化并不明显。从经济成本和糖化程度等因素进行综合考虑,选择淀粉酶添加量2%为宜。
2.1.7 糖化温度的确定
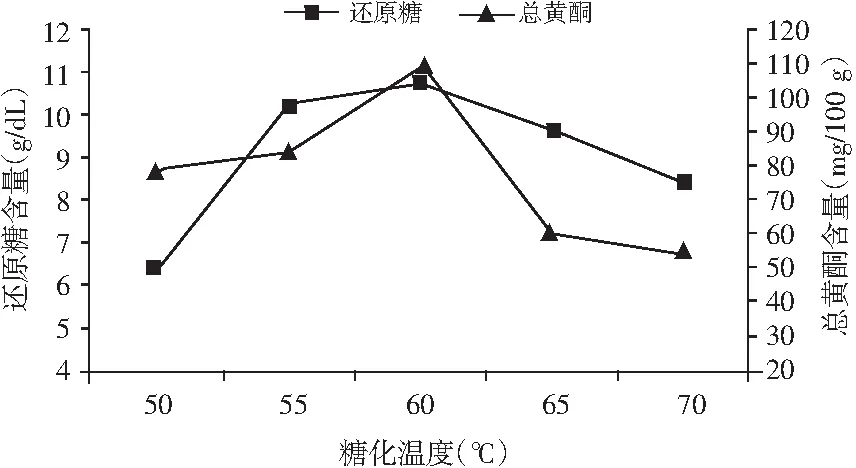
图9 糖化温度对薏仁糖化醪还原糖及总黄酮含量的影响Fig.9 Effect of saccharification temperature on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图9可知,糖化温度对薏仁糖化醪还原糖及总黄酮含量的影响与液化温度对其影响相似,故糖化温度选择60 ℃为宜。
2.1.8 糖化时间的确定
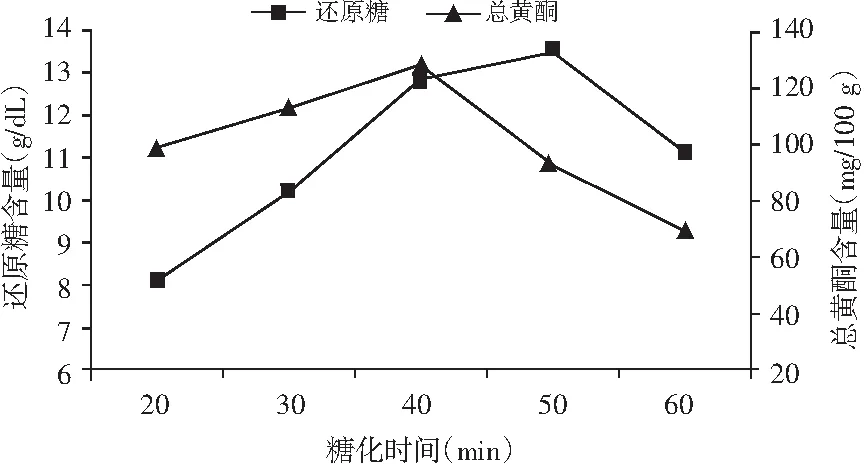
图10 糖化时间对薏仁糖化醪还原糖及总黄酮含量的影响Fig.10 Effect of saccharification time on the content of reducing sugar and total flavonoids in coax seed saccharificated mash
由图10可知,薏仁糖化醪还原糖和总黄酮含量随着液化时间的延长呈现先增大后减少的趋势,其作用机理可能是糖化时间较短使糖化不完全,还原糖和总黄酮析出不充分,而较长时间的糖化过程使还原糖和黄酮结构不稳定发生分解,且在40~50 min阶段,糖化时间的延长对于薏仁糖化醪还原糖含量的增长贡献不足以弥补对总黄酮的破坏程度,故综合考虑选择糖化时间40 min为宜。
2.2 Plackett-Burman试验设计结果
以薏仁糖化醪还原糖含量为响应值,进行8因素12组试验,每组平行测定3次,试验结果见表3。

表3 Plackett-Burman试验因素水平及影响Table 3 Factors and levels of Plackett- Burman experiment

续 表
注:“*”表示影响显著(P<0.05);“**”表示影响极显著(P<0.01)。表6和表7同。
由表3可知,液化温度(P=0.0027)、液化时间(P=0.0072)及糖化酶添加量(P=0.0067)对糖化醪还原糖含量影响极显著;回归方程为:还原糖含量=8.37+0.054A+0.0887B-4.167E-003C+0.43D+0.30E+0.31F+0.13G+0.10H,模型R2=0.9846,具有统计学意义,故Plackett-Burman试验筛选的重要影响因素为液化温度、液化时间和糖化酶添加量,对这3个因素进行下一步的优化,其余影响不显著的因素则根据单因素优化结果取值。
2.3 最陡爬坡试验结果
基于Plackett-Burman试验设计结果,选取液化温度、液化时间和糖化酶添加量3个因素进行最陡爬坡试验,试验结果见表4。
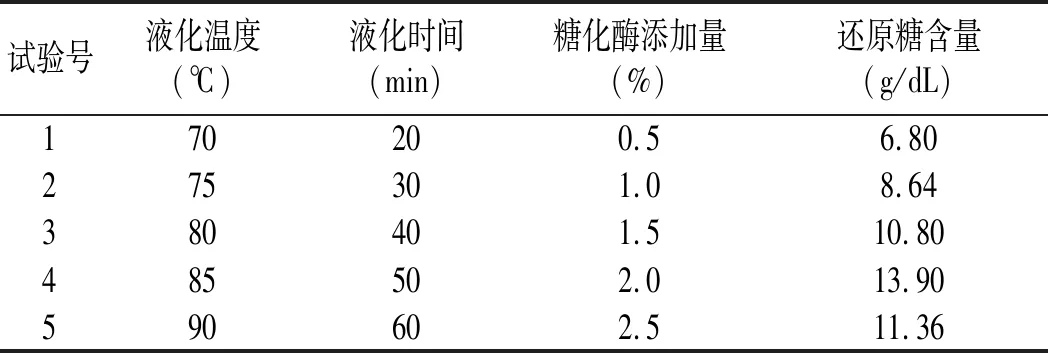
表4 最陡爬坡试验设计及结果Table 4 The steepest ascent experimental design and results
由表4可知,第4组试验得到的还原糖含量最高,故3个因素的中心点分别取为:液化温度85 ℃,液化时间50 min,糖化酶添加量2.0%。
2.4 响应面试验结果
2.4.1 Box-Behnken试验设计方案及结果
以薏仁糖化醪还原糖含量和总黄酮含量为响应值,采用Design-Expert 10软件提供的Box-Behnken试验和响应面分析[16],对试验数据进行处理,试验结果见表5。
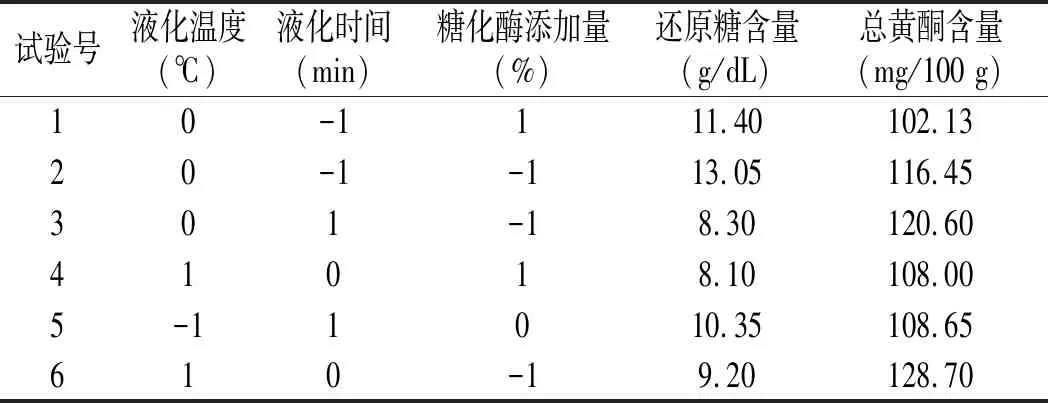
表5 Box-Behnken试验设计及结果Table 5 Box-Behnken experimental design and results
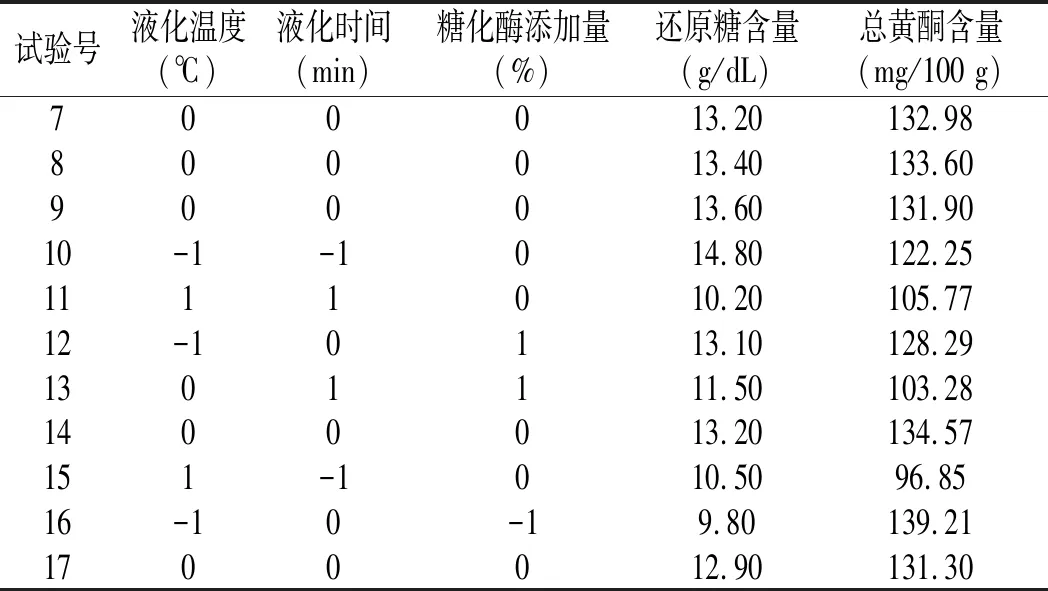
续 表
2.4.2 模型的建立与方差分析
运用Design-Expert 10数据处理软件对表5中数据进行分析,经二次多元回归拟合,结果见表6和表7。
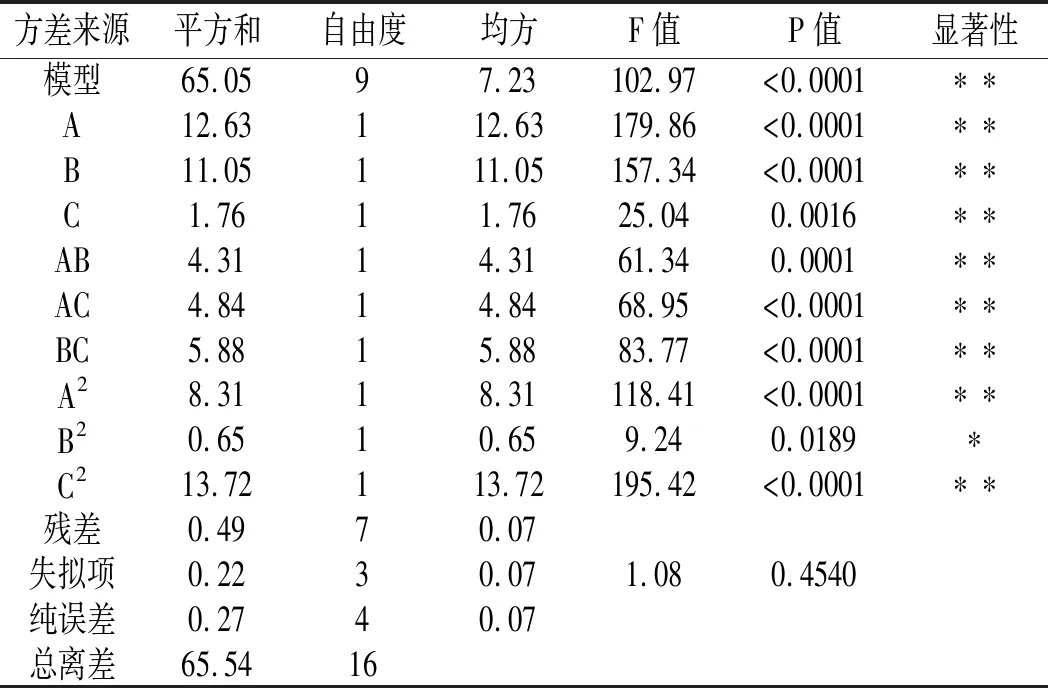
表6 还原糖含量的方差分析Table 6 Analysis of variance of reducing sugar
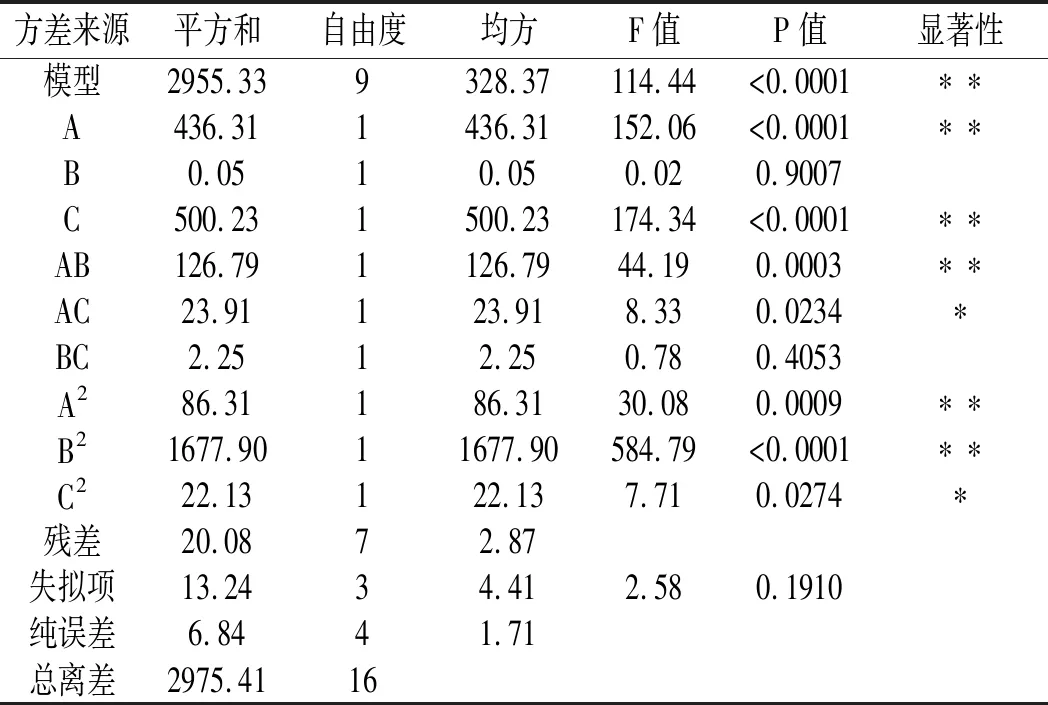
表7 总黄酮含量的方差分析Table 7 Analysis of variance of total flavonoids
方差分析结果显示:2 个模型的P值均小于0.0001,且失拟项P 值均大于0.05,故2个模型均为回归显著型。R12(还原糖含量)=0.9925,R22(总黄酮含量)=0.9932,表明预测值与实验值之间拟合度较高。各因素对薏仁糖化醪还原糖含量的影响大小为:液化温度(A)>液化时间(B)>糖化酶添加量(C),各因素对薏仁糖化醪总黄酮含量的影响大小为:糖化酶添加量(C)>液化温度(A)>液化时间(B)。经过回归拟合,分别得到Y1(还原糖含量)和Y2(总黄酮含量)的二次元回归方程:
Y1=13.26-1.26A-1.18B+0.47C+1.04AB-1.10AC+1.21BC-1.41A2-0.39B2-1.80C2,Y2=132.87-7.39A+0.077B-7.91C+5.63AB-2.44AC-0.75BC-4.53A2-19.96B2-2.29C2。
2.4.3 响应面优化分析
运用Design-Expert 10软件对表5中数据进行处理,绘制出3个因素之间的交互作用对薏仁糖化醪还原糖及总黄酮含量的影响,见图11。
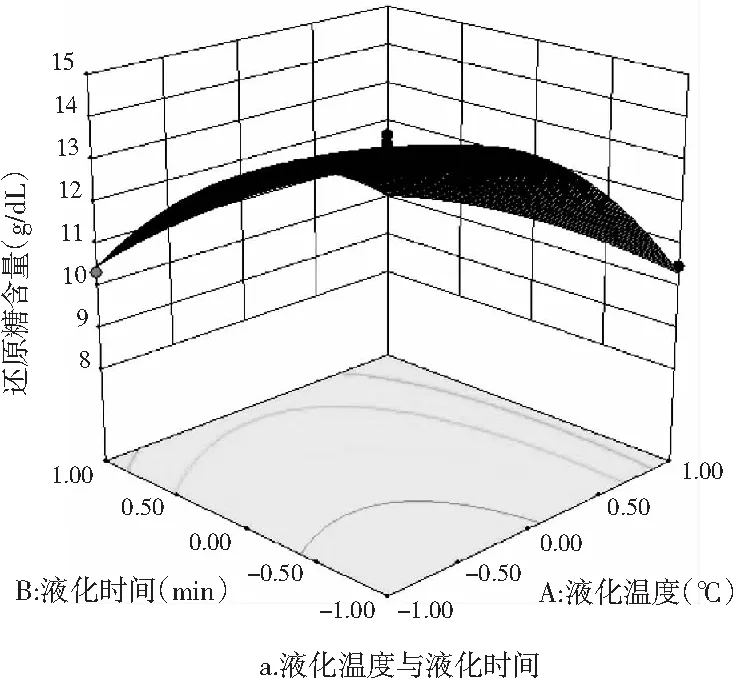
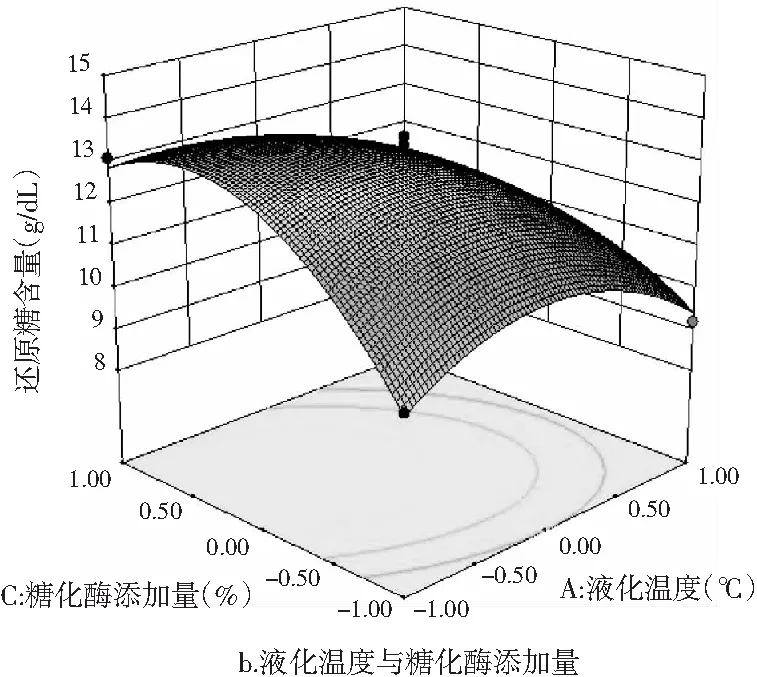
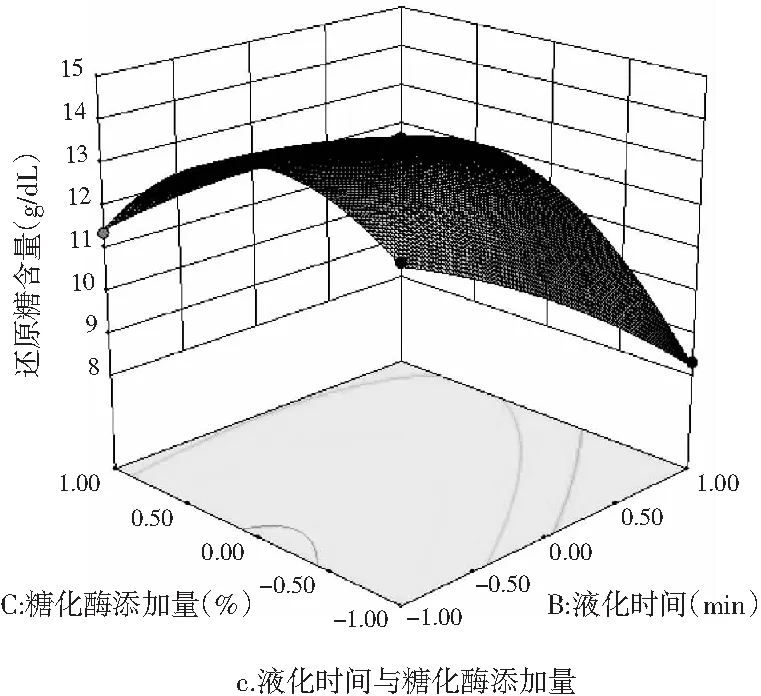
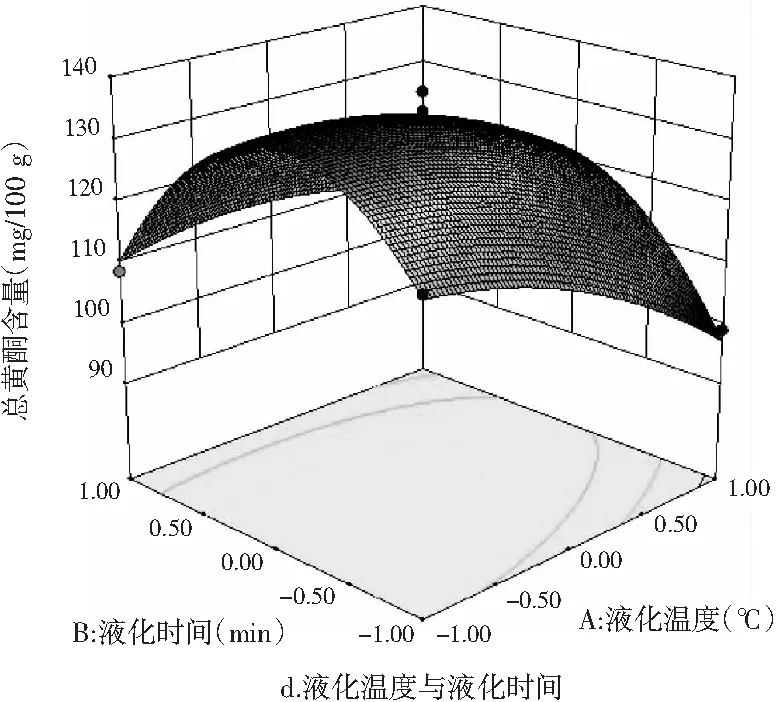
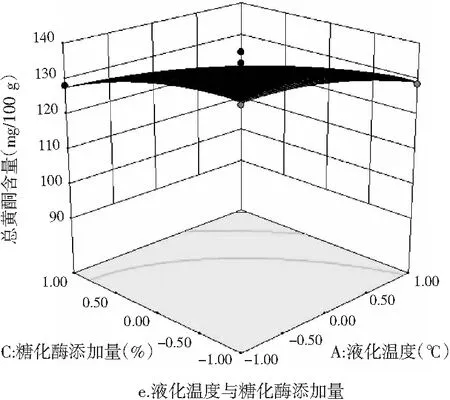
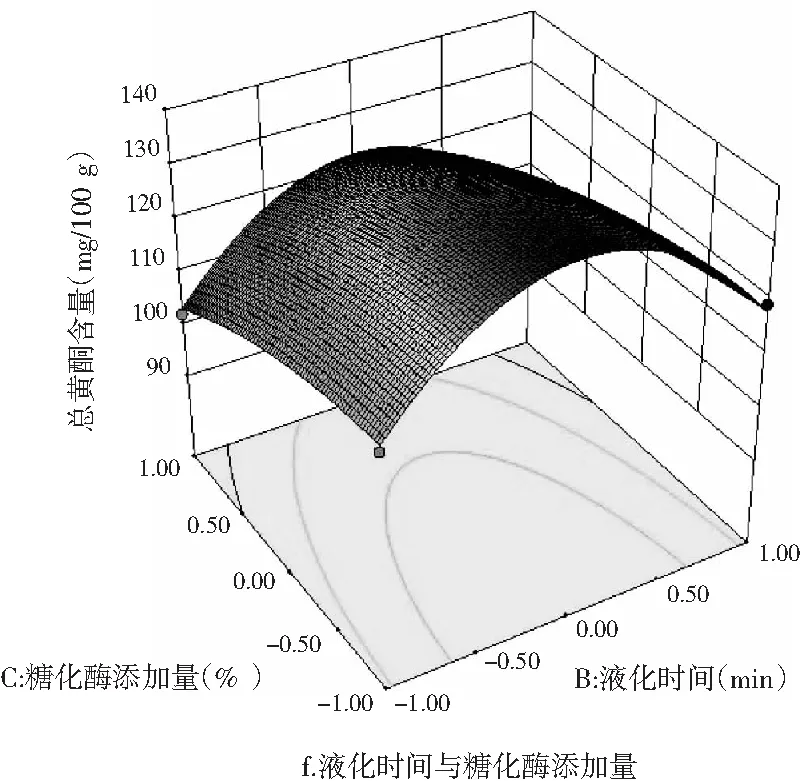
图11 各因素交互作用对薏仁糖化醪还原糖和 总黄酮含量影响的响应面图
由图11中a~c可知,液化温度、液化时间和糖化酶添加量两两交互项均对薏仁糖化醪的还原糖含量产生了显著的影响。由图11中 a和b可知,当液化时间和糖化酶添加量一定时,随着液化温度的升高,糖化醪还原糖含量先增大,达到极大值后开始下降。这是因为液化温度过高,导致还原糖受热不稳定发生分解,而温度过低,则使液化不充分,从而还原糖析出不充分。由图11中a和c可知,当液化温度和糖化酶添加量一定时,随着液化时间的延长,糖化醪的还原糖含量先增大后减少。这是因为液化时间过短使得液化不充分,时间过长则破坏还原糖的稳定性使其分解从而减少。由图11中b和c可知,当液化温度和液化时间一定时,随着糖化酶添加量的增加,还原糖含量同样呈现出先增大后减少的变化。
由图11中d~f可知,液化温度与液化时间的交互作用、液化温度与糖化酶添加量的交互作用均对薏仁糖化醪总黄酮含量影响显著,液化时间与糖化酶添加量的交互作用对总黄酮含量影响不显著。这与方差分析结果一致。
由回归方程拟合得到的薏仁糖化液化及糖化的最优工艺条件为:液化温度81.57 ℃,液化时间47.65 min,糖化酶添加量1.8915%。在此优化条件下薏仁糖化醪的还原糖理论值为13.595 g/dL,总黄酮含量理论值为136.795 mg/100 g。结合实际生产,将以上最优工艺条件调整为:液化温度81.5 ℃,液化时间47 min,糖化酶添加量1.9%。在此条件下重复3次试验进行验证,得到的糖化醪还原糖含量为13.2 g/dL,与预测值相比误差为2.9%;总黄酮含量为136.55 mg/100 g,与预测值相比误差为0.17%,由此可知,利用该模型优化所得的条件准确可靠,具有实际应用价值。
3 结论
本研究设置了高粱添加量、料水比、α-淀粉酶添加量、液化温度、液化时间、糖化酶添加量、糖化温度、糖化时间8个单因素试验,考察其对糖化醪还原糖及总黄酮含量的影响。在单因素的基础上,采用Plackett-Burman试验,快速有效地筛选出显著影响薏仁糖化醪还原糖和总黄酮含量的3个主要因素分别为液化温度、液化时间和糖化酶添加量。通过Box-Behnken试验设计和响应面分析确定了薏仁糖化最优工艺条件为:高粱添加量0.8倍,料水比1∶3,α-淀粉酶添加量0.3%,液化温度81.5 ℃,液化时间47 min,糖化酶添加量1.9%,糖化温度60 ℃,糖化时间40 min。在此条件下得到的薏仁糖化醪还原糖含量可达13.2 g/dL,总黄酮含量可达136.55 mg/100 g。

