HPLC同时测定双乌止痛酊中3种单酯型生物碱的含量
李金慈,陈 琛,王 争,陈 星,闫 冰,苏 华
(东部战区总医院制剂科,江苏 南京 210002 )
双乌止痛酊为东部战区总医院院内制剂,由制川乌、制草乌、制天南星、丁香、细辛等十余味中药组成,具有祛风止痛、舒经活络的功效,临床主要用于治疗关节肿痛、肩周炎、急性扭伤和挫伤等,疗效显著。方中制川乌、制草乌为君药,其主要活性成分为双酯型乌头碱经炮制水解后生成的单酯型生物碱,既为功效成分,同时也是毒性成分。双酯型二帖生物碱毒性最强但性质不稳定,易被水解,其C8位上的乙酰基水解时失去一分子醋酸,得到相应的苯甲酰单酯型乌头原碱类,毒性为乌头碱的1/50~1/500,若继续水解,其C14位上苯甲酰基失去一分子苯甲酸生成醇胺型生物碱,毒性仅为乌头碱的1/2000~1/4000[1]。
目前,关于含制乌头类毒/效成分的成方制剂的质控研究较少。2015年版中国药典共收载了62个含有川乌、草乌或附子的成方制剂,其中仅附桂骨痛片/胶囊/颗粒以高效液相色谱法(HPLC)测定苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的总量[2]。在本院双乌止痛酊原质量标准中,仅规定了苯甲酰新乌头原碱的含量标准[3]。然而,由于乌头产地、批次、炮制工艺等的不同,导致生物碱含量有差异。出于对用药安全的考虑,重新评价该制剂,优化双乌止痛酊的质量控制方法十分必要。因此,本研究拟建立HPLC同时测定双乌止痛酊中3种单酯型生物碱的含量,以期更加全面的控制该制剂的安全性和有效性,并为临床安全使用含乌头类制剂提供依据。
1 仪器与试药
1.1 仪器
Agilent 1260型高效液相色谱仪(美国Agilent公司,包括G1311B四元泵、G1329B自动进样器、G1330B恒温箱、G4212B DAD检测器、OpenLAB CDS ChemStation工作站);HH6型电热恒温水浴锅(国华电器有限公司); FA1604S型电子天平(上海天平仪器厂);AE240型电子分析天平(0.01 mg,梅特勒—托利多仪器有限公司)。以上仪器均检定合格,实验所用玻璃量具均经过校验合格。
1.2 试药
苯甲酰新乌头原碱(批号111795-201604,纯度94.0 %),苯甲酰乌头原碱(批号111794-201705,纯度99.1 %),苯甲酰次乌头原碱(批号111796-201705,纯度98.6 %)均购自中国食品药品检定研究院;乙腈(美国TEDIA公司)、磷酸(美国Aladdin公司)为色谱纯,盐酸(上海九亿化学试剂有限公司)、氨水(南京化学试剂有限公司)、三乙胺(国药集团)、三氯甲烷(上海试四赫化工有限公司)均为分析纯,水为超纯水。双乌止痛酊样品(东部战区总医院制剂科生产)。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent 5TC-C18色谱柱(4.6 mm×250 mm,5 μm);流动相A为乙腈,流动相B为0.05 %磷酸水溶液(三乙胺调pH至6.5),梯度洗脱:0~20 min,15 %~21 % A,20~60 min,21 %~24 % A;流速为1.0 ml/min;检测波长235 nm;柱温30 ℃;进样量20 μl。理论塔板数按苯甲酰新乌头原碱计算不低于3000。苯甲酰新乌头原碱的保留时间约为31 min,苯甲酰乌头原碱的保留时间约为37 min,苯甲酰次乌头原碱的保留时间约为41 min。
2.2 溶液的制备
2.2.1 对照品溶液的制备 分别取苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱对照品适量,精密称定,加异丙醇-三氯甲烷(1:1)溶液分别制成每1 ml含0.5593 mg苯甲酰新乌头原碱、0.1998 mg苯甲酰乌头原碱、0.1980 mg苯甲酰次乌头原碱的溶液,作为对照品储备液。
分别精密吸取上述3个对照品储备液适量,混合,加异丙醇-三氯甲烷(1:1)溶液制成每1 ml含44.744 μg苯甲酰新乌头原碱、15.984 μg苯甲酰乌头原碱、15.840 μg苯甲酰次乌头原碱的混合对照品溶液。
2.2.2 供试品溶液的制备 精密量取双乌止痛酊10 ml至分液漏斗中,加2 %(v/v)盐酸30 ml,充分摇匀,用氨水调pH至10,分别用30,30,20 ml三氯甲烷振摇提取,合并三氯甲烷液,低温(<40 ℃)蒸干,残渣加异丙醇-三氯甲烷(1:1)溶解并定容至5 ml量瓶,经0.45 μm微孔滤膜滤过,即得。
2.2.3 阴性对照溶液的制备 称取处方量除制川乌、制草乌外的其他药材,按双乌止痛酊的制备工艺制成阴性对照样品,按2.2.2项下方法制成阴性对照溶液。
2.3 方法学考察
2.3.1 专属性考察 精密吸取对照品溶液、供试品溶液与阴性对照溶液各20 μl,按2.1项色谱方法进样测定,结果表明在苯甲酰新乌头原碱、苯甲酰乌头原碱和苯甲酰次乌头原碱的保留时间处无干扰,色谱图见图1。
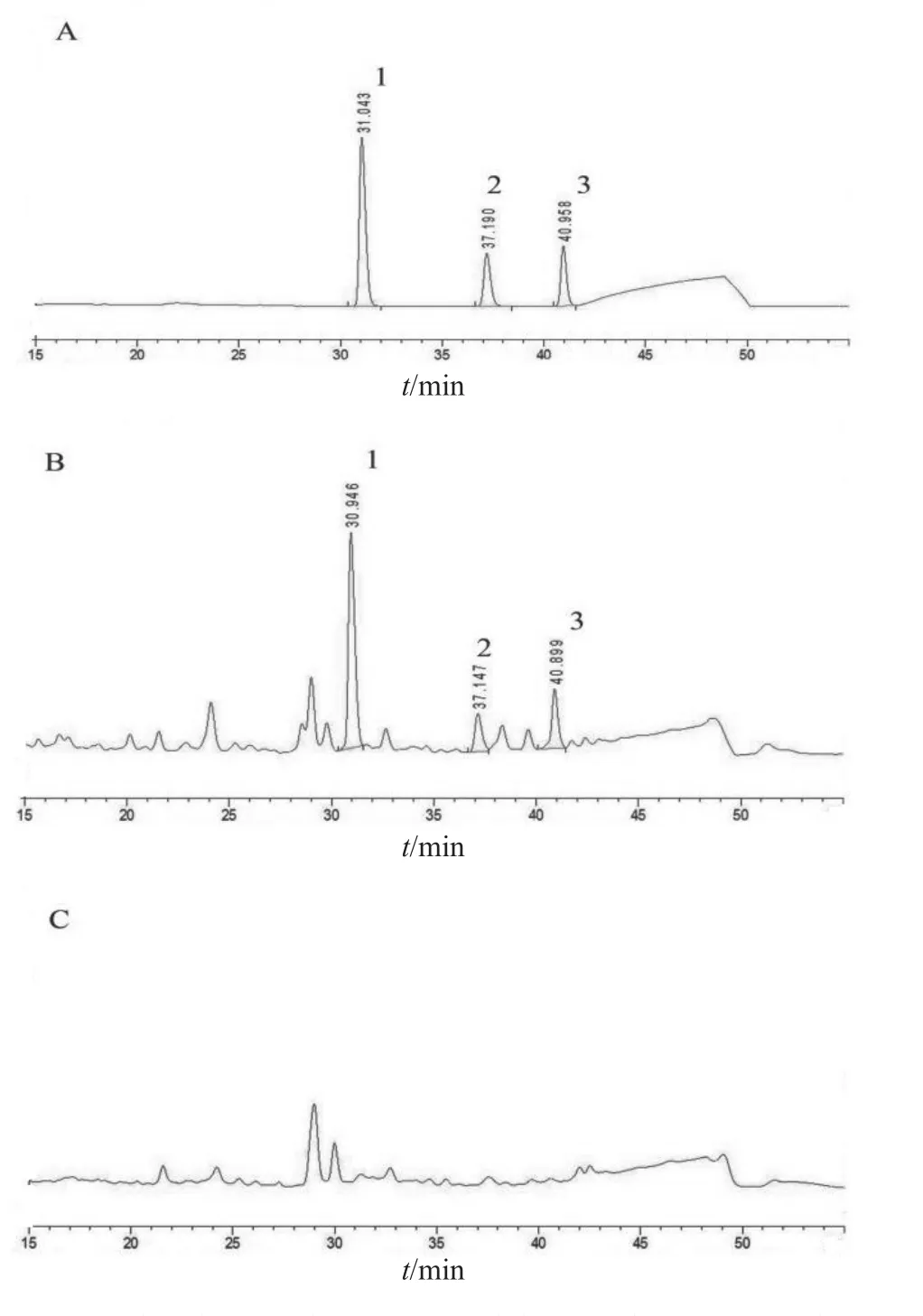
图1 双乌止痛酊HPLC色谱图
分别精密吸取2.2.1项下苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱对照品储备液0.5,1.0,2.0,4.0,8.0,16.0 ml 至50 ml量瓶,用异丙醇-三氯甲烷(1:1)稀释至刻度,得系列混合对照品溶液,按2.1项下方法进行测定,分别以苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱对照品浓度μg/ml为横坐标(X),以峰面积为纵坐标(Y),进行线性回归,回归方程见表1。结果表明,苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的浓度分别在5.593~178.976,1.998~63.936,1.980~63.360 μg/ml之间,与峰面积呈良好的线性关系。

表1 双乌止痛酊中3种单酯型生物碱线性回归方程
2.3.3 精密度试验 取2.2.1项下的混合对照品溶液,按2.1项下色谱条件连续进样6次,测得苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱峰面积RSD分别为0.07 %,0.11 %,1.37 %,结果表明,该方法精密度良好。
2.3.4 稳定性试验 取同一批号(181114)样品,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件,在常温下分别于0,1,2,4,8 h进样,记录峰面积,测得苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱峰面积的RSD分别为1.33 %,1.80 %,3.41 %,结果表明,供试品溶液在8 h内稳定。
2.3.5 重复性试验 取同一批号(181114)样品6份,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进样分析,计算得苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的平均含量分别为25.228,4.273,5.280 μg/ml,RSD分别为2.87 %,2.95 %,2.64 %,结果表明,该方法重复性良好。
2.3.6 加样回收率试验 精密量取9份已知含量的双乌止痛酊样品(批号:181114)5 ml,按低、中、高3个浓度分别精密加入2.2.1项下混合对照品溶液1.5,2.5,3.5 ml,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进样分析,计算回收率,结果见表2,表明该法准确度良好。

表2 双乌止痛酊中3种单酯型生物碱加样回收率试验
2.4 样品的含量测定
取10批不同时间生产的双乌止痛酊,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进样分析测定,结果见表3。

表3 不同批号双乌止痛酊中3种单酯型生物碱含量
3 讨论
乌头类中药在中医临床具有悠久的历史和显著的疗效,主要包括附子、川乌、草乌3种,其中附子有回阳救逆之功,川乌、草乌则长于祛风胜湿止痛。然而此类中药毒性极强,其中乌头碱型生物碱是兼具药理活性和毒性的主要成分。因此,乌头类中药制剂需应用准确可靠的方法进行科学合理的含量测定,使其更加安全合理地用于临床。
3.1 指标成分的选择
目前文献报道的乌头碱型生物碱的含量测定多集中于单一的制川乌、制草乌、附子的药材及炮制品,对于含乌头类中药成方制剂的生物碱含量测定报道相对较少。单酯型乌头原碱类成分是双酯型乌头碱水解后的产物,其毒性大大降低,但仍保留了抗炎、降压、镇痛等药理活性[4]。2015年版药典中也以3种单酯型乌头原碱的总量作为制川乌、制草乌及附子的质控指标,因此本实验选取了3种单酯型生物碱作为双乌止痛酊的含量测定指标,以期建立多成分测定的质控体系,进一步提高其质控标准,保障临床用药的安全有效。
3.2 流动相体系选择
文献报道的单酯型生物碱的分析方法多为乙腈-四氢呋喃-0.1 mol/L 醋酸铵体系[5-7]及乙腈-40 mmol/L醋酸铵(氨水调pH至10)体系[8-9]。鉴于pH为10的流动相体系碱性较强,对仪器及色谱柱要求较高,因此本实验中不予考虑。实验首先参考了2015年版中国药典制川乌的HPLC含量测定方法对苯甲酰新乌头原碱、苯甲酰乌头原碱及苯甲酰次乌头原碱3种成分进行分析,即乙腈-四氢呋喃(25:15)-0.1 mol/L 醋酸铵(每1000 ml加入冰醋酸0.5 ml)梯度洗脱,结果表明,3种成分出峰时间较合适,分别为20,24,26 min,但峰型均较差,拖尾严重。其次,实验中尝试乙腈-0.2 %醋酸(三乙胺调pH至6.2)体系进行梯度洗脱,结果表明,3种单酯型生物碱峰型有较大改善,对照品分离度均较好,但样品分离度达不到要求,且分析过程中基线漂移,因此考虑将醋酸更换为磷酸以使基线稳定。在本色谱体系中,仅加入磷酸不能出峰,必须加入少量的三乙胺后才能出峰,其原因可能是生物碱成分与色谱柱上的酸性硅醇基结合,不能被酸性流动相洗脱下来,而加入三乙胺使流动相呈一定的碱性,可使结合型的生物碱游离出来,被流动相洗脱下来。双乌止痛酊成分极其复杂,进一步样品分析过程表明,苯甲酰乌头原碱和苯甲酰次乌头原碱的分离度并不理想,因此尝试稍微提高流动相体系的碱性以改善分离度,比较pH 6.2,pH 6.5和pH 6.8 3种流动相体系,结果表明,pH 6.5时分离效果最好。
3.3 样品制备方法的选择
在乌头类生物碱含量测定中,文献多采用先酸化再碱化,然后用氯仿、乙醚等有机溶剂提取或萃取制备供试品溶液[7],也有文献采用丙酮沉淀[10]或C18小柱吸附法[11]等。双乌止痛酊的处方组成十分复杂,制备工艺提取的成分极多,本实验采用先酸化酊剂再调pH碱化样品使生物碱游离,最后以有机试剂萃取的方法制备供试品。实验中以3种单酯型生物碱的含量总和为指标,考察了盐酸浓度(0.05 %,1.0 %,2.0 %)、盐酸用量(20,30,40 ml)、pH值(8,10,12)、萃取溶剂(氯仿、乙醚、乙酸乙酯)、溶剂用量(40,80,120 ml)及萃取次数(2,3,4次),结果表明,加入30 ml 2.0 %盐酸后以氨水调pH至10,再以80 ml氯仿分3次萃取时效果最佳。采用乙酸乙酯萃取时,杂质多,目标峰峰型较差,而乙醚则提取不完全,目标化合物含量显著低于氯仿提取的样品。而酸溶氯仿萃取的样品色谱峰干扰稍少,重复性好,准确率高。
4 小结
本文建立了双乌止痛酊中制川乌、制草乌所含的3种单酯型生物碱的HPLC含量测定方法,并对2018年生产的10批样品进行了含量测定。结果表明,3种单酯型生物碱的总含量最低为34.78 μg/ml,最高为70.06 μg/ml,平均为52.02 μg/ml。根据2015版中国药典规定的制川乌、制草乌中单酯型生物碱的含量范围,按双乌止痛酊的处方配比及制剂工艺转移率进行折算,制剂中单酯型生物碱的总含量应在13.5~66.0 μg/ml范围内。本实验中所测的10批样品中有8批处于以饮片含量限度换算的范围内,2批样品含量稍微超出最高限。
双乌止痛酊中制川乌、制草乌既为处方中的有效成分同时也是毒性成分,其单酯型生物碱的含量对双乌止痛酊的质量与安全性会产生很大的影响,含量不达标会降低临床疗效,含量超标则可能引起中毒等不良反应。在制剂生产过程中,饮片质量、生产设备、制剂工艺等因素均可带来制剂质量的差异。本文首次对双乌止痛酊中单酯型生物碱的总量进行测定,补充并提升了其原有的质量评价指标,为该制剂的全面质量控制与临床用药安全提供一定依据。

