基于外部参数正交的无创血糖测量温度校正
葛 晴,韩同帅,刘 蓉,李晨曦,徐可欣
天津大学精密测试技术及仪器国家重点实验室,天津 300072
引 言
使用近红外光谱(NIR)进行人体血糖无创检测是一种很有前途的方法,虽然在相关领域以往的研究中已取得了很好的进展,但迄今为止,尚未见满足临床应用精度要求的研究成果,主要是由于人体背景变化对近红外无创血糖测量光谱的复杂影响,大大削弱了血糖浓度变化的光谱测量信息。在这些复杂的人体背景干扰因素中,体温变化的影响不容忽视: 一方面温度变化会影响皮肤组织的体积,导致组织光谱吸收特性和散射特性变化; 另一方面人体组织含有70%以上的水分,水中在近红外波段的吸收光谱对温度变化非常敏感。Liu等[1]通过蒙特卡罗模型和口服葡萄糖耐量试验(OGTT)全面评估了温度变化对无创血糖测量的影响,结果表明,温度变化是近红外无创血糖测量的主要误差源,其影响占模型总误差的50%以上。
为消除温度的干扰,一方面考虑有效的测量方法,如: 徐可欣等提出了一种浮动参考测量方法[2],该方法基于特定径向距离下漫反射光强不受葡萄糖浓度变化影响的机理,在该距离下测量的光谱可以作为背景参考以消除包括温度变化在内的多种干扰因素的影响。但是,基于浮动基准方法的在体参考测量具有波长特异性和个体差异性,因此需要个性化地设计光学测头方案。另一方面,考虑在光谱分析时,建立更有效的数学模型。人们基于化学计量学提出了多种光谱预处理方法,如正交信号校正(OSC)、广义最小二乘加权(GLSW)[3]以及外部参数正交化(EPO)等。其中EPO方法只需对一个或多个具有代表性的样本进行预实验,模型建立简单。Han等[4]在预测Intralipid水溶液中葡萄糖浓度实验中使用该方法成功地消除了温度对测量的影响,得到了较好的光谱校正效果。
本研究将该方法引入人体血糖无创测量。研究其消除温度变化对血糖漫射光谱影响的可行性。测量中要求干扰信号空间与有用信号空间正交,即温度光谱响应与葡萄糖光谱响应之间彼此正交,而仪器系统漂移,人体出汗等共模干扰常导致两者存在偶然相关,影响了消除温度干扰的效果。因此在进行温度校正之前,首先对原始光谱进行了位置差分处理,以获得具有很高正交性的温度光谱响应和浓度光谱响应。然后,使用EPO方法消除温度变化对光谱的影响。最后通过对校正后的光谱数据进行偏最小二乘回归(PLSR)建模,与未经温度校正的PLSR模型进行比较,利用决定系数(R2)和均方根误差(RMSE)以及主成分数(PCs)对模型的预测能力进行评价,验证了该温度校正方法的有效性。
1 方法与原理
1.1 位置差分参考测量方法
为了消除实际人体实验中存在的多种共模干扰,提出了一种基于位置参考的光谱差分方法,将测量位置处的信号与参考位置处的信号进行差分计算[5]。简要地认为测量过程中,当葡萄糖浓度改变的同时,主要存在以下两种共模背景干扰[5]: (1)测量过程中,影响光强变化的系统漂移影响因子f(t); (2)手掌表皮出汗引起部分光吸收: 光在穿过表皮后,进入汗液,设汗液导致的光强变化符合朗伯比尔定律,汗液中各种成分的等效吸收系数为μaw,汗液吸收光程长为l。
假设t1时刻,在皮肤干燥状态下测量位置处测得的光强为
Is1=f(t1)Is(ls,T1,cg1)
(1)
其中Is为不受系统漂移影响的漫反射光强,f(t)为在t1时刻的系统漂移影响因子,Is1是系统漂移后测得的漫反射光强,ls为测量位置信号的平均光程,cg1为在t1时刻血糖浓度,T1为真皮层温度。
在两个较近的位置,人体温度变化,血糖变化相同,因此参考位置测得的光强为
Ir1=f(t1)Ir(lr,T1,cg1)
(2)
对式(1)和式(2)相比后取对数,得到t1时刻的位置差分吸光度A1
(3)
在t2时刻,相对于t1时刻发生了系统漂移、人机接口处出汗等变化,检测到的光强为Is2
Is2=f(t2)Is(ls,T2,cg2)exp(-μawl)
(4)
式(4)中,T2为变化后的真皮层温度。
同理,由于两个位置是同步测量的,设皮肤温度在两个较近位置相同,皮肤表层的出汗在比较近的两个检测位置是同步,出汗引起的光程变化也相同,因此参考位置处的光谱信号可表示为
Ir2=f(t2)Ir(lr,T2,cg2)exp(-μawl)
(5)
对式(4)和式(5)相比后取对数,得到t2时刻的位置差分吸光度A2
(6)
根据式(3)与式(6)可以发现,尽管检测过程中存在仪器系统漂移与表皮出汗等背景变动,但经位置差分处理后得到的位置差分吸光度A只包含与葡萄糖浓度、真皮层温度相关的信号。
1.2 基于外部参数正交化方法的温度校正
为了消除真皮层温度变化对浓度测量光谱的干扰,对位置差分吸光度光谱进行外部参数正交化(EPO)校正[6]。
差分吸光度光谱A可分解为有用信息和干扰信息,将光谱数据用矩阵形式表达
A=AP+AQ+R
(7)
式(7)中,P和Q分别为有用子空间和干扰子空间上的投影算子矩阵,R为滤波冗余部分,通常来源于随机的测量噪声,可忽略不计。
EPO方法将测量光谱投影到与外部干扰子空间正交的空间,进而消除外部干扰对光谱的影响。因此先求出干扰子空间投影算子Q,再通过式(8)求出有用子空间投影算子P
P=E-Q
(8)
式(8)中,E为单位矩阵。
通常使用主成分分析(PCA)来提取温度干扰空间Q[7],具体步骤为:
首先,将含干扰信息光谱A与不含干扰信息光谱Ar做差,得到差异光谱矩阵D
D=A-Ar
(9)
对D的协方差矩阵进行奇异值分解,得到右奇异矩阵Vs,该矩阵的每一列对应温度干扰空间的一个载荷向量,因此,由Vs张成的空间即为温度干扰子空间,即Q可表示为
(10)
进一步根据式(8)获得有用子空间投影矩阵P。将所有光谱数据均投影到有用子空间中,获得校正后的光谱数据,即
A*=AP
(11)
采用校正后基准温度下的光谱数据进行PLS建模,可预测所有温度下的光谱数据。
2 模拟光谱温度校正
2.1 蒙特卡洛模拟参数设置
考虑到在实际人体实验中,外界测量条件变化、人体自身生理状态变化以及仪器自身存在的误差等干扰会同时存在,难以保证仅温度变化而其他干扰不变,因此为了更明确地研究EPO方法消除人体温度变化的有效性,采用人体三层皮肤模型蒙特卡洛(Monte Carlo)模拟获得光谱数据,模拟参数根据实际人体OGTT实验中体温和血糖浓度水平设置。
Monte Carlo是一种统计模拟随机抽样的方法,广泛应用于模拟各种输运现象,研究光子在散射介质中的传播是Monte Carlo模拟的典型应用之一。人体皮肤表皮层厚度设置为0.3 mm[8],真皮层厚度设置为1 mm[8],皮下组织无穷大,光子数为109,设置波长范围为: 1 000~1 690 nm,间隔10 nm。皮肤各层的光学参数,吸收系数μa、散射系数μs、各向异性因子g和平均折射率n取自文献[9]。
蒙特卡洛模拟具体分为三组,温度与浓度“同时变化组”用于模拟实际OGTT实验; “温度变化组”用于建立EPO温度滤波矩阵; 只有浓度变化的为“浓度变化组”。各组血糖浓度与温度参数设置如表1。

表1 三组模拟血糖浓度与温度参数Table 1 Blood glucose concentration and temperature parameters of the three groups simulation
2.2 位置差分法处理效果分析
为了验证位置差分参考测量方法能够有效地消除仪器系统漂移所带来的共模干扰,这三组模拟均以入射光子数随机变化±1%来模拟仪器系统漂移,获得三层皮肤模型漫反射光强分布,取径向检测距离分别为0.5和2 mm[10]处漫反射光强(用光子数N计算转化得到),然后根据式(6)计算出差分吸光度光谱,通过与单位置光强光谱比较验证差分测量方法的有效性: 在1 000~1 690 nm波长范围内计算单位温度变化引起的光谱能量变化ΔIT(差分后的ΔAT)和单位糖浓度变化引起的光谱能量变化ΔIc(差分后的ΔAc),计算其相关系数如表2。
表2 温度和血糖浓度变化引起光谱变化相关系数
Table 2 The correlation coefficient of spectral change caused by temperature and change caused by glucose concentration

源探距离0.5 mm处correl(ΔIT, ΔIc)=0.842 1源探距离2 mm处correl(ΔIT, ΔIc)=0.843 6位置差分后correl(ΔAT, ΔAc)=0.081 8
位置差分处理前,源探距离为0.5和2 mm的出射光强受仪器系统漂移的影响,使得温度和血糖浓度变化的光谱信息含有共模成分,由于模拟的系统漂移较大(±1%入射光子数变化),且模拟的人体体温变化趋势与血糖变化趋势较为一致,因此单位置处测量的温度光谱响应与浓度光谱响应相关性强,相关系数达到0.84。而经位置差分消除仪器系统漂移的共模影响后,温度变化和浓度变化的光谱响应相关系数仅为0.08。因此,位置差分法可有效消除仪器系统漂移带来的共模干扰。
2.3 EPO方法消除温度干扰
2.3.1 基于EPO方法进行温度校正的可行性


图1(a) 仅温度变化组ΔA(以28.4 ℃的样品为参考,糖浓度为4 mmol·L-1)
Fig.1(a) ΔAcaused by temperature change only (based on 28.4 ℃, the glucose concentration was 4 mmol·L-1)

图1(b) 温度浓度同时变化组ΔA第一主成分的贡献(以28.4 ℃—5.2 mmol·L-1样品为参考)
Fig.1(b) The contribution of the first principal component of ΔAin first group (based on 28.4 ℃—5.2 mmol·L-1)

图2(a) 仅浓度变化ΔA(以5.2 mmol·L-1的样品为参考,温度为30 ℃)
Fig.2(a) ΔAcaused by different blood glucose concentrations (based on 5.2 mmol·L-1, the temperature was 30 ℃)

图2(b) 温度、浓度同时变化组ΔA第二主成分的贡献(以28.4 ℃—5.2 mmol·L-1样品为参考)
Fig.2(b) The contribution of the second principal component of ΔAin first group (based on 28.4 ℃—5.2 mmol·L-1)
主成分分析方法中,不同主成分彼此正交。由第一、第二主成分的正交性可判断: 温度变化光谱和浓度变化光谱正交。进一步通过量化分析的角度,计算单位温度变化和单位糖浓度变化引起的吸光度变化: ΔAT和ΔAc,计算两者内积为1.10×10-4,极小的内积值验证了温度变化光谱和浓度变化光谱正交。
2.3.2 基于EPO温度校正方法的有效性
通过比较EPO处理前后的吸光度光谱特征,说明该方法进行温度校正的有效性。

图3(a) 校正前ΔA(以28.4 ℃—5.2 mmol·L-1组为参考)
Fig.3(a) The change ofAbefore using EPO method (based on 28.4 ℃—5.2 mmol·L-1)
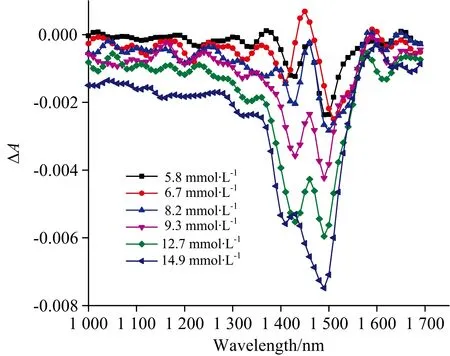
图3(b) 仅浓度变化时ΔA(以5.2 mmol·L-1组为参考)Fig.3(b) The change of A when only concentrationchanges (based on 5.2 mmol·L-1)

图3(c) 校正后ΔA*(以28.4 ℃—5.2 mmol·L-1的样品为参考)
Fig.3(c) The change ofA*after using EPO method (based on 28.4 ℃—5.2 mmol·L-1)
如图3(a)所示,EPO处理前,受温度变化的影响,吸光度变化量达到0.04~0.06。图3(b)为不受温度影响时的吸光度变化量,最大仅为0.008,远小于受温度影响时的吸光度变化量。由此可见,校正前,温度变化对光谱的干扰淹没了反应葡萄糖浓度变化的有用信息。
使用EPO处理图3(a)中受温度干扰的吸光度光谱,得到图3(c)中吸光度光谱变化,发现除了在1 400~1 500 nm处存在奇异的吸收峰,在其余波长位置吸光度变化量随血糖浓度变化呈现较好的梯度特征。主要是由于在1 400~1 500 nm波段存在水的强吸收。图3(c)校正后光谱特征与校正前光谱差异明显,相反,与图3(b)不受温度干扰的光谱特征近似,说明EPO光谱校正方法可以有效地降低温度变化对光谱的影响,同时保留葡萄糖浓度信息。
3 血糖浓度预测模型的建立

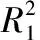

表3 EPO校正前后建模效果对比Table 3 Comparison of the results before and after EPO correction
4 结 论
通过人体三层皮肤模型蒙特卡洛模拟获得光谱数据,经位置差分处理后,使用EPO方法进行温度校正,最后对血糖浓度进行PLSR建模预测。验证了位置差分法能有效消除仪器系统漂移等共模干扰的影响。对差分处理后的吸光度光谱使用外部参数正交化(EPO)方法进行校正,可以有效消除温度对光谱的影响同时保留血糖浓度信息,提高了建模效果。在下一步的研究中,考虑将该温度校正方法应用于实际人体血糖浓度的测量,通过设计OGTT实验验证其有效性。同时可考虑使用EPO方法消除除温度以外的其他干扰,如人机接口压力变化等。

