葡萄糖-6-磷酸脱氢酶基因突变永生化淋巴细胞系的建立
贾峥 张艳艳 孙楠 张文新 高飞 孙晶 黄杰★ 曲守方★
葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)缺乏症是由位于X 染色体长臂2 区8 带(Xq28)的G6PD基因突变导致G6PD 酶合成缺陷引起,是一种以溶血性贫血为主要临床特征的遗传病,常见临床表现有新生儿黄疸、新生儿高胆红素血症、蚕豆病、药物性溶血、某些感染性溶血等[1-2]。本病在我国主要分布在长江流域以南地区,尤以广东、海南、广西、云南、贵州、四川等地为高发区。G6PD 缺乏症患者多数平时无临床症状,早期诊断和干预非常重要。在G6PD 缺乏症的高发地区,应开展G6PD 缺乏症筛查。作为一种X-连锁不完全显性遗传病,男性携带突变(男性半合子)表现为明显的酶活性缺乏,女性携带纯合突变或杂合突变时(称为女性杂合子),发病情况因人而异。部分女性杂合子的酶活性可能接近正常不表现缺乏,因此不易通过酶活性检测发现,可以通过细胞化学染色体法和基因检测等方法明确突变状态[3]。G6PD 缺乏症的分子检测方法,包括荧光探针PCR熔解曲线法、基因芯片、反向点杂交、测序和飞行时间质谱等,提高了女性杂合子的检出率[4-7]。
目前尚无葡萄糖-6-磷酸脱氢酶基因突变的国家参考品,亟需建立相应的国家参考品,用于评价葡萄糖-6-磷酸脱氢酶基因突变试剂盒的质量。葡萄糖-6-磷酸脱氢酶缺乏症作为一种单基因病,该类参考品的制瓶颈是难以保证持续获得临床样本,解决的思路是建立永生化淋巴细胞系或者构建基因编辑细胞系。本院通过建立葡萄糖-6-磷酸脱氢酶基因突变的永生化淋巴细胞系,可以提供长期稳定的遗传资源,并采用二代测序法进行验证。
1 材料方法
1.1 材料
1.1.1 样本来源及处理
经伦理委员会批准,联系珠海市妇幼保健院,招募自愿参与项目的样品捐献者33 人,签署知情同意书。每人抽取10 mL 外周血,血液样本采集到枸橼酸盐或柠檬酸盐抗凝的真空采集管。采集外周血后进行永生化淋巴细胞系建系。
1.1.2 试剂和仪器
RPMI 1640 培养基、胎牛血清(FBS)和青霉素链霉素双抗购自美国GIBCO 公司;人外周血淋巴细胞分离液、环孢霉素A 和二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;葡萄糖-6-磷酸脱氢酶基因突变检测试剂盒(荧光PCR 熔解曲线法)由厦门致善生物科技有限公司提供;基因组DNA提取试剂盒(磁珠法)由深圳华大智造科技有限公司提供;新生儿基因检测试剂盒由华大基因股份有限公司提供。
上海宏石SLAN-96S 全自动医用PCR 分析系统,厦门致善生物科技有限公司提供;MGISEQ-2000 基因测序仪,深圳华大智造科技有限公司提供。
1.2 方法
1.2.1 样本的筛查
使用葡萄糖-6-磷酸脱氢酶基因突变检测试剂盒(荧光PCR 熔解曲线法),按照说明书的操作方法,对样本进行检测。
1.2.2 永生化淋巴细胞系的建立
1.2.2.1 EBV 病毒液的制备 复苏B95-8 细胞株,采用RPMI 1640 培养基加胎牛血清(FBS)进行培养,每隔2~3 天补液一次,逐渐增加培养基的用量。饥饿培养10 天后,收集细胞在液氮及37℃条件下反复冻融3 次,2 000 rpm 离心10 min。收集上清液,使用0.2 μm 滤膜的细胞滤器进行过滤后,备用。
1.2.2.2 单核B 淋巴细胞的分离和转化 取采集的外周血5 mL,加入等体积的含有青霉素链霉素双抗的RPMI 1640 培养基稀释血液。将稀释后的血液缓缓加入已分装在离心管内的淋巴细胞分层液中,2 000 rpm 离心20 min。小心吸取白膜层,转移至新的离心管中,加入含有双抗的RPM1640 培养基8 mL 洗涤2 次,1 500 rpm 离心10 min 后,去上清。然后加入分装好的EBV 病毒液1.5 mL、环孢霉素A 0.4 mL 以及完全培养基重悬细胞沉淀,然后将细胞悬液接种至T25 培养瓶中,将细胞培养瓶置于37℃的5%CO2培养箱进行培养。
1.2.2.3 永生化淋巴细胞系冻存 接种培养24~48 h 后,使用倒置显微镜观察细胞转化情况并拍照。观察细胞状态及聚团大小,适当加入少量完全培养基继续培养。一周后观察细胞聚团数量及细胞状态,进行半换液。待培养液颜色变浅黄,细胞聚团多且密集时,1 300 rpm 离心5 分钟,传代。待细胞培养至足够数量时(3~6×106个/mL),1 300 rpm 离心5 分钟,收集细胞。根据细胞的数量加入含10%DMSO 冻存液,调整细胞冻存浓度,按所需要求将细胞分装至冻存管。然后按照标准冻存操作程序进行梯度降温存储,最终转移至液氮进行长期存储。
1.2.3 永生化淋巴细胞系的验证
将永生化淋巴细胞系取出复苏后进行基因组DNA 提取,使用琼脂糖凝胶电泳检测DNA 的完整性。采用新生儿基因检测试剂盒进行验证。采用酶切的方法将基因组DNA 打断为100~200 bp 左右的DNA 片段,通过末端修复,加A 和接头连接后,进行第一轮PCR 扩增。扩增的PCR 产物采用DNA 探针进行目标区域富集后,使用MGISEQ-2000 基因测序仪进行高通量测序。
2 结果
2.1 样本筛查
采用葡萄糖-6-磷酸脱氢酶基因突变检测试剂盒(荧光PCR 熔解曲线法),根据与探针杂交产物熔点的差异来检测G6PD基因突变。通过比较检测样本在反应液A 和反应液B 体系中FAM、HEX、ROX 和CY5 共8 个检测通道的熔解峰与野生型对照对应通道的熔解峰之间熔点(Tm 值)的差异判断样本是否发生突变。当样本熔解峰与野生型对照对应熔解峰差异(ΔTm 值)在±1℃以内的即为野生型峰,差异超过±2℃的即为突变型峰,最后筛查出不同突变类型的样本。33例样本的筛查结果可见表1。CNGB030108 样本在反应液A 体系CY5 检测通道出现野生峰和突变峰的融合峰,而其它7 个通道的熔解峰均为野生峰,且突变峰与野生型对照的熔解峰差异在(-4.8℃)~(-3℃)范围内,表明是1376(G>T)杂合型突变;在反应液B 体系ROX 检测通道出现野生峰和突变峰的融合峰,而其它7 个通道的熔解峰均为野生峰,且突变峰与野生型对照的熔解峰差异在5.19℃~6.41℃范围内,表明是519(C>T)杂合型,见图1。
2.2 永生化淋巴细胞系的建立
采用EBV 转化加环孢霉素A 法,共完成33例样本建系,其中27例样本建系成功,6例因细菌污染导致失败,建系成功率为81%,复苏成功率为100%,可以传代用于实验研究。在倒置显微镜下可观察到细胞转化后96 h 内,细胞体积明显增大,聚团生长的细胞团增多;转化2 周后,肉眼可见细胞聚团物,显微镜下观察大量细胞聚团;转化培养3~4 周后,显微镜下观察细胞外壁呈不规则毛刺状突起,增殖旺盛,表明建系成功,见图2A~图2C。

表1 样本的筛查结果Table1 The screening results of samples
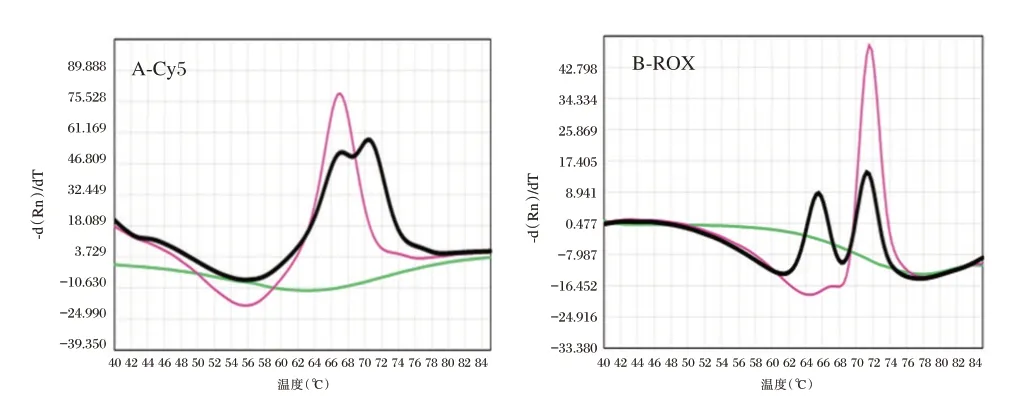
图1 CNGB030108 样本筛查结果Figure1 The screening result of CNGB030108
2.3 永生化淋巴细胞系的验证
用基因组DNA 提取试剂盒提取的永生化淋巴细胞系样本基因组DNA,使用0.8%琼脂糖凝胶电泳,结果显示DNA 条带完整,没有拖带或弥散带,表明基因组DNA 具有很好的完整性。
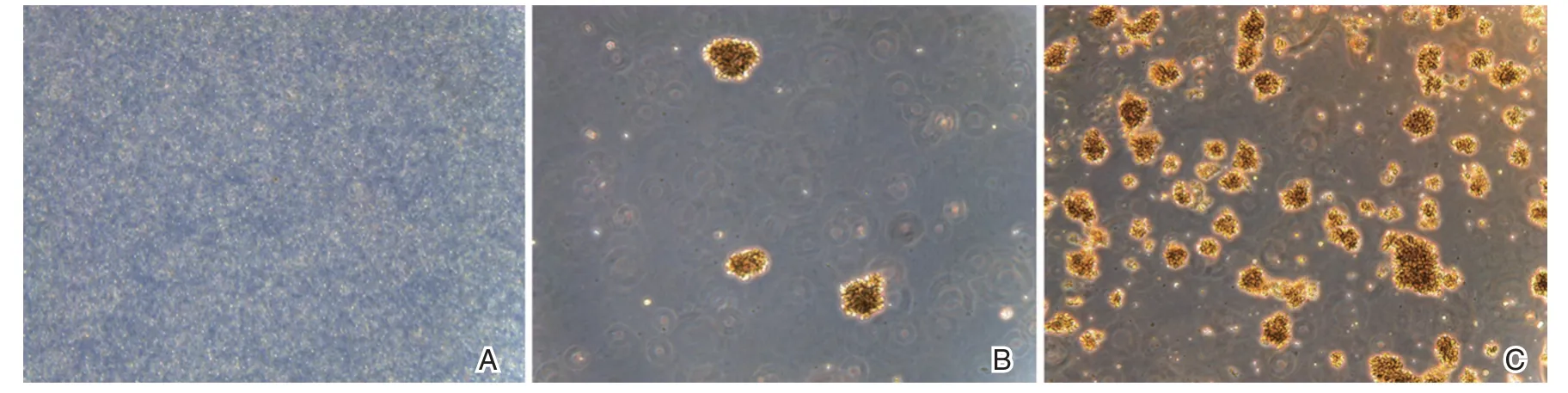
图2 永生化淋巴细胞系转化第0、15 天和30 天结果(×50)Figure2 The result of immortalized lymphocyte cell line transformation on day 0,day15 and day 30(×50)
采用高通量测序法进行验证,样本的结果均与采用荧光PCR 熔解曲线法筛查的结果一致,见图3和表2。CNGB030108 样本的测序结果显示在X 染色体153 762 678 bp(人类基因组hg19)位置处检测到94 条reads 支持C 碱基(正向是G 碱基)和108 条reads 支持T 碱基(正向是A 碱基),表明是c.519 C>T 杂合突变;在X 染色体153 760 484 bp 位置处检测到60 条reads 支持G 碱基(正向是C 碱基)和68 条reads 支持T 碱基(正向是A 碱基),表明是c.1 376 G>T 杂合突变。

图3 CNGB030108 样本测序结果Figure3 The sequencing results of CNGB030108
3 讨论
永生化指体外培养的细胞经过自发的或受外界因素的影响从增殖衰老危机中逃离,从而具有无限增殖能力的过程。目前应用最多的方式是使用EB 病毒(EBV)转化人外周血淋巴细胞从而获得的一种能够连续分裂、永久生存的B 淋巴细胞株,每株细胞含有正常的二倍体组型并且含有供者完整的遗传信息。在B 淋巴细胞转化过程中加入环孢霉素A,可以抑制T 淋巴细胞的免疫杀伤活性,有效阻止T 淋巴细胞对已转化的B 淋巴细胞的攻击,从而提高转化效率。获得的永生化细胞系在连续培养传代过程中染色体稳定,可获取足量的细胞遗传资源用于研究。世界上基因细胞遗传资源存储机构包括英国生物样本库(UK Biobank)、美国国立卫生研究院(National Institutes of Health,NIH)、美国国家人类基因细胞库(The NIGMS Human Genetic Cell Repository),均将其作为最主要的技术法方法保存细胞遗传资源[8-9]。

表2 永生化淋巴细胞系样本验证结果Table2 The verification results of immortalized lymphocyte cell lines
我国常见的致病性G6PD基因变异类型包括c.95A>G、c.392G>T、c.487G>A、c.493A>G、c.592C>T、c.1024C>T、c.1360C>T、c.1376G>T、c.1388G>A,这9 种变异占总变异的90%以上[10]。本研究采用葡萄糖-6-磷酸脱氢酶突变类型的外周全血样本,经过EB 病毒诱导分化,最终成功建立了葡萄糖-6-磷酸脱氢酶基因突变的永生化淋巴细胞系,包括葡萄糖-6-磷酸脱氢酶基因c.392G>T 纯合和杂合突变、c.871G>A 纯合和杂合突变、c.95A>G 纯合和杂合突变、c.1388G>A 纯合和杂合突变、c.1376G>T纯合和杂合突变、c.1360C>T 杂合突变、c.1024C>T纯合和杂合突变、c.519 C>T 杂合突变,涵盖了我国常见的突变类型。同时对建系成功的永生化淋巴细胞株进行高通量测序方法的验证,结果表明葡萄糖-6-磷酸脱氢酶基因突变的永生化淋巴细胞系基因组DNA 的结果与临床样本的标示结果一致。该永生化淋巴细胞系的遗传信息稳定,可作为国家参考品的遗传资源,用于评价葡萄糖-6-磷酸脱氢酶基因突变检测试剂盒的质量。

