基于实时荧光RT-PCR的新型冠状病毒的不同标本类型核酸检测
周刚 李超 郑国栋 柳洪涛 周荣荣 王洪涛 王刚平
新型冠状病毒(Severe Acute Respiratory SyndromeCoronavirus-2,SARS-CoV-2)感染正席卷全球多个国家爆发流行,感染人数不断攀升[1]。截止到2020年3月26日,SARS-CoV-2 在我国确诊人数已超过8 万余人,全球其他国家感染人数已达37 万余人并不断持续上升,对全球公共卫生安全构成了巨大威胁[2]。SARS-CoV-2 的传染源有SARS-CoV-2 感染患者及无症状感染者[3],尤其是无症状感染者的存在可导致疑似感染者及密切接触者数量大量增加,加速疫情的蔓延。新型冠状病毒肺炎的诊断基于流行病学史、临床表现及影像学表现,而病毒的核酸检测可为其诊断提供直接证据[4-5],促进患者的隔离、治疗和评估,同时还能为疫情防控中心及时切断传播途径、有效控制传染源提供指导,保障疫情的防控。根据新型冠状病毒肺炎诊疗方案(试行第七版),可采用基因测序、实时荧光聚合酶链反应(Real-Time Polymerase Chain Reaction,RT-PCR)对SARS-CoV-2 感染者进行病毒核酸检测进而确诊患者,而RT-PCR技术因其操作简单、耗时短、成本低而在临床上得到广泛应用[6]。本研究采用实时荧光RT-PCR 法对疑似SARS-CoV-2 感染患者进行了SARS-CoV-2核酸检测,及时对疑似患者进行快速有效的诊断,为疫情防控提供支持与指导。
1 材料与方法
1.1 样本来源
收集2020年1月至2020年2月送至本中心的2 258例疑似SARS-CoV-2 感染患者标本共3 284人份,其中,男性1380例(61.12%),女性878例(38.88%);年龄范围为6 个月~91 岁,平均年龄为(35.49±16.13)岁。将符合《新型冠状病毒肺炎诊疗方案(试行第七版)》疑似病例描述的疑似感染者标本均纳入本研究中,采样失败或者流行病学史不明确、临床表现不符合者均剔除。
1.2 试剂和仪器
病毒核酸提取试剂盒、病毒核酸提取仪Smart 32、荧光定量RT-PCR 试剂均为中山大学达安基因股份有限公司提供;阳性标本复核试剂由上海伯杰医疗科技有限公司提供;PowerMicrobiome™RNA Isolation Kit 由德国Qiagen 公司提供,Applied Biosystems™QuantStudio™1&3&5(以下简称Q5)实时定量PCR 仪由美国赛默飞世尔科技公司提供。
1.3 标本前处理与病毒RNA 提取
提前将水浴箱预热至56℃,在生物安全柜内用75%乙醇对装有标本的密封袋进行喷洒消毒,用吸水纸擦拭后放入浴锅中的试管架上,标本盖搁置重物防止试管架浮动。每隔10 min 将标本轻轻摇匀1 次,灭活时间为45 min[7-8]。将灭活好的标本从水浴锅中取出,在生物安全柜内对密封袋进行消毒,打开密封袋后,即时用75%酒精消毒。
咽拭子/痰液:取出样本后混匀,参照病毒核酸提取试剂盒说明书进行操作,加入20 μL 蛋白酶K,吸取离心后的标本悬液上清200 μL,加入到预混的深孔板,于生物安全柜静置10 min 后,置于病毒核酸提取仪Smart 32 上提取病毒核酸。程序运行结束后,吸取核酸转置于1.5 mL 离心管,直接用于实时荧光RT-PCR。由于RNA 容易降解,短暂存放可置于-20℃冷冻,长时间保存需置于-70℃或以下。
粪便标本:将送检标本取黄豆粒大小(约0.25g)置于1.5 mL 离心管中,采用PowerMicrobiome™RNA Isolation Kit 粪便RNA 提取试剂盒提取粪便中的核酸,严格按照说明书进行操作。
1.4 PCR 扩增
采用新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光PCR 法)针对ORF1ab基因和核壳蛋白N基因进行PCR 扩增,使用仪器为Q5 实时定量PCR仪,扩增程序如下:50℃15 min;95℃15 min;94℃15 s;55℃45 s,45 个循环;结果判读:如果检测标本在FAM 和VIC 通道无扩增曲线或Ct 值>40,且Cy5 通道有扩增曲线,可判样品未检测到2019 新型冠状病毒(2019-nCoV)RNA;如果检测标本在FAM 和VIC 通道Ct 值≤40,且有明显的扩增曲线,可判样品为2019 新型冠状病毒(2019-nCoV)阳性;如果检测标本仅在FAM 或VIC 单一通道Ct 值≤40,另一通道无扩增曲线,结果需复检,复检结果一致可判样品为2019 新型冠状病毒(2019-nCoV)阳性,复检均为阴性可判断为未检测到2019 新型冠状病毒(2019-nCoV)RNA。
1.5 统计学分析
采用SPSS19.0 软件进行数据处理,计数资料用n(%)表示,计数资料组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 疑似SARS-CoV-2 感染者检测结果
共收集2 258例疑似SARS-CoV-2 感染者标本3 284 人份,其中1 539例为单份样本;824例为双份标本,921例为三份标本;因921 人份样本中只检测出1 份阳性,故不纳入统计;将单一样本类型与两种样本类型阳性检出率进行统计分析,差异有统计学意义(P<0.05),增加样本类型可以提高阳性检出率3 284 人份样本中共检出阳性样本79 人份;其中包括男性疑似感染者13例,女性7例,性别阳性检出率差异无统计学意义(P>0.05),见表1。
此外,在对20例疑似感染者重新采样复检时发现,有4例疑似感染者检测结果出现三次阴阳互转的现象,还有1例疑似感染者多次口咽拭子、鼻咽拭子核酸检测结果均呈阴性,而痰液标本检测结果呈阳性的现象。
2.2 不同样本类型核酸检测结果
采用实时荧光PCR 方法检测,结果显示,在四种样本类型中,鼻咽拭子与痰液标本检测结果差异无统计学意义(P>0.05),而其他三种样本类型与其它样本类型检测结果的差异有统计学意义(P<0.05),其中口咽拭子阳性检出率最低,鼻咽拭子、痰液标本相对口咽拭子较高,而粪便标本阳性检出率最高(本组粪便的样本量较小)。详见表2。

表1 疑似SARS-CoV-2 感染者核酸检测结果及男女阳性检出率比较[n(%)]Table1 Nucleic acid detection results of SARS-CoV-2 suspected patients and the positive rate in Male and Female groups[n(%)]
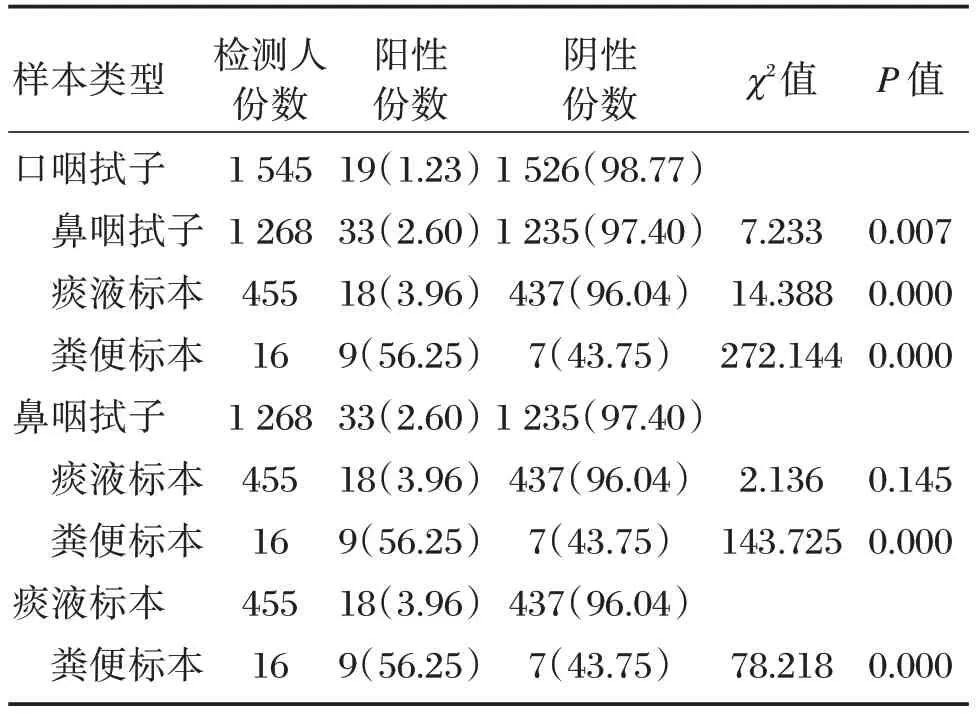
表2 疑似SARS-CoV-2 感染者不同类型标本核酸检测结果比较[n(%)]Table2 Comparison of nucleic acid detection results of SARS-CoV-2 suspected patients[n(%)]
2.3 同一疑似感染者、同一时间不同标本类型病毒核酸检测结果
303 人次同一时间同时取口咽拭子、鼻咽拭子及痰液标本采用实时荧光RT-PCR 的方法进行病毒检测,3 种样本类型中仅痰液标本检出1 人份阳性,3 种标本相比,阳性检出率差异无统计学意义(P>0.05);4 人次同一时间同时取口咽拭子、鼻咽拭子及粪便标本进行检测,未检出阳性样本;280人次同一时间同时取口咽拭子和鼻咽拭子标本进行检测,两者阳性检出率差异无统计学意义(P>0.05);132 人次同一时间同时取鼻咽拭子和痰液标本进行检测,两者阳性检出率差异无统计学意义(P>0.05);见表3。

表3 同一疑似感染者、同一时间不同标本类型核酸检测结果[n(%)]Table3 SARS-CoV-2 nucleic acid detection results at the same time in the same suspected patient with different sample types[n(%)]
3 讨论
目前,全球疫情仍处于严峻的形势。且SARSCoV-2 感染尚未有特效治疗方法,及早发现感染者仍为疫情防控的关键。病毒的核酸检测可快速诊断SARS-CoV-2 感染,为临床治疗提供依据、为防控隔离提供指导,阻止疫情扩散。
本研究针对疑似SARS-CoV-2 感染者的口咽拭子、鼻咽拭子、痰液标本及粪便标本的检出阳性检出率与其他研究者阳性检出率差异比较大[9],主要原因为疫情发病地域不同,疫情与非疫情区;单一样本类型与两种样本类型阳性检出率的统计结果提示,对高度可疑的病人,临床有必要增加标本类型,提高阳性检出率。此外,本研究中性别阳性检出率差异无统计学意义,该统计结果也与Rui Liu 等[9]的结果不一致,在国内其他研究中也有报道重症患者中男性多于女性[10],这可能与本研究来自非疫情区,阳性样本数过少有关。
本研究还观察到4例疑似感染者检测结果出现三次阴阳互转的现象,还有1例疑似感染者多次口咽拭子、鼻咽拭子核酸检测结果均呈阴性,而痰液标本检测结果呈阳性的现象。疫情爆发后,有研究针对SARS-CoV-2 核酸检测假阴性问题进行过探讨,造成假阴性的原因有很多,标本采集、检测方法、产品稳定性等因素都可能影响检测结果[11-12];有报道称拭子样本采用目前现有的RT-PCR 试剂盒,阳性检出率预估值为30%~50%[13]。因此,在确诊SARS-CoV-2 感染的过程中应综合分析疑似患者的流行病学史、临床症状以及影像学证据,必要时多次、多样本类型综合检测以避免假阴性结果。
目前SARS-CoV-2 核酸检测最常用的标本类型为口/鼻咽拭子,有研究显示口咽拭子阳性检出率最低,与本研究结论一致[14]。SARS-CoV-2 最早确认的传播途径是飞沫传播和接触传播,随着对SARS-CoV-2 病毒的研究与核酸检测的科技攻关,且有研究首次在确诊病例粪便中检测到了SARSCoV-2 病毒[15],使得粪便标本在临床患者筛查中成为重要的样本类型;本研究中粪便样本取样不多,大多数为初次/多次检测阳性者,故粪便样本阳性检出率高达56.25%,与吴冰珊等[16]的研究结论一致。
临床反馈及研究都显示单一的咽拭子样本进行病毒核酸检测时会出现时阴时阳的现象,或出现咽拭子多次检测阴性而粪便核酸检测阳性的情况。因此,本研究对同一疑似感染者、同一时间不同标本类型病毒核酸检测结果进行统计分析,结果显示与王云等的结论一致[17],多样本类型的一致性可为临床提供更清晰明确的指导。
目前,SARS-CoV-2 仍属于未知病毒,人类对其在体内的活动过程尚未完全清晰掌握,仍需要更多的研究来支持与指导临床工作。本研究提示多种标本类型的联合检测可能提高检出率,为防控切断传播途径,尤其是无症状感染者的传播提供更准确的判断。

