机器人与腹腔镜肿瘤剜除术治疗胰头部胰岛素瘤的对比研究
赵之明,尹注增,姜 楠,许 勇,赵国栋,高元兴,谭向龙,刘 荣
(中国人民解放军总医院第一医学中心肝胆外二科,北京,100853)
胰岛素瘤又称胰岛β细胞瘤,90%以上为胰岛β细胞的良性肿瘤,且90%为单发,约90%位于胰腺内,直径通常<2 cm,发生在胰头、体及尾部各占1/3[1]。手术切除是目前根治胰岛素瘤的唯一有效方法,近年国内外陆续报道了腹腔镜胰岛素瘤切除术的成功经验[2-3]。本团队前期的研究发现,近端胰岛素瘤常常邻近主胰管、肠系膜血管等重要解剖结构,胰头部尤其钩突部胰岛素瘤的腹腔镜切除相对难度较大[4-5]。达芬奇机器人手术系统具有放大的3D高清视野、机械手臂高度灵巧与精细操作等优势,在胰腺微创手术方面得到了广泛应用[6],但达芬奇机器人手术系统在近端胰岛素瘤的应用中是否具有优势,文献报道较少。本文现总结分析机器人与腹腔镜胰头部胰岛素瘤切除术的应用价值及临床差异。
1 资料与方法
1.1 临床资料 回顾分析2016年1月至2019年10月解放军总医院肝胆外二科采用腹腔镜及机器人行胰头部胰岛素瘤切除术的22例患者的临床资料,见表1。纳入标准:(1)术前经内分泌科诊治,定性诊断为胰岛素瘤患者;(2)术前增强CT或MRI、超声造影及DSA等定位肿瘤位于胰头部,符合胰腺肿瘤剜除术指征[7];(3)术后病理检查证实为胰腺神经内分泌肿瘤。排除标准:(1)恶性胰岛素瘤;(2)胰岛素瘤复发;(3)多发性内分泌肿瘤(MEN-1或MEN-2)。
1.2 手术方法
1.2.1 体位及穿刺孔布局 常规取头高脚低30~45°位,机器人手术还需采用低分腿位。腹腔镜与机器人穿刺孔位置采用我科模式化的布局方案[4,8]。
1.2.2 胰头部胰岛素瘤的显露 (1)传统入路:打开胃结肠韧带,游离胰颈下缘,游离结扎胃结肠干(Helen干),解剖出肠系膜上静脉及门静脉;完成Kocher切口,游离十二指肠、胰头部,解剖出下腔静脉及左肾静脉。(2)横结肠系膜入路:将大网膜及横结肠向上翻起,小肠推向左侧,显露横结肠系膜根部,打开结肠中血管右侧无血管区,即可显露十二指肠降段与水平段。分离胰腺被膜与右侧横结肠系膜之间的融合筋膜,比较容易显露出肠系膜上静脉。离断汇入胃结肠静脉干的右结肠静脉后,即可完整显露胰头钩突的腹侧面。游离十二指肠侧腹膜及胰头后方融合筋膜,将胰头十二指肠向左上翻起,即可完整显露胰头及钩突的背侧面。
1.2.3 肿瘤剜除 凸出胰腺表面的肿瘤,用超声刀或电钩沿肿瘤边界完整剜除肿瘤。肿瘤位于胰腺实质内时,常规采用术中超声定位肿瘤、边界及其与主胰管、胆总管的关系。肿瘤距主胰管较近(2~3 mm)时,可于术前1 d行ERCP胰管支架置入,为术中超声提供指引,并预防主胰管的严重损伤。也可用5-0 Prolene缝合一针牵拉肿瘤,紧贴肿瘤被膜仔细分离,可防止损伤胰管及胆管(图1)。肿瘤切除前、后测量血糖,切除的标本立即送术中冰冻病理检查。
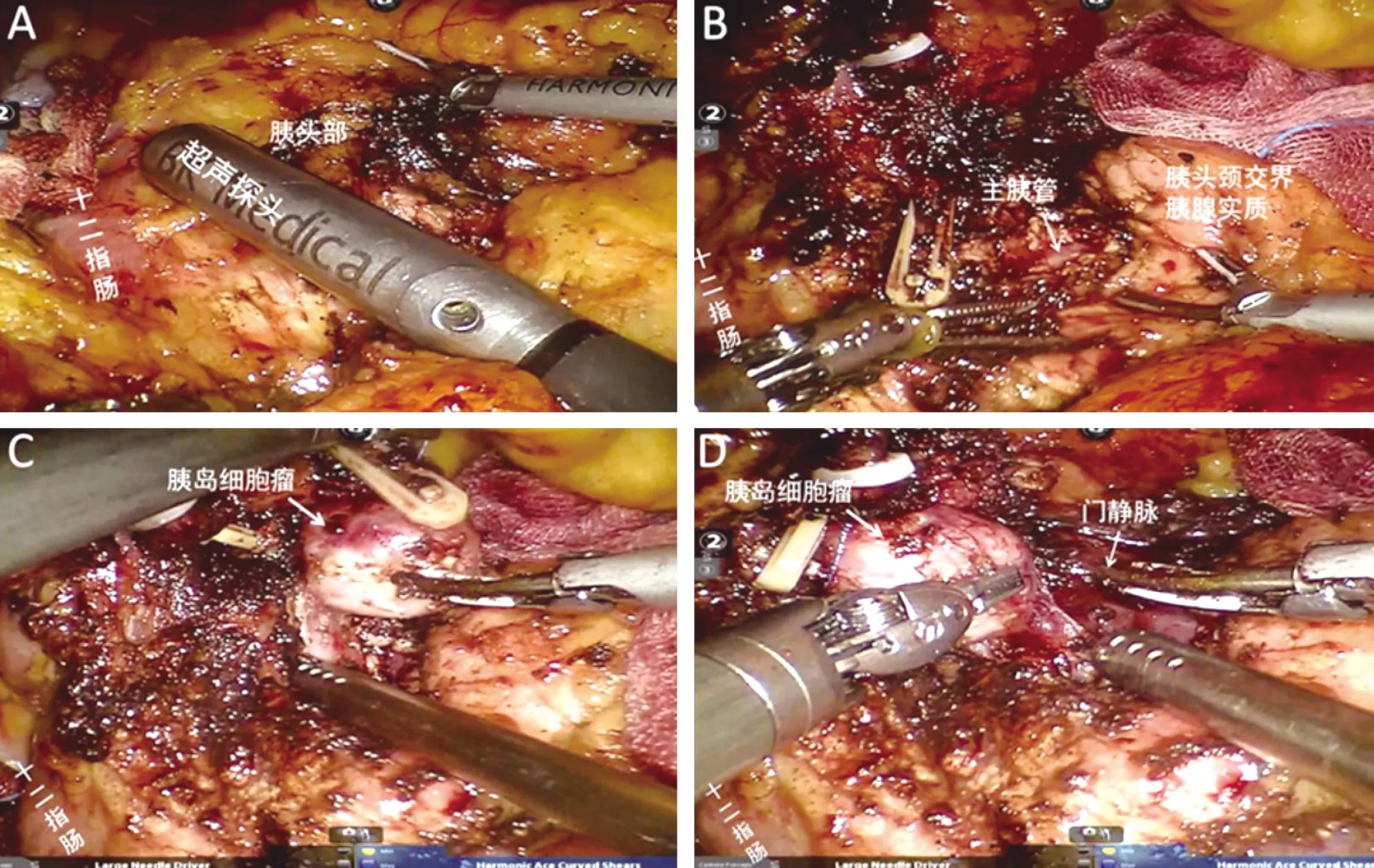
图1 机器人胰头深部胰岛细胞瘤剜除(A:术中超声探查;B:切开肿瘤腹侧部分胰腺实质,显露主胰管;C:沿肿瘤包膜分离;D:于门静脉右侧完整剜除肿瘤)
1.3 观察指标 分析两组手术时间、术中出血量、中转开腹率、术后住院时间、围手术期并发症等资料。胰瘘诊断标准采用国际胰瘘研究小组制定的临床分级标准,对术后胰瘘情况进行分级[9]。
1.4 随访 术后采用电话与门诊随访方式,随访截至2020年1月31日。
2 结 果
2.1 临床资料 22例患者中男9例,女13例。两组患者性别、年龄、BMI及肿瘤直径差异无统计学意义,见表1。
2.2 手术指标 22例患者均为单发肿瘤,顺利完成肿瘤剜除术,无术中输血,术后病理证实为胰腺神经内分泌肿瘤。腹腔镜组手术时间60~260 min,术中出血量5~400 mL;机器人组手术时间60~300 min,术中出血量5~100 mL。两组差异均无统计学意义(P>0.05)。腹腔镜组11例患者中4例中转开腹,其中3例肿瘤位于胰头,1例位于钩突,中转率36.36%;机器人组11例患者无一例中转开腹;但两组中转率差异无统计学意义(P>0.05)。见表2。
2.3 术后指标 两组患者术后临床症状完全缓解,腹腔镜组术后住院3~21 d,机器人组5~9 d,两组术后住院时间差异无统计学意义(P>0.05)。两组均无术后出血、C级胰瘘、严重感染、二次手术、死亡等并发症发生。腹腔镜组术后生化漏发生率为54.5%,B级胰瘘发生率为27.3%;机器人组生化漏发生率为63.6%,B级胰瘘发生率为9.1%,两组胰瘘发生率差异无统计学意义(P>0.05),见表2。术后患者均获随访,临床症状完全缓解,随访期间无肿瘤复发。
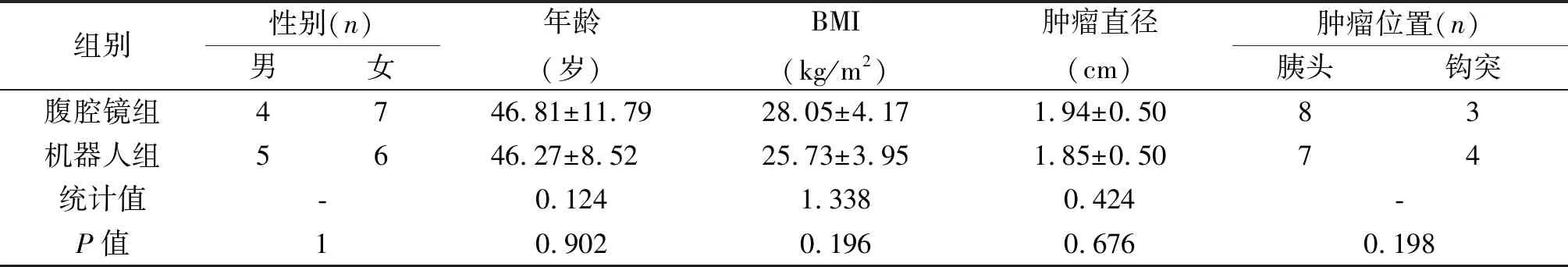
组别性别(n)男女年龄(岁)BMI(kg/m2)肿瘤直径(cm)肿瘤位置(n)胰头钩突腹腔镜组4746.81±11.7928.05±4.171.94±0.5083机器人组5646.27±8.5225.73±3.951.85±0.5074统计值-0.1241.3380.424-P值10.9020.1960.6760.198
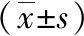

组别术中出血量(mL)手术时间(min)中转开腹(n)术后住院时间(d)生化漏(n)B级胰瘘(n)腹腔镜组89.09±118.08171.36±57.7149.55±5.5263机器人组65.0±43.18146.81±84.1506.70±1.4271统计值0.6350.798-0.165--P值0.5320.4340.0900.12610.586
3 讨 论
散发性胰岛素瘤是最常见的功能性胰腺神经内分泌肿瘤,每百万人年发病率为3~10例[10],90%以上的患者可通过外科手术治愈。肿瘤剜除术能最大程度地保留胰腺功能,有效防止术后胰腺内、外分泌功能不全,但也存在潜在胰瘘、感染、复发等风险。因此,对于包括胰岛素瘤在内的良性胰腺神经内分泌肿瘤患者,2017 NCCN指南推荐首选保留胰腺功能的切除手术[11]。微创手术在治疗胰腺良性肿瘤方面具有一定优势,包括缩短术后住院时间、良好的美容效果。但由于长期低血糖发作,功能性胰岛细胞瘤患者往往主动多次进食高糖类食物缓解症状,导致大部分患者比较肥胖,从而给腹腔镜手术带来一定困难。尤其部分解剖位置深在的胰岛细胞瘤,腹腔镜技术存在游离显露困难、局部剜除困难等问题,行腹腔镜肿瘤剜除术仍存有一定争议[12-13]。达芬奇机器人手术系统可最大限度地利用有限的操作空间,消除手术盲区,解决了腹腔镜在视野、操作器械灵活性等方面的缺陷。达芬奇机器人手术系统的出现可为胰头部胰岛素瘤患者提供更多的微创机会。
腹腔镜/机器人胰岛细胞瘤剜除术是依赖于影像学的手术,术中需要识别肿瘤及其邻近的重要解剖结构才能确保手术安全,包括主胰管、胆总管、十二指肠、门静脉、肠系膜血管等主要结构。胰岛细胞瘤剜除术中腔镜下超声的使用非常重要,不仅可定位肿瘤、判断肿瘤血运情况,也能发现隐匿的多发微小病灶[14]。术中通常需要测量剜除前后的血糖、血清胰岛素水平变化,并且将剜除的肿瘤立即送检冰冻病理进一步验证。
本研究的术者团队分别于2002年、2011年开展了腹腔镜与机器人胰腺手术,目前已积累了成熟的腹腔镜与机器人手术经验[15-16]。本研究中,两组手术时间、术中出血量及术后住院时间差异无统计学意义。但机器人组11例患者均顺利完成肿瘤剜除术,无中转开腹;腹腔镜组4例中转开腹,中转率达36.36%。分析中转开腹的原因主要为:3例胰头部肿瘤,位置深且靠近肠系膜上静脉、门静脉等大血管,腹腔镜操作角度受限且存在“筷子效应”,造成术野显露困难、操作不稳定,考虑手术安全性被迫中转开腹;1例患者因肥胖(体重指数32.88 kg/m2),镜下无法充分显露而中转开腹。Costi等[12]报道,腹腔镜胰头部肿瘤剜除术的中转开腹率为21.43%,中转原因主要为镜下操作困难、术中出血。虽然本研究中两组中转率差异无统计学意义,但我们认为可能与样本量较少有关。结合文献报道及临床应用,我们仍然认为对于胰头部的胰岛素瘤,机器人手术较腹腔镜手术具有一定的潜在优势。
国内韩显林等[17]报道了50例(13例肿瘤位于胰头部)机器人胰岛素瘤切除术的经验,其中 3例肿瘤位于胰头,因术中暴露不充分、出血较多中转开腹。我们借鉴机器人胰十二指肠切除术的经验[8],分别采用传统入路与结肠系膜入路(R孔)或两者结合的方式,使机器人手术中胰头部的显露更加简单、充分。对于体积较小的胰头腹侧、背侧及钩突胰岛素瘤,结肠系膜入路不用打开胃结肠韧带,可最短路径显露肿瘤,缩短手术时间。
胰瘘是胰头部肿瘤剜除术后主要并发症,总发生率高达75%~80%[17-19],B级胰瘘发生率达20%以上。本研究中两组患者均无术后出血、C级胰瘘、严重感染、二次手术、死亡等并发症发生。两组生化漏、B级胰瘘发生率差异均无统计学意义(P>0.05),胰瘘患者均通过延迟拔除腹腔引流管治愈。表明机器人胰头部胰岛素瘤切除术安全、可行。
综上所述,应用达芬奇机器人手术系统行胰头部胰岛素瘤切除安全、可行;与传统腹腔镜相比,机器人手术成功率可能更高,具有一定优势。

