万寿菊悬浮培养细胞生产游离叶黄素工艺的研究
徐晓辉,王莉洁,孙丹,郭健
(1.辽宁何氏医学院健康营养学院,辽宁沈阳 110163;2.辽宁何氏医学院药学院,辽宁沈阳 110163)
天然产物及其衍生物的使用存在严重的供应问题[1]。在许多情况下,当某种植物成为一种商业化草药或者其中某个成分开始用于制药时,由于大规模的野外采伐和不可持续的采收技术,使其数量受到威胁[2]。虽然栽培作为一种可持续的方法可以替代野外采伐,但在50 000种药用植物中,有2/3依然来自野外采收,使得4 000~10 000种药用植物濒临灭绝[3]。此外,植物来源的化合物结构比较复杂,多数情况下不具备利用化学合成生产的经济可行性[4]。
植物细胞悬浮培养提供了另外一种获得药用化合物的方式[5]。利用植物细胞培养技术生产次生代谢产物的优势主要表现在:(1)是一个连续生产系统,不受环境条件影响和限制;生产是在限定的可控条件下完成的,无农用化学品,可以更好地控制产品的产量和质量;(2)生物量积累迅速,目标化合物产率高;(3)下游分离、纯化过程简单,减少了有害溶剂的使用,更加环境友好[6]。迄今为止,已经有17种药用化合物可以利用植物细胞培养技术进行商业化生产,其中大规模生产的主要有:来自紫草(Lithospermum erythrorhizon)的抗炎药物紫草素;来自短叶红豆杉(Taxus brevifolia)的抗癌药物紫杉醇;来自人参(Panax ginseng)并具有心脏保护作用的人参皂甙[7]。
叶黄素经常用作改善眼部健康的补充剂,能够预防和改善年龄相关性黄斑变性和白内障[8],但是人体不能合成叶黄素,完全依赖于从饮食中摄取来满足对叶黄素的需求[9]。目前,商业化生产的叶黄素主要提取自万寿菊(Tagetes erecta L.)的花瓣[10]。然而,从万寿菊的花瓣中提取来生产叶黄素会受到鲜花的季节性供应、土地需求大、需要大量技术工人以及叶黄素含量低等因素限制[11]。此外,万寿菊中叶黄素有两种存在形式,分别为游离叶黄素和叶黄素酯,其中叶黄素酯占80%~100%[12],叶黄素酯必须经过皂化反应除去脂肪酸,才能得到游离叶黄素[13],提取和纯化过程比较复杂。基于上述限制性因素,迫切需要建立新的叶黄素来源,用于其商业化生产,以满足日益增长的市场需求。
在前期研究中,以万寿菊花瓣为外植体构建得到能够生产游离叶黄素的万寿菊悬浮培养细胞系,并建立了培养细胞中叶黄素的超高效液相色谱分析方法[14]。因此通过考察细胞培养条件以及诱导子等对培养细胞中叶黄素合成的影响,建立悬浮培养细胞生产叶黄素的生产工艺,为下一步中试放大培养打下基础。
1 材料与方法
1.1 仪器与试剂
超高效液相色谱仪(ACQUITYTMUPLC,Waters,美国);纯水/超纯水一体化系统(MING-CHE 24UV,Merck Millipore,法国);超声波清洗器(KQ3200E,昆山市超声仪器有限公司);冷冻离心机(5430R,Eppendorf AG,德国);旋转蒸发器(RE-52AA,上海亚荣生化仪器厂);移液器(Research®plus,Eppendorf AG,德国)。
叶黄素(Sigma-Aldrich,美国);乙腈(HPLC级,Sigma-Aldrich,美国);甲醇(HPLC级,Fisher Scientific,美国);甲醇(分析纯,国药集团化学试剂有限公司);水杨酸(分析纯,天津市科密欧化学试剂有限公司);茉莉酸甲酯(Sigma-Aldrich,美国)。
1.2 色谱条件[14]
色谱柱:Waters ACQUITY UPLC®BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相:A为乙腈-甲醇(90∶10,v/v),B为水;梯度洗脱程序:0.0~2.5 min,90%A;2.5~3.0 min,90%~100% A;3.0~6.0 min,100% A;6.0~6.5 min,100%~90% A;6.5~9.5 min,90% A。柱温:25 ℃;流速:0.4 mL/min;进样体积:5 μL;检测波长:448 nm。
1.3 万寿菊悬浮培养细胞
万寿菊悬浮培养细胞所用的培养基为MS(Murashige and Skoog,1962)基础培养基,添加1 mg/L NAA(1-Naphthaleneacetic acid),1 mg/L KT(kinetin),30 g/L蔗糖。用1 mol/L NaOH将培养基的pH值调到5.8,然后116 ℃灭菌30 min。细胞每两周继代培养一次,接种密度为75 g/L。所用摇瓶为100 mL,内装20 mL培养基。摇瓶以双层铝箔纸封口,置于100 r/min的摇床上光照培养,温度为25 ℃,光照强度为8 000 Lx,光照时间为24 h/d。
1.4 细胞生物量的测定方法
1.4.1 细胞鲜重
将细胞样品倒入布氏漏斗中,减压抽滤除去培养基,用去离子水清洗至少3次后称重,所得为细胞鲜重(Fresh cell weight)。
1.4.2 细胞干重
减压抽滤后的细胞样品置于冷冻干燥机中冷冻干燥48 h至恒重,然后称重,所得为细胞干重(Dry cell weight)。
1.5 诱导子溶液的配制及添加方法
将茉莉酸甲酯(MJA)和水杨酸(SA)分别溶于无水乙醇中,配制成储备液。在生物安全柜内,经0.22 μm微孔滤膜注射过滤除菌后,添加到细胞培养基中。
1.6 培养时间对细胞生长和游离叶黄素生产的影响
分别于细胞生长的第0 d、3 d、7 d、10 d、14 d、17 d、21 d、24 d和28 d取样,测定细胞鲜重和细胞干重,并利用UPLC测定细胞中游离叶黄素的含量,计算培养细胞中游离叶黄素的体积产率。
1.7 诱导子对细胞生长和游离叶黄素生产的影响
于细胞生长的第7 d,在悬浮培养细胞液体培养基中分别添加终浓度为10 μmol/L的水杨酸以及10 μmol/L的茉莉酸甲酯,在细胞生长的第14 d收获细胞,测定细胞鲜重、细胞干重以及细胞中游离叶黄素的含量,计算细胞中游离叶黄素的体积产率。
1.8 光照对细胞生长和游离叶黄素生产的影响
将培养细胞分成两组,其中一组按照1.3中所述方法进行光照培养;另一组进行暗培养,其它培养条件均完全相同。培养第14 d收获细胞,测定细胞鲜重、细胞干重以及细胞中游离叶黄素的含量,计算细胞中游离叶黄素的体积产率。
2 结果与讨论
2.1 细胞生长曲线
植物细胞的生长一般可分为以下4个阶段:延滞期(Lag phase)、指数期(Exponential phase)、稳定期(Stationary phase)和衰亡期(Decline phase)。万寿菊悬浮培养细胞的生长曲线如图1所示。可以看出,对于万寿菊悬浮培养细胞,细胞鲜重和细胞干重的积累表现出基本相同的规律。第0~3 d为延滞期,在此阶段,细胞刚刚转入新鲜培养基,还处在适应阶段,逐渐恢复分裂能力。第3~14 d为指数期,细胞一方面通过分裂,实现细胞数目的增多;另一方面,通过细胞体积的增大,最终实现细胞生物量的快速积累。第14~21 d为稳定期,细胞生长速率下降,新生的细胞数和死亡的细胞数相当,细胞数达到最大值。第21~28 d为衰亡期,细胞停止生长和分裂,开始衰老和死亡。

图1 万寿菊悬浮培养细胞的生长曲线
在细胞生长的第14 d,细胞鲜重达到最大值;在细胞生长的第21 d,细胞干重达到最大值,为13.04±2.15 g/L。鉴于培养细胞从14 d进入稳定期,且就细胞干重而言,经统计学分析,第14 d、17 d以及21 d,无显著性差异。考虑生产成本和发酵周期,以悬浮培养细胞生物量为参数时,培养细胞收获的最佳时间为细胞生长的第14 d。在细胞生长的第14 d,细胞鲜重为225.86±12.99 g/L,为第0 d的7.9倍;细胞干重为12.43±0.49 g/L,为第0 d的4.9倍。
2.2 细胞中游离叶黄素的生产曲线
万寿菊悬浮培养细胞中游离叶黄素的生产曲线如图2所示。万寿菊悬浮培养细胞中游离叶黄素的积累和细胞生物量的积累(细胞干重)具有相同的规律,几乎完全吻合。这表明,万寿菊悬浮培养细胞生产游离叶黄素和细胞生长是偶联的。基于此,在下一步中试放大培养阶段,可以通过细胞的高密度培养,实现细胞生物量的快速积累,进而实现高产游离叶黄素。
万寿菊培养细胞生产游离叶黄素,在细胞生长的第14 d,开始进入稳定期,一直持续到第24 d,然后游离叶黄素的产率开始下降。游离叶黄素的产率在细胞生长的第21 d达到最大值,体积产率为1.57±0.52 mg/L。同细胞生长曲线一样,经统计学分析,叶黄素产率在细胞生长的第14 d、17 d、21 d以及24 d,无显著性差异。考虑生产成本和生产周期,培养细胞生产游离叶黄素时,细胞收获的最佳时间为细胞生长的第14 d。在细胞生长的第14 d,游离叶黄素产率为1.29±0.09 mg/L,为第0 d的8.48倍。

图2 万寿菊悬浮培养细胞中游离叶黄素的生产曲线
2.3 诱导子对细胞生长和游离叶黄素生产的影响
分别添加诱导子茉莉酸甲酯(MJA)和水杨酸(SA)对万寿菊悬浮培养细胞生长的影响如图3所示。添加茉莉酸甲酯和添加水杨酸的两个处理组之间,细胞鲜重接近,且均低于对照组细胞,处理组与对照组均无显著性差异;而对于细胞干重而言,对照组细胞与处理组细胞,3组值都接近,且无显著性差异。上述结果表明,以茉莉酸甲酯或者以水杨酸作为诱导子添加,对万寿菊悬浮培养细胞生长均无显著性影响。

图3 茉莉酸甲酯和水杨酸对万寿菊悬浮培养细胞生长的影响
分别添加诱导子茉莉酸甲酯和水杨酸对万寿菊悬浮培养细胞生产游离叶黄素的影响如图4所示。由图4可知,添加茉莉酸甲酯组细胞中游离叶黄素的产率与对照组细胞产率接近,无显著性差异,但两者均高于添加水杨酸组细胞中游离叶黄素的产率。上述结果表明,以茉莉酸甲酯或者以水杨酸作为诱导子,对万寿菊悬浮培养细胞生产游离叶黄素无显著性促进作用。

图4 茉莉酸甲酯和水杨酸对游离叶黄素生产的影响
2.4 光照对细胞生长和游离叶黄素生产的影响
光照培养、暗培养以及暗培养添加茉莉酸甲酯3种培养条件下,万寿菊悬浮培养细胞生长情况如图5所示。由图5可知,就细胞鲜重而言,光照组细胞最高,且与暗培养细胞之间为显著性差异,而暗培养添加茉莉酸甲酯组细胞鲜重最低,细胞干重亦显示出相同的规律,说明暗培养以及暗培养添加茉莉酸甲酯抑制细胞生长。上述结果表明,光照对于万寿菊悬浮细胞生长具有显著促进作用。
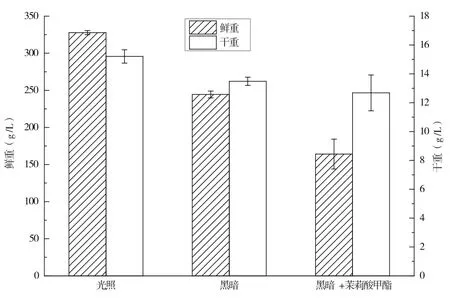
图5 光照对万寿菊悬浮培养细胞生长的影响
光照培养、暗培养以及暗培养添加茉莉酸甲酯3种培养条件下,万寿菊悬浮培养细胞生产游离叶黄素的情况如图6所示。由图6可知,3组细胞中游离叶黄素的产率以光照培养组细胞中最高,达到1.95±0.17 mg/L,而暗培养组细胞中游离叶黄素的产率仅为0.34±0.02 mg/L,暗培养添加茉莉酸甲酯组细胞中游离叶黄素产率为0.32±0.01 mg/L。光照培养组细胞中游离叶黄素产率为暗培养组细胞产率的5.7倍;光照培养组细胞游离叶黄素产率为暗培养添加茉莉酸甲酯组细胞产率的6.1倍。上述结果表明,光照对于万寿菊悬浮培养细胞生产游离叶黄素具有显著促进作用。推测这可能与叶黄素是光合色素有关。同时,暗培养条件下,茉莉酸甲酯对培养细胞生产叶黄素无显著性影响。

图6 光照对游离叶黄素生产的影响
3 结论
通过建立万寿菊悬浮培养细胞生产游离叶黄素的工艺,发现细胞最佳收获时间为生长的第14 d,此时为稳定期。万寿菊悬浮培养细胞生产游离叶黄素和细胞生长是偶联的,可以通过培养细胞的高密度培养,实现细胞生物量的快速积累,进而实现高产游离叶黄素,这对于下一步中试放大培养意义重大。光照是叶黄素合成的关键因素,能够显著促进培养细胞生长和生产游离叶黄素。茉莉酸甲酯和水杨酸不能促进培养细胞中游离叶黄素的合成。在暗培养条件下,茉莉酸甲酯不能替代光照诱导游离叶黄素的合成。
未来需根据叶黄素的生物合成途径,选择合适的方法实现有效的过程调控。同时,运用分子生物学技术对合成途径中的关键酶等进行改造,以实现反应器放大培养阶段叶黄素的稳产和高产。

