农杆菌介导转化木霉原生质体的研究
顾斌涛,熊大维
(江西省科学院微生物研究所,江西南昌 330096)
根癌农杆菌(Agrobacterium tumefaciens)是一种存在于土壤中的革兰氏阴性菌,在自然条件下能感染植物的受伤部位,可以转移肿瘤诱导质粒的片段T-DNA(Transfer DNA)导入到植物基因组中。根癌农杆菌介导转化法不仅用于植物的转化,而且能用于酵母、曲霉、木霉和蘑菇等真菌的转化,根癌农杆菌介导转化法比传统聚乙二醇介导的原生质体转化法效率更高[1-4]。
里氏木霉(Trichoderma reesei)是工业上重要的产酶菌种,其在纤维素基质上生长迅速、培养简便,发酵工艺成熟,胞外分泌蛋白能力强,产物分离成本低,在产酶条件下不产生毒素,具有良好的安全性[5]。里氏木霉具有纤维二糖水解酶基因的强启动子,大量同源或异源的酶基因在里氏木霉中获得表达并应用于工业生产[6-7]。用里氏木霉作为宿主菌进行基因工程改造越来越受到重视,目前对里氏木霉进行转化效率较高的方法为根癌农杆菌介导转化法[8]。一般研究常用里氏木霉的分生孢子作为其转化受体细胞,本研究利用里氏木霉的原生质体作为转化受体材料,以期提高根癌农杆菌介导转化的效率,方便对里氏木霉遗传改造时进行大通量的筛选。
1 材料与方法
1.1 试验材料
菌株:里氏木霉H7和根癌农杆菌AGL-1为实验室保存。
质粒:pCAM-pht01为实验室保存,根癌农杆菌转化载体,含潮霉素基因表达盒。
PDA培养基:称取PDA干粉(英国Oxoid公司CM0139)39 g,加入1 L去离子水,搅拌至样品分散,高压蒸汽灭菌后倾注平板。
PDA抗性培养基:PDA培养基中加入潮霉素B(150 μg/mL)和头孢霉素(400 μg/mL)。
IM培养基:取1.25 mol/L磷酸缓冲液800 μL,MgSO4-NaCl缓冲液 20 mL,10 mg/mL CaCl2·2H2O溶液1 mL,1 mg/mL FeSO4·7H2O溶液1 mL,微量元素溶液5 mL,200 mg/mL NaNO3溶液2 mL,50%甘油10 mL,1 mol/L MES溶液40 mL,200 mg/mL葡萄糖溶液5 mL,混匀后加入900.7 mL无菌水[9-10]。
1.2 试验方法
1.2.1 根癌农杆菌感受态的制备
将根癌农杆菌接至含60 μg/mL利福平的LB液体培养基,28 ℃、180 r/min培养48 h,按接种量为10%转接至LB液体培养基中,28 ℃、180 r/min培养至OD600达到0.6左右。将菌液分装并冰浴15 min,离心弃上清。将根癌农杆菌重悬于500 μL预冷的0.1 μmol/L MgCl2溶液,冰浴10 min。离心弃上清,加入100 μL预冷的0.02 μmol/L的CaCl2溶液重悬菌液,冰浴20 min。
1.2.2 质粒导入根癌农杆菌
在农杆菌中加入5 μL的质粒轻轻混合,冰浴15 min后放入液氮冷冻1 min。冷冻后在37 ℃的水浴中放置3 min,再立即冰浴2 min,加入450 μL的LB液体培养基。在100 r/min和28 ℃的摇床上孵育3 h。然后4 000 r/min离心3 min。弃去约400 μL上清,剩下的液体与菌体沉淀混合,涂布至LB固体抗性平板。在28 ℃条件下培养至转化子长出。
1.2.3 根癌农杆菌介导转化里氏木霉
根癌农杆菌接LB液体培养基(含利福平25 μg/mL和卡那霉素60 μg/mL)培养36 h;离心收集菌,用IM液体培养基重悬菌至OD660为0.15,添加乙酰丁香酮400 μmol/L,铝膜避光,在28 ℃和180 r/min的摇床培养至OD660为0.5左右。
里氏木霉接到PDA平板上28 ℃培养7 d,用无菌水从平板上洗下木霉孢子,过滤得孢子液。血球计数板对孢子计数,8 000 r/min离心2 min,弃去上清,用无菌生理盐水调节孢子液的浓度到106个/mL。
取上述根癌农杆菌和里氏木霉孢子液按体积1∶1混合,然后涂布在IM平板的硝酸纤维素膜上,暗处共培养。将硝酸纤维素膜反铺到含150 μg/mL潮霉素B和400 μg/mL头孢霉素的PDA抗性平板上,30 ℃培养至里氏木霉转化子长出。
2 结果与分析
2.1 根癌农杆菌的浓度对转化效率的影响
根癌瘤农杆菌介导转化不同宿主菌的能力不同,过高或过低的农杆菌浓度对转化效率有直接的影响,一般处于对数生长期的农杆菌转化能力较强,实验选择不同浓度的农杆菌(OD660=0.4~1.0)进行研究,结果(图1)表明根癌农杆菌的浓度对转化效率有显著的影响,根癌农杆菌OD660为0.8时的转化效率最高,当OD660超过0.8时,转化效率反而降低,可能由于过高的菌浓使得培养基中营养不足,降低了农杆菌的介导能力。因此实验最适宜的根癌农杆菌菌液OD660为 0.8。

图1 根癌瘤农杆菌浓度对转化效率的影响
2.2 乙酰丁香酮浓度对转化效率的影响
乙酰丁香酮是一种由受伤植物产生的酚类物质,在遗传转化中诱导能力较强,其作用机制在于能诱导农杆菌转化相关基因的转录和表达,刺激肿瘤诱导质粒的T-DNA转移并整合到植物或真菌细胞的基因组中。使用不同浓度的乙酰丁香酮进行农杆菌和木霉的共培养,结果如图2所示。乙酰丁香酮浓度对转化效率的影响是显著的,在一定范围内,随乙酰丁香酮浓度的增加转化效率也增加。但过高浓度的乙酰丁香酮影响了转化效率。当乙酰丁香酮浓度80 μg/mL时,转化效率最高,因此后续实验采用乙酰丁香酮浓度为80 μg/mL。

图2 乙酰丁香酮浓度对转化效率的影响
2.3 共培养时间对转化效率的影响
研究不同共培养时间对转化效率的影响,结果显示(图3)共培养12 h时没有获得转化子,随着共培养时间的延长,转化效率逐渐提高,共培养48 h转化率最高。共培养时间过长时,转化效率反而有些下降,这可能是农杆菌过度生长,一方面消耗了培养基的营养,另一方面在后续培养中产生物理屏障,限制了木霉菌的生长。另外,过长的共培养时间可能导致转化子菌落会相互重叠,给下一步的筛选带来困难,因此共培养时间选择48 h为宜。

图3 共培养时间对转化效率的影响
2.4 共培养温度对转化效率的影响
共培养温度对农杆菌介导转化有一定的影响,采用 20 ℃、22 ℃、24 ℃、26 ℃、28 ℃和 30 ℃进行实验,如图4的结果显示,在一定温度范围内,转化效率随着温度的上升而增加,当温度24 ℃时转化效率最高,当温度过高时,转化效率随着温度的上升而下降。可能由于低温影响了里氏木霉和农杆菌的生长,高温影响了农杆菌介导转化过程中的T-DNA转移机制。因此实验选取共培养温度为24 ℃。

图4 共培养温度对转化率的影响
2.5 共培养pH对转化效率的影响
共培养基的pH对菌体的生长和代谢有很大的影响,使用根癌农杆菌介导转化一般需要较低的pH值。采用不同的共培养基pH进行实验,图5的结果显示,当共培养基pH为5.2~5.6,具有较高的转化效率,其中以pH在5.4时转化效率最高,达到87个转化子(每106个细胞),是以孢子为受体(转化效率46个转化子/106个孢子)的1.9倍[11]。
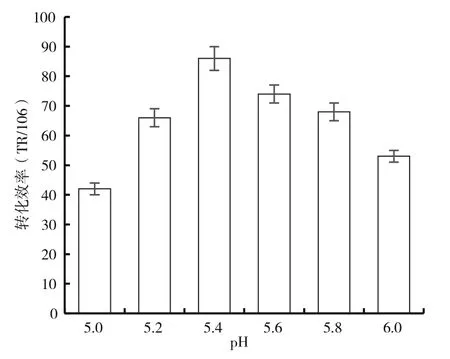
图5 共培养pH对转化率的影响
3 讨论与结论
丝状真菌在生产有机酸、抗生素、酶制剂及药物活性物质中发挥着重要的作用。作为异源蛋白表达的细胞工厂,丝状真菌具有蛋白分泌能力强、营养需求低、翻译后修饰加工和产物分离成本低等优势。丝状真菌有着良好的生物安全性,黑曲霉、里氏木霉和米曲霉等已在食品行业有长期应用。里氏木霉是生产工业酶制剂的重要菌株,本身能分泌大量的纤维素酶,其纤维素酶酶系组成较为齐全,通过遗传改造里氏木霉进行同源或异源表达的研究越来越受重视。本研究利用里氏木霉的分生孢子作为其根癌农杆菌介导转化的受体细胞,获得转化的适宜条件为:根癌农杆菌菌液OD660为0.8,乙酰丁香酮浓度为80 μg/mL,共培养时间选择48 h,共培养温度为24 ℃,共培养基pH在5.4。在此条件下,根癌农杆菌介导转化的效率达87个转化子(每106个细胞),高于传统以分生孢子作为受体细胞的转化效率。

