术前CT血管成像对慢性完全闭塞病变介入治疗结果预测价值的研究
马琳莹 赵晶石 李小路 刘芳 张同
150001 哈尔滨医科大学附属第四医院影像科
冠状动脉慢性完全闭塞病变(chronic total occlusion ,CTO)被定义为冠状动脉闭塞,管腔不连续和顺行血流中断且闭塞时间大于3个月,TIMI为0级血流或之前的血管造影证实[1-2]。在涉及侵入性冠状动脉造影的个体中CTO的发生率高达25%~35%。对CTO进行血运重建仍具有挑战性,其成功率大约为50%~80%,在日本有经验的介入中心手术成功率可达90%[3]。经历经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)失败的患者并发症发生率高,并且进一步PCI的成功率较低。因此本文旨在研究术前CT血管成像(coronary computed tomography angiography,CCTA)对CTO开通结果的预测价值。
1 对象和方法
1.1 研究对象
回顾性分析2016年1月至2018年12月就诊于我院心内科,并经冠状动脉造影(coronary angiography,CAG)确诊至少一支冠状动脉存在闭塞,且闭塞时间大于3个月的患者资料。入选标准:(1)CAG结果提示血管狭窄100%(TIMI 0级);(2)PCI术前一个月内接受冠状动脉CT检查。排除标准:(1)近期三个月内曾有心肌梗死者;(2)碘对比剂过敏者;(3)CT图像缺失或者图像无法判定;(4)严重肾功能不全者,肾小球滤过率<30 ml·min-1·1.73 m-2;(5)孕期及妊娠妇女。
1.2 方法
所有患者签署检查知情同意书,检查前由医护人员告知检查流程并进行呼吸训练。使用320排CT(东芝Aquilion ONE)对患者进行检查。医护人员在患者肘前静脉埋入18号静脉注射针头注射造影剂。根据患者体质指数,应用双筒高压注射器以4.5~5.0 ml/s流速静脉注射非离子型碘对比剂(浓度约为350 mgI/ml)50~60 ml,完成后注射同等流速生理盐水30~40 ml。管电压控制范围为80~120 kV,管电流范围为350~550 mA。人工智能触发扫描,扫描范围自气管分叉至心脏膈面下1 cm左右,所有的检查者都采用前瞻性心电门控[4-5],心率<75次/min,采集实相70%~80%;心率>75次/min,采集实相为R-R间期的35%~75%。
1.3 图像分析
将CCTA图像传至三维后处理工作站,对冠脉图像进行重建,包括多平面重建,曲面重建等。同时记录以下参数:闭塞血管部位、闭塞长度、闭塞血管钙化程度、闭塞头端纤维帽形态(锥形或钝头)、闭塞近端是否分叉、闭塞近端的平均CT值(规避钙化斑块)、重构的类型[2]、闭塞段内线样强化、闭塞段血管弯曲情况(≥45°或<45°)等[6]。血管重构包括正性重构和负性重构。如果血管外弹性膜(extravascular elastic membrane,EEM)面积大于病变的近端EEM和远端EEM面积的平均值,则称为正性血管重构。如果EEM面积小于病变的近端EEM和远端EEM面积的平均值,则称为负性血管重构。所有CT图像分析均由两位具有5年经验的影像诊断医师进行分析判断。J-CTO评分为在30 min内导丝通过病变,变量包括近段闭塞形态(锥形0分,钝形1分),弯曲角度(<45°为0分,>45°为1分)、闭塞长度大于20 mm(<为0分,>为1分)、既往PCI手术失败史(无0分,有1分)。CT-RECTOR评分包括多处闭塞、入口或出口没有锥形残端、血管弯曲大于45°、钙化面积大于50%、既往PCI手术失败、CTO闭塞时间大于12个月或未知分别赋予1分[6-7]。
PCI图像:PCI手术均由具有5年以上冠状动脉介入治疗经验的心血管内科医师完成并评估。手术成功定义为导丝通过闭塞病变且治疗后病变血管前向血流TIMI为3级,残余狭窄<25%。未发生不良心脏事件,包括心原性死亡、急性心肌梗死和穿孔等并发症。
1.4 统计学方法

2 结果
2.1 基本情况
排除三个月内发生心肌梗死者1例,既往接受过PCI或者CABG治疗者5例,图像质量差3例。最终共纳入113例患者,114处病变血管。所有CTO病变分为PCI成功组与PCI失败组(图1)。其中成功组84例,失败组30例,介入治疗成功率约为73.7%。两组患者的临床基本资料中仅在有无心肌梗死病史上有明显差异(P<0.05),见表1。
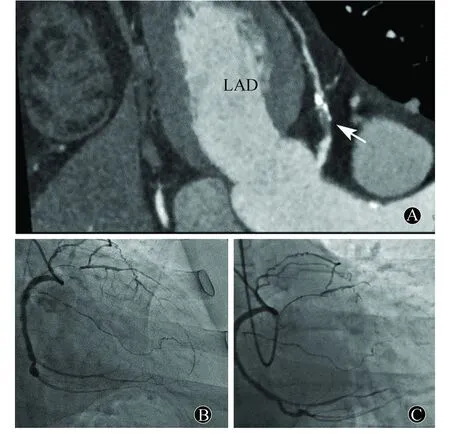
患者男性,CCTA显示左前降支钝形闭塞、负性重构(A);冠状动脉造影证实左前降支闭塞,最终手术失败(B、C)图1 PCI失败组1例患者左前降支闭塞、负性重构
2.2 术前320排CCTA影像参数的比较
CCTA参数分析结果显示,PCI失败组的负性重构、血管弯曲度、钝头闭塞、钙化程度大于50%、闭塞长度、闭塞头端的密度均显著高于PCI成功组(均为P<0.05),见表2。
将上述影像特征纳入多因素logistic回归分析判断影响CTO介入治疗的因素,变量纳入方法选择逐步回归法,结果显示:负性重构、血管弯曲大于45°、钝形闭塞者,PCI成功率低(均为P<0.05),见表3。
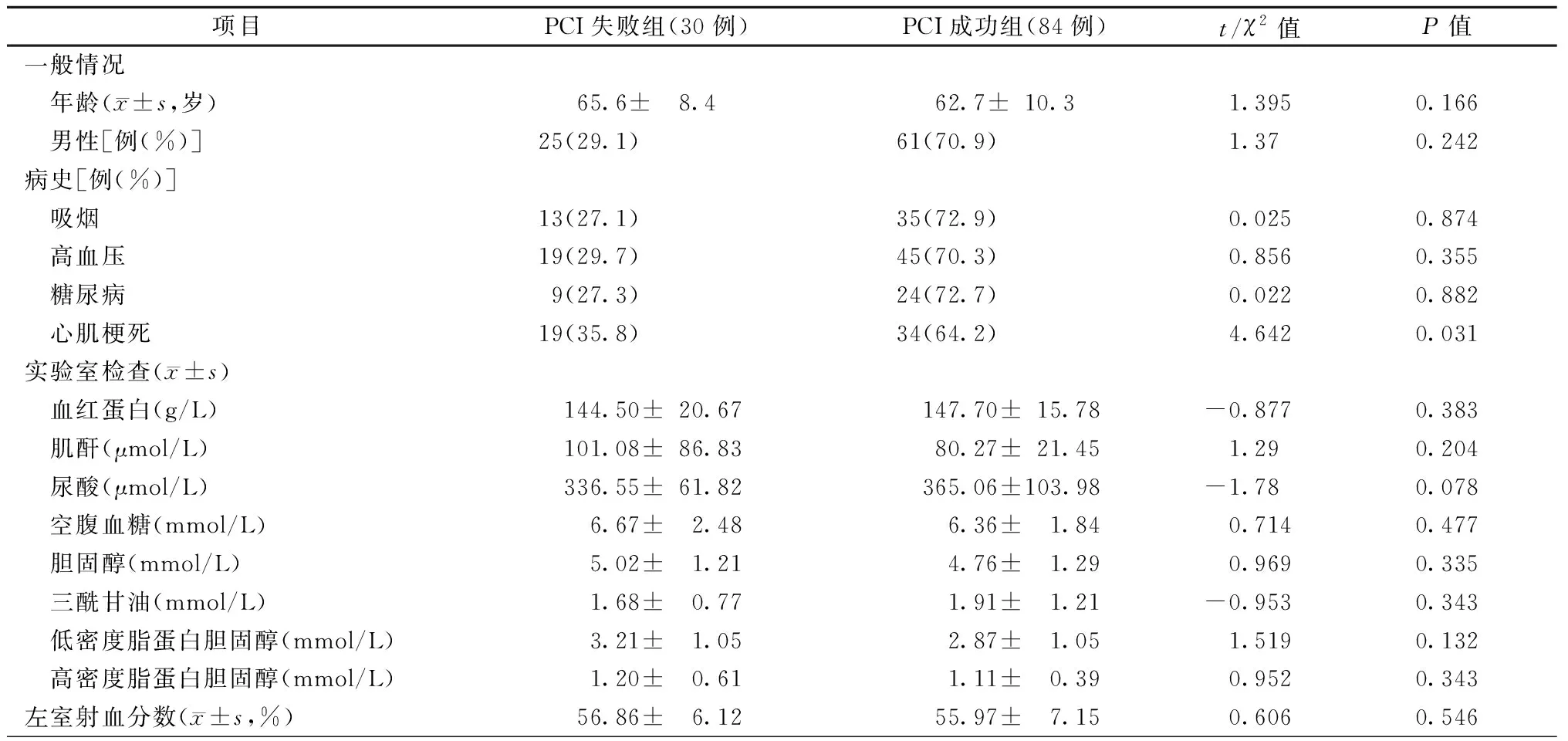
表1 CTO患者临床基本资料及实验室检查结果比较
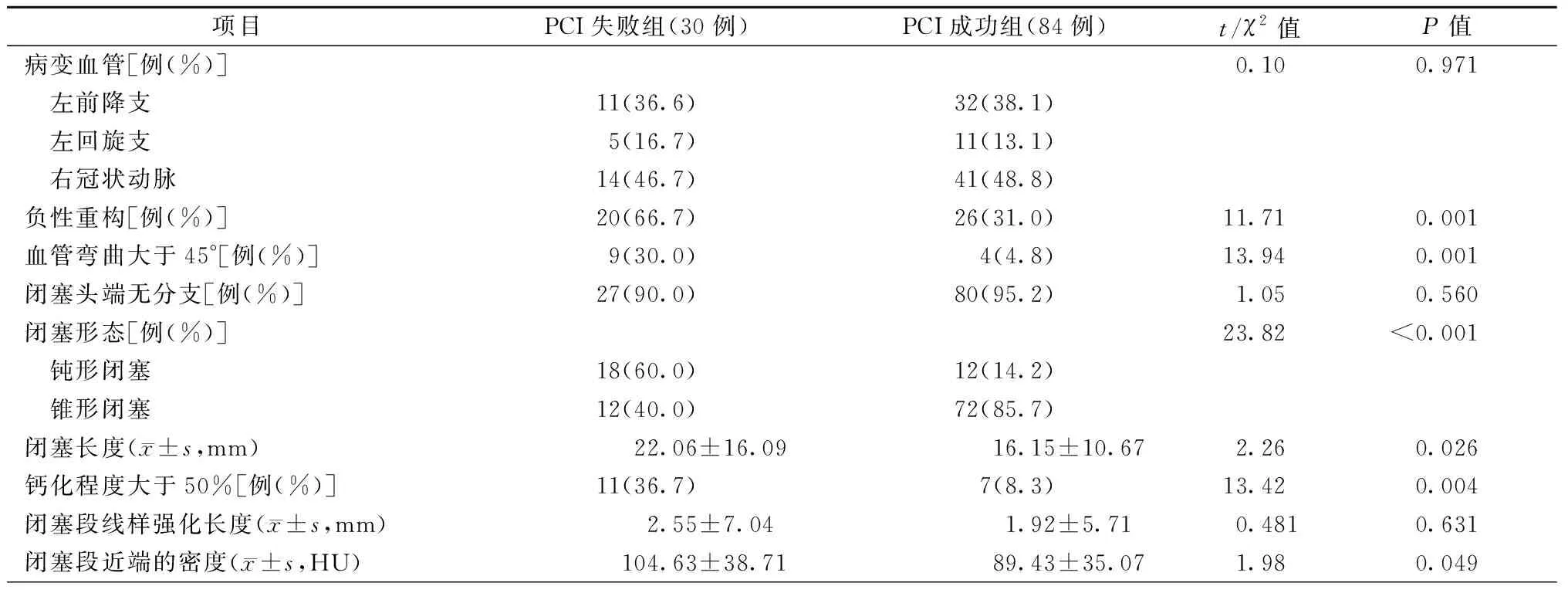
表2 CTO患者320排CCTA影像评估参数比较
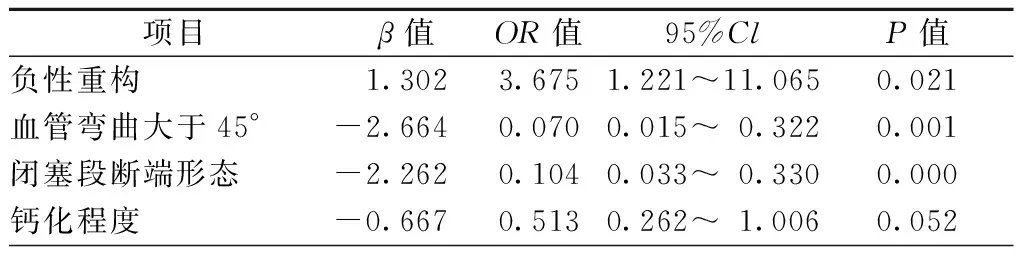
表3 Logistic回归分析
2.3 评价J-CTO积分和CT-RECTOR积分对介入手术结果的预测
J-CTO评分[8]中随着评分等级的增加,PCI成功率逐渐下降,分别为94.7%、60.0%、46.7%、0%。CT-RECTOR评分[8]随着评分等级的提高,PCI失败率逐渐增高,分别为0.03%、18.6%、47.0%、100%。如图2所示,J-CTO评分的ROC曲线下面积为0.768(95%CI:0.672~0.865,P<0.001),CT-RECTOR评分的曲线下面积为0.854(95%CI:0.775~0.934,P<0.001)。CT-RECTOR评分预测介入治疗成功率明显高于J-CTO评分(85.4%比76.8%,P<0.05)。
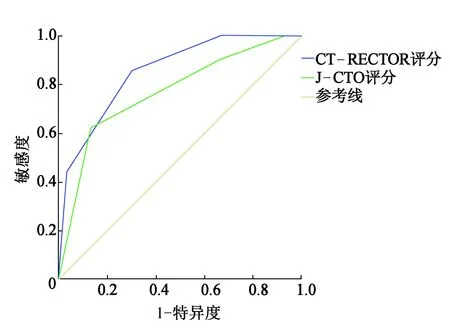
图2 J-CTO评分和CT-RECTOR评分对PCI结果的预测
3 讨论
尽管在支架术已成型的今天,CTO病变仍为转为CABG手术的主要原因[9]。本研究显示,钙化、血管弯曲大于45°、钝形闭塞是导致CTO介入手术失败的主要因素。
CTO的动脉粥样硬化斑块主要由细胞内外脂质、平滑肌细胞、细胞外基质和钙组成。我们将CT值40~130 HU定义为纤维成分[10],纤维斑块的存在代表一种伤口的愈合情况,富含胶原蛋白的瘢痕组织代替了之前含有蛋白多糖的细胞外基质,病变的近端特别密集,从而形成近端纤维帽,围绕着相对较软有组织的血栓和脂质核心。闭塞段残端的锥形形状被认为是潜在的“微通道”的关键标记,其有助于导丝通过近端纤维帽。根据Rolf等[11]的说法,冠状动脉CTA对于钝性残端的检测似乎比有创血管造影术更敏感[12]。我们首次测量了规避钙化斑块闭塞近段管腔的密度,组间比较结果显示腔内密度的不同在预测手术失败上差异有统计学意义,PCI成功组闭塞近端2 mm以内的CT平均值为89.43 HU,失败组为104.63 HU,但两者相差较小。我们会扩大样本量进一步验证。
钙化的程度通常与其闭塞时间有关,随着时间的累积,病变内的纤维组织逐渐演变成血栓机化,钙盐在斑块内沉积[13]。与CAG相比,CT对钙化斑块的识别具有高度特异性。由于导丝具有朝向阻力小的方向走行的特点,在严重钙化病变的部位,导丝进入闭塞病变的难度会增加,很容易进入假腔,支架扩张也会增加挑战性;对于同轴钙化使用旋磨术会变得频繁,研究显示,钙化重构达到0.84是旋磨术的独立预测因子,旋磨术使用不恰当易于引起并发症[14]。即使在反复尝试扩展的期间,严重的钙化病变也能导致穿孔。在失败组钙化横截面积大于50%者所占比例达36.7%,虽然我们未进行钙化积分的测定,但是参考之前的研究方法[15],将钙化程度按照所占面积进行划分同样也具有统计学意义。我们后续会扩大样本量将队列分为无钙化、偏心钙化、连续钙化和闭塞钙化进行下一步的分析。
J-CTO评分是日本多中心CTO研究中心制定的评分标准,而CT-RECTOR评分是Opolski等通过冠脉CT血管成像的结果评估CTO病变,我们的研究结果也与Tan等[16]研究一致,两种评分相比,CT-RECTOR评分显示出更好的预测效能。分数越高,手术失败几率越大,这些指标在影像资料极容易观察得到,为临床医生制定治疗方案提供一定帮助。
本实验为回顾性单中心研究,可能会造成结果偏移,尤其是术者对病变的判断、器械熟悉程度等对手术成功与否会有直接影响。后期会纳入其他中心的研究数据,以期进一步完善试验方案,获得更高级别的循证学依据。
综上所述,术前CCTA可以提高CTO病变的检出率,显示CTO病变的解剖结构,并为高风险冠状动脉介入治疗的成功率提供预测价值。正性重构者PCI成功率高,而血管弯曲大于45°、钝形闭塞、钙化程度越高者失败率越高,是影响CTO患者手术成功率的主要因素,CT-RECTOR评分有助于预测CTO行PCI手术结果。
利益冲突:无

