心肌病的病理研究进展
蓝明 刘兵 刘君萌 杨重庆 何青
100730 北京医院心内科 国家老年医学中心
心肌病(cardiomyopathy)是一大类累及心肌组织,临床以心脏结构异常、心力衰竭、心律失常和(或)猝死为特征的疾病,临床有极大的异质性及多样性,是儿童及成人心脏移植的常见病因。美国心脏协会与欧洲心脏病学会的最新指南与共识均将心肌病定义为一组引起心肌结构及功能异常的异质性疾病。1999年,我国经全国心肌炎心肌病学术研讨会专家组讨论,基本采纳1995年世界卫生组织/国际心脏病学会及联合会(WHO/ISFC)关于心肌病的定义及分型标准,将心肌病分为扩张型心肌病(dilated cardiomyopathy,DCM)、肥厚型心肌病(hypertrophic cardiomyopathy,HCM)、限制型心肌病、致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)、特异性心肌病及未分类心肌病。尽管在2013年,Arbustini等提出的MOGE(S)法对心肌病进行了新的分类,但该分类方法尚未在临床上广泛应用。
心肌病的病理研究的深入对其诊治及预后评估等方面意义重大。近年有文献对心肌病的超微病理学进行阐述,超微病理学是病理学的重要分支学科,细胞超微结构的改变不仅表现了疾病的亚细胞表观学特点,也从病因学角度为进一步认识这类疾病提供了信息。本文根据我国1999年的心肌病分类方式阐述不同类型心肌病的病理研究进展及其超微病理学的最新认识。
1 DCM
DCM以进行性左心室或双心室扩张、收缩功能受损为特点,病因包括基因突变、病毒感染、心肌炎症及其他原因[1-2]。虽然我们倾向于用一元论解释DCM的病因,但有证据显示基因因素和环境因素可同时影响该疾病的发生,而且临床上能明确诊断病因的患者仍为少数[3-4]。临床常表现为进行性心力衰竭,常伴心律失常及血栓性疾病,病程中随时可发生猝死。排除全身性疾病的原因不明的DCM,称为特发性DCM(idiopathic dilated cardiomyopathy,IDC),约占DCM的10%。
IDC病理形态学主要诊断依据[5]:心脏质量增加;左心室或双心室腔显著扩大,心室壁变薄(图1A),可有附壁血栓。组织学表型不特异,可有心肌细胞萎缩、肥大及空泡变性,细胞核多形性,间质纤维组织呈小片或灶状增生(图1B、C和D)。

A:大体表现:左心室腔剖面,心腔扩张,心壁变薄,肌小梁扁平,心内膜灶状灰白增厚[6];B:HE染色显示,心肌间质片状纤维化,相互间可交织融合(箭头所示)[6];C:Desmin染色显示,深色部分为心肌染色,浅色部分为间质染色,可见心肌间质小片状纤维化,有交织融合表现(图片来源于作者的研究标本,尚未发表);D:Masson染色显示,蓝色部分为心肌间质中胶原纤维染色,紫红色为心肌染色,可见心肌间质小片状纤维化,有交织融合表现(图片来源于作者的研究标本,尚未发表)图1 IDC大体形态与光镜表现
IDC超微结构表型包括[6]:心肌细胞过度拉伸的适应性反应及损伤,肌丝结构紊乱,部分肌节过度收缩,Z线浓集,表现为“致密带”(图2A);大量增生且成分复杂的间质,分隔心肌细胞,间质中成片的Ⅰ型胶原(图2B)及丰富的特洛细胞(telocytes,TCs,图2C),TCs是特殊的间质细胞,近年来在哺乳动物多种器官的结缔组织中发现,也有在IDC患者的心肌间质中发现TC的报道,但其具体的意义及价值尚不明确;心肌细胞代谢异常,糖原增多(图2D)。
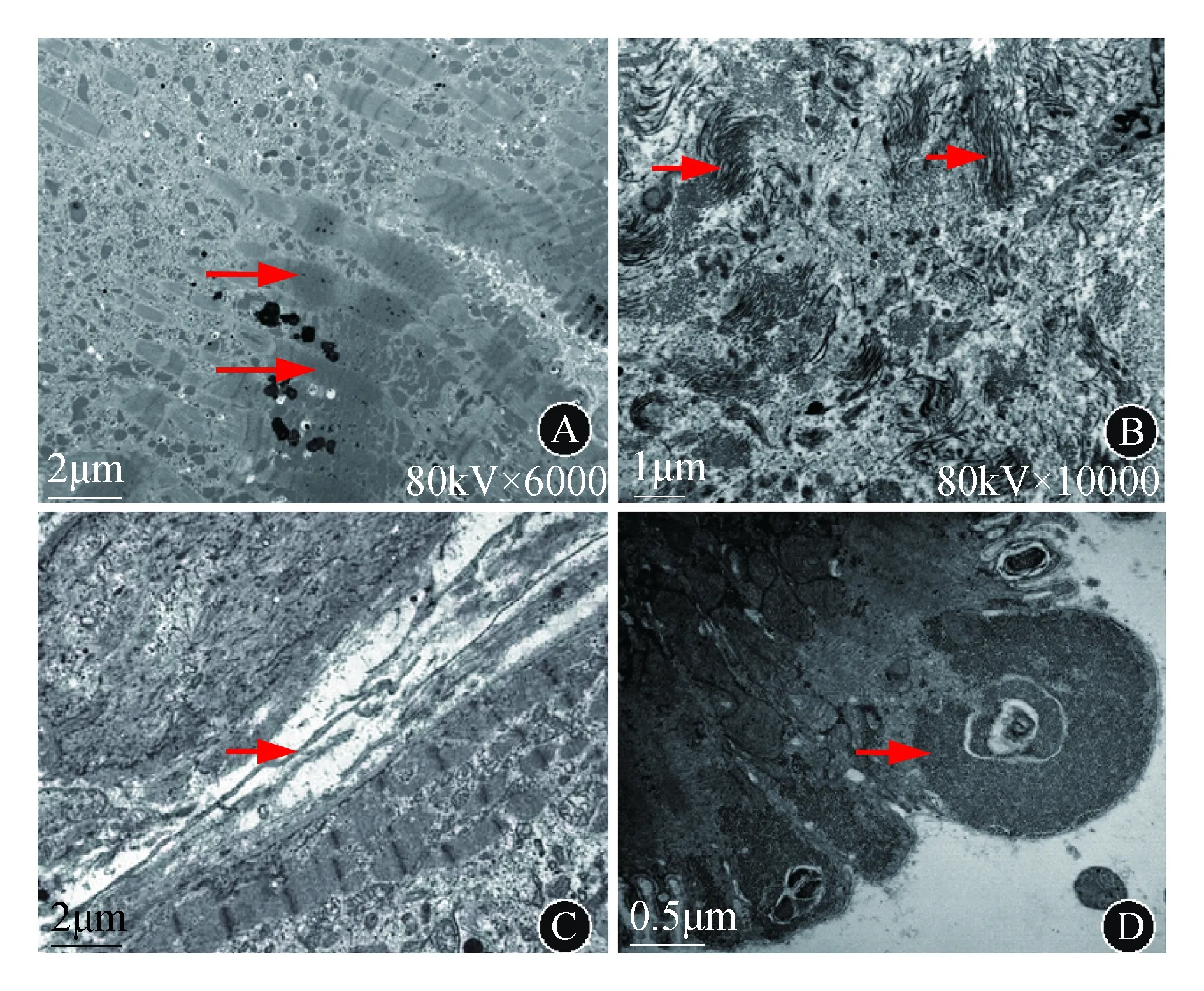
A:肌丝结构紊乱,肌丝束结构不良,肌节过度收缩,可见“致密带”(箭头所示)(图片来源于作者研究的标本,尚未发表);B:间质中大量Ⅰ型胶原(箭头所示)(图片来源于作者的研究标本,尚未发表);C:两细胞间间质增宽,间质中可见TCs(箭头所示)[6];D:心肌细胞代谢异常,糖原增多(箭头所示)(图片来源于作者的研究标本,尚未发表)图2 IDC电镜表现
IDC为遗传易感性与环境因素共同作用的结果[5],分子遗传学及全基因连锁分析检测技术揭示了其部分病因,包括编码肌小节蛋白的基因、编码细胞骨架蛋白(MLP20、Desmin、Tafazzin、Cyper/ZASP)的基因、编码核膜骨架的基因、编码肌营养蛋白的基因、线粒体基因及编码离子通道(SCN5A)的基因等。然而,IDC的致病基因具有一定的不完全外显率,即携带致病性突变的个体未出现表型,或虽未携带致病性突变基因,而修饰基因、种族和生活方式等也可能导致个体出现表型。有报道柯萨奇及其他肠道病毒的感染可能与IDC相关[7]。
2 HCM
HCM以左心室或右心室肥厚为特点,多呈不对称性肥厚且常累及室间隔,左心室容积多正常或减低,收缩梯度正常。常染色体显性遗传、不完全外显,因肌原纤维收缩蛋白基因突变致病。临床上诊断HCM,即无法解释的左心室壁厚度>15 mm,同时不伴有左心腔的扩大。常见心律失常及青少年时期猝死。
HCM的病理形态学主要诊断依据[8]:左心室或右心室肥厚,心脏质量增加(图3A)。组织学表型为心肌细胞肥大及心肌细胞和肌丝束排列紊乱并环绕增生的疏松结缔组织,心壁内小动脉管壁增厚,具体表现为心肌细胞肥大,正常心肌细胞直径10~20 μm,长80~150 μm,细胞肥大表现为横径与长径均增加,细胞核浓染、增大并畸形,胞质内空泡变性,排列紊乱即心肌纤维极向紊乱或心肌细胞无序排列(图3B);小血管病变,表现为心壁内小冠状动脉管壁增厚,主要为中膜肥厚,平滑肌细胞增生及极向紊乱,管腔内径缩小,甚至闭塞(图3C);其他特征包括间质纤维化、心内膜纤维性增厚等。
HCM超微形态学表型包括[6]:心肌细胞内广泛的肌丝束排列紊乱,心肌细胞肥大并被间质分隔,心壁内小冠状动脉中膜的平滑肌细胞及毛细血管内皮细胞增生、基底膜增厚等。透射电镜进一步观察到HCM心肌细胞内的结构异常:肌节结构异常,如肌节中的标志性结构,即Z线、M线、I带、H带、A带等形态模糊、结构变异或缺失;肌丝束极向紊乱,相邻肌丝束呈直角排列(图4A),肌丝束之间和同一肌丝束内部形成广泛的分支状连接,这些异常在HCM中出现的概率较其他类型心肌病更高,病变范围更广泛;较原发性心肌病其他类型表现更为突出的是,HCM的间质成分经增宽的心肌细胞膜间隙和(或)T管延伸入心肌细胞内,致使部分胞质被包裹并与细胞主体分离,甚至胞质被分割成多个大小不等的岛状(图4B);部分心肌细胞发育不良,但程度轻于ARVC、左室致密化不全。
心脏超声已经成为影像诊断HCM最主要的方式,但某些病变较为局限或病变程度较轻的患者则较难获得准确的诊断。心脏磁共振(CMR)得到广泛的应用及越来越多的关注,有研究显示,HCM患者猝死风险的高低与CMR显示的延迟增强节段数量成正比,若>15%的左室心肌组织发生了延迟增强,则该患者的猝死风险是没有延迟增强患者的2倍[10]。目前已认识到大部分HCM符合常染色体显性遗传的特性,但也存在散发病例,区别在于散发型患者的基因突变可能不来自遗传,而是新生基因突变[11]。目前已经确定至少存在25个相关致病基因,在这些致病基因中,β肌球蛋白重链基因(MYH7)、肌球蛋白结合蛋白C基因(MYBPC3)及心肌肌钙蛋白T基因(TnT)是3个最常见的突变基因,约占总数的50%左右。HCM患者的基因型与临床表型之间存在一定的关联性。
3 原发性限制型心肌病(primary restrictive cardiomyopathy,PRCM)
PRCM是一种少见类型的心肌病,主要临床表现为心脏舒张功能严重受损,心室充盈受限,舒张期容积减少,但室壁厚度和射血分数可正常或接近正常,总体预后较差,且栓塞并发症较多见。
PRCM的病理形态学主要诊断依据[12]:大体表现为心脏外形常呈锥形、僵硬,体积及质量无明显增加,双心房扩张,尤以左房显著,心房内膜增厚呈瓷白色,左心室腔无扩张或狭小或轻度扩张(图5A),可有附壁血栓形成。组织学改变可呈单侧或双侧心室受累,病程晚期可表现为心腔闭塞。心内膜及心肌间质的纤维化,以心内膜为主要表现者,心内膜纤维组织增生,并有向心肌内延伸和锚入现象(图5B),心内膜表层为玻璃样变的纤维组织,中层则以密集的胶原纤维为主,下层为较多的成纤维细胞及纤细的胶原,并插入心肌间,与其间的纤维组织相连包绕心肌细胞,增生的纤维组织中可出现钙化、小血管增生及炎细胞浸润,心内膜下的心肌间质纤维化常局限于心壁的内2/3层;以心肌间质纤维化为主要表现者,心内膜增厚不明显,心肌间质纤维组织大量增生,呈蜂巢状包绕心肌细胞(图5C),可融合成小灶瘢痕,心肌细胞常有变形及纤维分隔所致的极向紊乱。
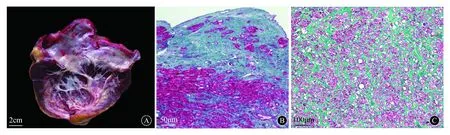
A:左心室心内膜心肌纤维化型大体表现:左心房扩张,内膜呈瓷白色,左心室室腔扩张,内膜呈瓷白色,室壁无增厚,切面见灰白色纤细条纹由内膜向肌层穿插,累及内2/3层[6];B:Masson染色显示,心内膜纤维化为主要表现,心内膜纤维化、增厚,向心肌内延伸、锚入[6];C:Masson染色显示,心肌间质纤维化为主要表现,增生的纤维组织呈蜂巢状包绕心肌细胞[6]图5 PRCM大体形态与光镜表现

A:心内膜纤维化为主要表现,心内膜下间质内见多个成纤维细胞,周围大量胶原沉积[6];B:心肌细胞间质纤维化为主要表现,大量纤维围绕心肌细胞,间质以胶原纤维增多为主[6];C:毛细血管周围纤维化[6]图6 PRCM电镜表现
心内膜心肌活检可见[13]:以胶原纤维增生为主要改变,心内膜炎细胞浸润,心内膜下心肌细胞变性坏死、心肌细胞肥大,间质纤维化,偶见心内膜纤维化,部分可见附壁血栓。
PRCM超微形态学表型[6]多样,心肌细胞及间质成分的改变均较复杂,间质有不同类型胶原成分的沉积(主要为Ⅰ型及Ⅲ型),心肌细胞存在继发性改变,还有多种发育不良表现。心内膜、心肌细胞及血管周围的间质成分大量增生,其中细胞成分较少,主要为均质的细胞外基质,散在粗大的Ⅰ型胶原纤维束,杂乱无序排列(图6)。
PRCM的概念近年来有所更新,2006年美国心脏协会原发性心肌病分类[14]中,将由于全身性疾病累及心脏而呈限制性表现者均归为继发性心肌病,如淀粉样变(原发性、家族性常染色体显性遗传性、老年性)、高歇病(Gaucher disease)、Hunter病等归为继发性心肌病亚类的浸润性心肌病,心内膜纤维化、高嗜酸性粒细胞综合征(Lueffler’s myocarditis)归为继发性心肌病亚类的心内膜疾病。另外,心脏移植后发生多次重度排异反应后可能呈限制性表现。
4 ARVC
ARVC又称致心律失常性右室发育不良(arrhythmogenic right ventricular dysplasia,ARVD),以纤维脂肪组织进行性替代右心室心肌为特点,初期按典型区域分布,随即可出现全部右心室及部分左心室受累,室间隔受累相对较轻。按解剖部位可分为右室型、左室型及双室型,按组织形态学可分为脂肪纤维型及纤维脂肪型。多为常染色体显性遗传、不完全外显,有报道称存在隐性遗传的类型。常表现为心律失常及猝死,青少年多见。
ARVC/D病理形态学主要诊断依据[15]:病变部位主要在右心室,亦可累及左心室,心室游离壁全层的2/3以上被脂肪纤维或纤维脂肪替代,典型特征为右心室游离壁心肌呈弥漫性或节段性缺失,代之以脂肪纤维或纤维脂肪组织(图7A)。Angelini提出的诊断标准:浸润的脂肪组织和(或)纤维脂肪组织应分别≥心肌组织的30%和40%。脂肪纤维型表现为心肌被脂肪组织替代,伴有纤维组织,无炎性浸润(图7B);纤维脂肪型表现为心肌被纤维脂肪组织替代(图7C),可见炎细胞浸润,免疫组化CD43、CD45、CD3及CD68等呈阳性表达。
ARVC/D超微结构表型[6]:脂肪纤维/纤维脂肪在心肌细胞内、外异常累积,心肌细胞内、外脂滴异常累积(图7D);多种形态的闰盘发育异常,如心肌组织存在桥粒异常等闰盘结构异常(图7D),推测是基因异常导致闰盘结构异常,致使心肌细胞连接障碍,引发一系列后续事件,包括细胞凋亡、死亡、纤维脂肪替代以及电活动不稳定等;不同发育阶段的心肌细胞,如幼稚心肌细胞,肌丝束稀少或缺失、极向紊乱,肌节结构异常;心肌的继发改变,如心肌细胞收缩不良,胞质内有大量溶酶体聚集;心肌细胞胞核及其他细胞器的改变,如胞核发育不良、核内脂滴、线粒体变性等。
异常的组织学提供主要的诊断标准[17],但尚缺乏足够的经验进行明确的解读。近来有报道,心肌活检标本的免疫组化分析可能提供高敏感性与特异性测试来诊断ARVC/D。有研究发现,与对照组相比,ARVC/D患者的心肌组织中盘状球蛋白(plakoglobin)染色水平降低[18]。盘状球蛋白染色水平在看似正常但具有纤维脂肪型表现的左心室或右心室降低,但在DCM中也有相似的表现,因此其特异性和临床价值有待商榷[17]。尸检证据发现,心房的病理改变与其心室相似,均有心肌细胞减少、脂肪细胞增多及心房壁间质纤维化,其中心房壁间质纤维化在心房颤动但不伴ARVC/D的患者中也有相似表现,这或许是ARVC/D患者心房颤动高发的原因[16,19]。
5 特异性心肌病
特异性心肌病包括缺血性、瓣膜性、高血压性、炎症性、代谢性、系统疾病性、家族遗传性、过敏与中毒性、围产期心肌病等多种类型心肌病。根据病因有不同的病理表现,这里不做赘述。
6 未分类的心肌病
无法分属其他类型的心肌病,如纤维弹性组织增生、致密化不全、收缩功能障碍伴轻度扩张、线粒体功能异常等不同类型心肌病,以心室肌致密化不全(non-compaction of ventricular myocardium,NVM)为例进行阐述。
NVM是心室肌发育不全的一种罕见类型的先天性畸形,由于心内膜形态学发生受到限制或停止而导致发育中的肌小梁致密化失败所致。该病多为散发,亦有家族性发病报道[20],儿童孤立性NVM的检出率约为0.014%,是儿童心肌病第3种常见类型,目前尚不清楚NVM成年人群的患病率。NVM起病隐匿,临床表现无特殊性,个体差异较大,病程进展由非致密化心肌范围和慢性缺血程度决定,以心室收缩和舒张功能不全、进行性加重的心力衰竭为主,主要表现为心功能不全、心律失常和栓塞,常伴有胸痛、晕厥、阵发性呼吸困难、发绀等。该病首次报道于1926年,又称“海绵状心肌”或“左室致密化不全”。根据部位不同分为左室型、右室型及双室型,以在左室型发病率最高,NVM男性多于女性,占56%~83%。由于NVM患者病程并非如先前所预料的那样,一旦发病心功能即恶化,在儿童患者中,病程中间会出现长短不一的功能恢复期,所以成年人发病率高。目前,NVM病因大致分为以下4类:遗传综合征的一部分、先天性代谢异常(inborn error of metabolism,IEM)、单基因改变、环境及血流动力学因素[21]。
NVM病理形态学主要诊断依据[21]:多累及左心室,典型部位在左心室心尖部及前壁和侧壁的中下部,偶见右心室或双心室受累,心室腔缩小,心室腔内壁的小梁层高度增厚,呈异常粗大的肌小梁及交错深陷的小梁间隐窝表型,心室壁小梁层与致密层的厚度比值≥2.0(图8A),亦可出现致密层和小梁层层叠相间结构,若合并左心室扩张或肥大,可有心腔扩张等表现。组织学改变的典型表现为心内膜常增厚,肌小梁异常粗大,小梁间隐窝深陷,隐窝表面被覆的内膜与心室腔内膜相连续,致密层和小梁状的心肌内毛细血管丰富,心内膜及心肌间质内有胚胎早期的残留物,如华通胶(Wharton’s jelly)、梭形原始细胞等,可有淋巴细胞浸润,肌丝束排列紊乱,肌丝束间小片纤维化,可出现微循环缺血改变;根据光镜表现分为3种组织学类型,即黏液基质型、纤维脂肪浸润型和心肌细胞密集型。
NVM超微结构表型包括[6]:心内膜及心肌层的多种异常,包括心肌细胞内细胞器的发育不良和结构改变,胚胎期的残留物以及心肌细胞和间质的继发性改变等,尤其在心肌细胞内较轻易观察到有以基质样物为主的片状区域,其内几乎没有肌丝束及细胞器等结构(图8B),此种空化表型可见于不同发育阶段及成熟的心肌细胞。
7 小结
我们目前对心肌病病理的认识有限,在病理结果的解读上存在很多疑问,如目前的病理发现是特异性还是非特异性的,以及是否存在病种间的特异性尚不十分清楚,因此心肌病病理诊断应更加谨慎全面,不仅包括大体标本的肉眼观察(如尸检)、光镜的组织学观察以及超微形态学观察,同时需要结合患者的临床情况、影像学等方面的资料综合考虑。随着对心肌病发病及遗传机制认识的不断深入,基于遗传相关因素的分类在心肌病的诊断、治疗上显得愈发重要[22]。此外,我们在心肌病的生理学、病理学、免疫学和心肌细胞代谢组学方面的进一步认识,结合电镜、分子生物学、分子免疫学及流式细胞学等技术在心肌病研究及临床中应用,我们对心肌病的认识将更加全面、深入,可使心肌病的诊断更加完善,将有助于改善患者的诊治效果及预后。
致谢
中国医学科学院阜外医院病理科赵红教授为本文提供了精美的图片及她对原发性心肌病超微病理学的认识,在此特别感谢。
利益冲突:无

