A型钾通道在正常大鼠小脑皮层中的表达*
王斯颖,余鑫钰, 杨培培,刘茂雪,胡红利,唐 新,邓杰文,黄 成,张 洁,林友胜△
1.成都医学院 检验医学院(成都 610500);2.成都医学院 基础医学院(成都 610500);3.成都医学院 临床医学院(成都 610500)
A型钾通道属于电压门控型钾通道,包括5种亚型,即Kv4.1、Kv4.2、Kv4.3、Kv3.4和Kv1.4[1-3]。由A型钾通道介导的IA电流是动作电位复极化早期外向电流的主要成分,它具有快速激活、快速失活的特点,在调节神经元放电频率及放电模式等方面具有重要作用[1-3]。A型钾通道的不同亚型在各脑区的分布不同。原位杂交实验[3]表明,Kv4.1mRNA在各脑区表达水平低,但Kv4.2、Kv4.3mRNA表达水平较高,且具有特定的分布模式。如Kv4.2主要分布在延髓、脑桥核、尾核和壳核;而Kv4.3主要表达在杏仁核、中缝核、压后皮层、黑质致密部、上丘等[4]。Kv4.2、Kv4.3在有些脑区表达,但在不同细胞群的分布也有差异。例如,在嗅球,Kv4.2主要分布在颗粒细胞中,而Kv4.3主要分布在球周细胞[5]。本实验采用实时荧光定量PCR技术鉴定成年雄性SD大鼠小脑皮层A型钾通道的主要亚型,然后进行免疫荧光染色,观察小脑皮层主要A型钾通道亚型在小脑皮层神经元上的分布和定位,为有关A型钾通道参与小脑功能调控的研究提供实验资料。
1 材料与方法
1.1 实验动物
健康成年雄性SD大鼠(250~300 g)由成都达硕实验动物有限公司提供,随机抽取6只进行实时荧光定量PCR实验,6只进行免疫荧光染色实验。
1.2 主要试剂
焦碳酸二乙酯(DEPC)购自美国Sigma公司;Trizol和琼脂糖购自美国Invitrogen公司;RNALater和荧光二抗购自美国Life公司;gDNA Ereaser With PrimeScript RT reagent Kit购自大连宝生物工程有限公司;FastStart Essential Probes Master购自瑞士Roche公司;兔抗Kv4.2抗体(APC-023)、兔抗Kv4.3抗体(APC-017)和兔抗Kv3.4抗体(APC-019)购自以色列Alomone公司;戊巴比妥钠、磷酸二氢钾、磷酸二氢钠、氯化钾、氯化钠、无水乙醇和氯仿购自成都科龙化工试剂有限公司。
1.3 实验仪器与设备
实时荧光定量聚合酶链反应(qRT-PCR)仪(PIKORed 96,美国ThermoFisher仪器有限公司);紫外分光光度计(NanoDrop2000,美国ThermoFisher仪器有限公司);低温离心机(C2500,湖南湘仪实验仪器厂); KD-BM Ⅱ组织包埋机(浙江科迪仪器设备有限公司);TC-120型组织自动脱水机(湖北泰维科技实业有限公司);显微镜拍摄及成像系统(BX41,日本Olympus 公司)。
1.4 探针和引物
使用选自瑞士Roche公司探针库的探针进行实时荧光定量PCR,扩增所需的引物为匹配探针的特异引物,探针购自Roche公司,引物由成都擎科梓熙生物技术有限公司合成(表1)。
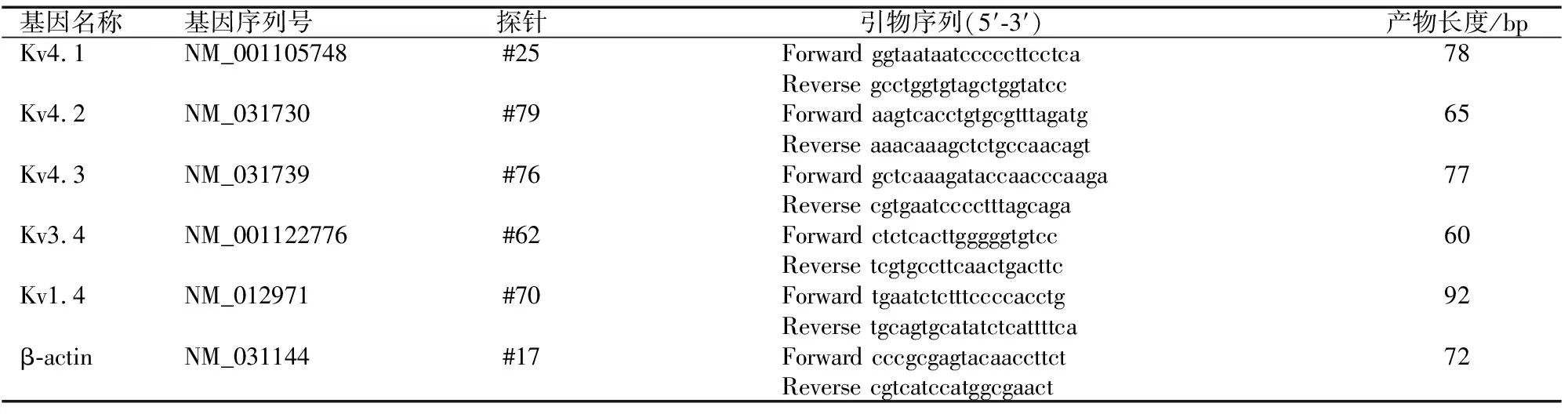
表1 实时荧光定量PCR探针和引物序列
1.5 qRT-PCR
1.5.1 取材 腹腔内注射戊巴比妥钠(40 mg/kg)麻醉雄性SD成年大鼠后,断头取脑,迅速剥离小脑皮层,置于RNALater中4 ℃过夜后,储存在-20 ℃保存备用。
1.5.2 总RNA提取和定量 按Trizol试剂的说明书,提取组织RNA并溶解于15 μL无RNA酶水中,用紫外分光光度计测定RNA浓度和纯度,OD260/280为 1.7~2.0。
1.5.3 cDNA 的合成 用gDNA Eraser去除基因组DNA后,以Oligo-dT为引物进行反转录得到cDNA。
1.5.4 qRT-PCR检测靶基因mRNA表达 10 μL定量PCR反应体系:上、下游引物(10 μmol/L)各0.15 μL,UPL探针0.15 μL,cDNA 2 μL, FastStart Essential Probes Master 5 μL,加超纯水至反应总体积为10 μL。反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,读取荧光值,循环40次;最后40 ℃延伸30 s。用灭菌水代替模板cDNA作为阴性对照;用看家基因β-actin作为实时荧光定量PCR反应的内参照。分别测定每个样品目的基因和β-actin mRNA的临界循环数(Ct),每个样品均作复孔以减少操作误差。基因的表达水平用Ct值表示,各样本△Ct值是用靶基因Ct值-内参基因Ct值的相对定量法求得,表示样本相对于内参基因的表达水平,通过比较各靶基因的△Ct值分析基因表达的相对差异。△Ct值越高,mRNA的量越少。
1.6 免疫荧光染色
1.6.1 灌注取材和切片 腹腔注射戊巴比妥钠(40 mg/kg)麻醉成年雄性SD大鼠后,0.9%生理盐水150~200 mL灌注至右心耳流出的液体清澈时,更换4%多聚甲醛溶液快速灌注至动物四肢抽动,再慢速灌至动物四肢变硬,然后取小脑并置于4%多聚甲醛溶液中,4 ℃过夜。经脱水、透明和包埋后,用石蜡切片机进行连续冠状切片,片厚5 μm,等距抽片。
1.6.2 免疫荧光染色观察 按常规方法进行免疫荧光染色,一抗分别用兔抗Kv3.4、兔抗Kv4.2和兔抗Kv4.3多克隆抗体,二抗用驴抗兔荧光二抗(绿色荧光Alexa488,红色荧光Alexa647),DAPI复染细胞核,封片,在暗室条件下进行荧光显微镜观察。
1.7 统计学方法
2 结果
2.1 大鼠小脑皮层A型钾通道亚型mRNA表达分析
在6只大鼠的所有样品均检出Kv4.1、Kv4.2、Kv4.3、Kv3.4和Kv1.4 mRNA表达。大鼠小脑皮层内Kv4.3 mRNA表达丰度最高,其次为Kv4.2和Kv3.4,Kv4.3、Kv4.2和Kv3.4 mRNA表达丰度明显高于Kv4.1和Kv1.4mRNA (P<0.01)(表2)。
表2 大鼠小脑皮层A型钾通道亚型mRNA的相对含量
注: 与Kv4.1和Kv1.4mRNA比较,#P<0.01
2.2 Kv3.4、Kv4.2和Kv4.3蛋白在小脑皮层中的表达定位
免疫荧光染色实验发现,Kv3.4、Kv4.2和Kv4.3蛋白在小脑皮层均有表达,主要位于细胞膜和细胞质,但这3种A型钾通道亚型分布在不同的小脑皮层细胞群;Kv3.4表达在小脑普肯野氏细胞,在颗粒细胞未见Kv3.4阳性产物;Kv4.2表达在小脑颗粒细胞,在普肯野氏细胞未见Kv4.2阳性产物;而Kv4.3在小脑普肯野氏细胞和颗粒细胞均有表达(图1)。
注:A、D、G:Kv3.4、Kv4.2和Kv4.3阳性神经元;B、E、H:DAPI染的细胞核;C、F、I:Kv3.4、Kv4.2和Kv4.3与DAPI共标
3 讨论
小脑的表面覆盖着一层灰质即小脑皮质,皮质内含有星型细胞、篮细胞、浦肯野氏细胞、高尔基细胞和颗粒细胞等神经细胞[6]。小脑皮层将来自大脑皮层、脑干和脊髓的传入投射,经精密分析与整合后,由浦肯野氏细胞发出各种输出指令,调控机体的平衡和眼球运动,协助大脑皮层控制随意运动,并参与随意运动的设计和编程[6]。小脑皮层主要通过攀缘纤维和苔藓纤维传递外部信息,参与精细运动的调节[6]。其中,苔藓纤维来自脊髓和脑干的核群,传递产生感觉和协调运动的信息,并将信息传递给颗粒细胞,经颗粒细胞的平行纤维而兴奋浦肯野氏细胞,参与运动的调节[7-8]。
A型钾通道在调节神经元的放电频率,动作电位的产生以及放电模式等方面具有重要作用[1]。采用实时荧光定量PCR技术在6只大鼠小脑皮层均检出Kv4.1、Kv4.2、Kv4.3、Kv3.4和Kv1.4mRNA表达,其中Kv4.3 mRNA表达丰度最高,其次为Kv4.2和Kv3.4;Kv4.3、Kv4.2和Kv3.4mRNA表达丰度明显高于Kv1.4和Kv4.1 mRNA;提示大鼠小脑皮层主要表达Kv4.3、Kv4.2和Kv3.4 3种A型钾通道亚型,这和臂旁外侧核的A型钾通道亚型相似[9]。采用免疫荧光染色方法观察到这3种主要A型钾通道亚型在小脑不同神经细胞群上分布不同,Kv3.4表达在皮层普肯野氏细胞,在小脑颗粒细胞未见Kv3.4阳性产物;Kv4.2表达在小脑颗粒细胞,在小脑普肯野氏细胞未见Kv4.2阳性产物;而Kv4.3在小脑普肯野氏细胞和颗粒细胞均有表达。小脑皮层浦肯野氏细胞具有整合功能,接收所有其它神经元的投射,其轴突是小脑皮层的唯一输出通路,Kv3.4、Kv4.3在小脑普肯野氏细胞均有表达,提示Kv3.4、Kv4.3可能通过调节突触输入、动作电位起始和反向传播等,参与小脑普肯野氏细胞的整合功能,调节小脑的运动输出。小脑皮层颗粒细胞参与外部信息传入,调节精细运动和运动学习,在小脑皮层颗粒细胞表达Kv4.2、Kv4.3,表明Kv4.2与Kv4.3可能参与了小脑外部传入信息的调控。
综上所述,本实验证实正常大鼠小脑皮层中存在A型钾通道表达,其主要亚型为Kv3.4、Kv4.2和Kv4.3,且不同亚型在小脑皮层不同神经细胞群上分布不同,可能在小脑皮层运动调节中发挥着不同作用。

