痛风性关节炎中IL-1β/Caspase-1介导的细胞焦亡的作用研究*
石 娇,吴东明,李 静,许 颖
成都医学院第一附属医院 检验科(成都610500)
痛风性关节炎是由于体内尿酸代谢异常引起的高尿酸症,过多的尿酸钠(monosodium urate, MSU)晶体沉积于关节腔、滑膜、软骨等关节组织而导致炎性病变[1]。随着人们生活质量的提高,生活方式和饮食习惯发生变化,痛风性关节炎的发病率和患病率在全球范围内快速增长且有年轻化趋势,目前我国痛风性关节炎的患病率约为1%~3%[2-3]。
近几年研究[4]发现,细胞焦亡在心血管、内分泌、感染性等多种疾病的发生、发展中均有参与。细胞焦亡是一种有别于细胞凋亡和细胞坏死的炎症性程序性死亡模式,细胞焦亡过程中核苷酸结合寡聚化结构域(nucleotide-binding oligomerizatiin domain, NOD)样受体(NOD-like receptor, NLR)炎性小体、半胱氨酸天冬氨酸蛋白水解酶1(caspase-1)等蛋白质和复合物发挥着重要作用[5]。目前,细胞焦亡是否参与痛风性关节炎的发病机制尚无研究,因此本研究拟通过检测急性痛风性关节炎患者血清中白细胞介素1β(Interleuin-1beta, IL-1β)和PBMCs(peripheral blood mononuclear cells, PBMCs)中IL-1β及caspase-1的表达水平,探讨细胞焦亡与痛风性关节炎疾病的发生、发展的关系,为疾病的诊断、治疗及防治提供依据。
1 资料与方法
1.1 临床资料
选取2018年8月至2019年3月于成都医学院第一附属医院门诊就诊的急性痛风性关节炎患者40例,正常对照组选取体检中心实验指标正常的健康体检人群40例。纳入标准:所有急性痛风性关节炎患者均符合1977年美国风湿协会(American college of rheumatology, ACR)急性痛风性关节炎的分类标准;发病后未服用糖皮质激素、秋水仙碱等药物。排除标准:合并心脑血管疾病、肾脏系统、内分泌系统、呼吸系统、消化系统、感染性及自身免疫相关疾病。40例急性痛风性关节炎患者(acute gout, AG)和健康对照者(healthy controls, HC)分别为AG组、HC组。
1.2 材料
IL-1β酶联免疫吸附试剂盒购自上海生物工程有限公司;样本密度分离液购自天津灏洋华科生物科技有限公司;RPMI-1640培养基购自江苏长星医疗科技有限公司;MD-AIM-V细胞培养基购自美德太平洋(天津)生物科技股份有限公司;IL-1β抗体、caspase-1购自Abcom公司;生化试剂购自迈克生物有限公司;其余试剂、耗材购自上海碧云天生物技术有限公司。
1.3 标本采集及处理
分别采集AG组和HC组肝素抗凝全血5 mL,用样本密度分离液分离全血中的PBMCs,将分离得到的PBMCs中加入MD-AIM-V细胞培养基300 μL吹打混匀后备用。采用全自动血球分析仪(希森美康XS-500i)进行 PBMCs的纯度验证。采用免疫印迹法检测PBMCs中IL-1β、caspase-1的蛋白水平:对收集备用的PBMCs于4 ℃下以12 000 r/min离 心10 min后,通过调整蛋白浓度至6 mg/L后进行蛋白表达检测,记录并进行灰度值分析,将目的蛋白与内参蛋白(β-actin)灰度值比较,作为目的蛋白的相对表达量。
同时分别采集AG组和HC组静脉血4 mL,3 500 r/min离心5 min后,分离血清备用。采用全自动生化分析仪(日立式7600型)检测血清中尿酸(uric acid, UA)、肌酐(creatinine, CREA)、血尿素氮(blood urea nitrogen, BUN)、谷氨酸氨基转移酶(alaninetransaminase, ALT)、天门冬氨酸氨基转移酶(aspartateaminotransferase, AST)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、前白蛋白(prealbumin, PA)的含量。采用酶联免疫吸附法(ELISA)检测血清中IL-1β表达。
1.4 统计学方法
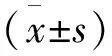
2 结果
2.1 PBMCs的验证结果
PBMCs是外周血单个核细胞,其包括淋巴细胞(lymphocyte, LYMP)和单核细胞(monocyte, MONO)。AG组和HC组全血分离的细胞主要为PBMCs,纯度达(94.91±2.40)%(表1、图1)。
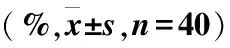
表1 AG组与HC组 PBMCs验证结果
2.2 两组PBMCs中IL-1β和caspase-1的免疫印迹法分析结果
两组PBMCs中IL-1β和caspase-1的免疫印迹法分析结果提示,AG组较HC组IL-1β和caspase-1表达水平增强(图2)。
2.3 两组UA、CREA、BUN、PA、ALT、AST、TP、ALB的检测结果
AG组与HC组年龄、TP和ALB差异无统计学意义(P>0.05),AST、ALT差异有统计学意义(P<0.05),UA、CREA、BUN、PA差异有统计学意义(P<0.01)(表2)。
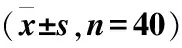
表2 AG组与HC 组一般临床资料
2.4 AG组与HC组血清中IL-1β检测结果
GA组的IL-1β的表达比HC组明显升高,GA组IL-1β表达量为(1.08±0.79) μg/L,HC组IL-1β表达量为(0.30±0.08)μg/L,差异有统计学意义(t=6.036,P<0.001)(图3)。
2.5 AG组UA、BUN、CREA与IL-1β相关性比较
血清UA与IL-1β呈正相关性(r=0.501,P=0.004),血清BUN、CREA与IL-1β无相关性(图4)。
3 讨论
近年来,由于痛风性关节炎对组织器官的严重损害以及多样化的并发症使其成为困扰人类健康的一大难题。目前痛风性关节炎的诊断主要依靠临床表现和影像学检查[3]。实验室检测指标主要有血清中尿酸含量检测和关节炎发作时关节液微生物培养情况,但关节液的采集比较困难且微生物培养周期用时长,不利于作为常规检查开展,因此需寻找更多有效的实验室检测指标用于急性痛风性关节炎的早期诊断及鉴别诊断,以及为监测患者治疗期间的变化提供有效的帮助。在本研究中,除UA在AG组较HC组升高,还可见BUN、CREA、PA、ALT、AST等指标呈增加趋势,这是因为在痛风性关节炎发展过程中,体内尿酸的生成增多,而肾脏排泄减少,加重体内肾脏和肝脏代谢负担,从而出现肝功能和肾功能的指标异常变化。血清中BUN、CREA、PA、ALT、AST的含量变化可用作评估急性痛风性关节炎的伴随症状。
痛风性关节炎的病理生理不仅与高尿酸血症有关,还涉及炎症小体的激活。炎症反应是参与介导急性痛风性关节炎的一个重要过程,本研究中可见,血清中IL-1β在AG组的表达较HC组有明显升高,Ma等[5-6]也证实痛风性关节炎炎症反应与炎性因子IL-1β的表达增加有关。IL-1β属于IL-1的分泌型,是血液循环中主要存在的形式,也是MSU晶体诱导炎症反应的关键因子,IL-1β参与急性痛风性关节炎炎症的发生发展,可作为痛风性关节炎急性发作指标。本研究进一步发现PBMCs中IL-1β和caspase-1蛋白水平的表达,AG组IL-1β和caspase-1蛋白水平明显高于HC组。caspase-1蛋白水平的表达增加与核苷酸结合寡聚化结构域样受体3(NLR family, Pyrin domain containing 3, NLRP3)炎症小体介导的细胞焦亡信号通路有关[7-9]。细胞焦亡经典激活途径主要表现为caspase-1的活化,NLRP3炎症小体激活,导致炎性因子的释放,从而诱发级联放大的炎性反应,对机体的免疫应答和免疫反应具有重要的调节作用[10-11]。急性痛风性关节炎发病过程是由于关节腔内尿酸盐浓度急剧增加,导致MSU晶体的不断形成,MSU晶体作为内源性损伤相关因子激活NLRP3炎症小体组装,活化的NLRP3炎性小体剪切caspase-1前体形成成熟的caspase-1,caspase-1继而切割IL-1β前体,促进IL-1β的成熟及分泌,最终导致痛风性关节炎的炎性反应[12]。房树标等[12]研究采用IL-1β的抑制剂后发现,caspase-1表达减少,NLRP3炎性小体的信号通路降低,进一步证实了IL-1β的产生与caspase-1介导的NLRP3信号通路有关。
综上所述,IL-1β和caspase-1介导的细胞焦亡在痛风性关节炎的发生、发展中有重要作用。但caspase-1介导的细胞焦亡过程中除有IL-1β释放,还有白细胞介素18(Interleuin-18, IL-18)等炎性因子释放,后续的研究中将继续检测更多的焦亡指标,进一步验证细胞焦亡在痛风性关节炎中的作用。

