miR-381-3p靶向特异性蛋白1抑制mTOR/p70s6k信号通路调控食管癌细胞的增殖和凋亡*
木亚林,岳 恺,李 明
南阳市中心医院 肿瘤内科 (南阳 473000)
食管癌(esophageal carcinoma, EC)是世界上最常见和致命的恶性肿瘤之一,发病率排名第八,死亡率高居第六,每年有30 万人死于食道癌[1]。虽然诊断和治疗技术均有所改善,但由于预后不良和复发,食管癌仍然很难痊愈,5年生存率约为10%[2]。因此,迫切需要探索食管癌的分子机制和食管癌早期诊断的生物标志物,为改善EC患者的长期生存提供新的治疗策略。已有研究表明miR-381 能够抑制宫颈癌[3]、甲状腺乳头状癌[4]、口腔鳞癌[5]等多种肿瘤的增殖、迁移和侵袭,但是其对食管癌的作用尚不清楚,有待进一步研究。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是磷酸肌醇3激酶相关激酶家族的一种丝氨酸/苏氨酸激酶,可通过激活核糖体激酶来调节肿瘤细胞的增殖、存活和侵袭转移[6]。p70s6激酶(the p70s6 kinase,p70s6k)是mTOR/p70s6k信号通路下游mTOR的主要效应器[7]。mTOR/p70s6k信号通路调控许多肿瘤的存活和细胞增殖,在包括食管癌在内的多种肿瘤中普遍被激活[8]。特异性蛋白1(specificity protein 1,SP1)是一种转录因子,在调节肿瘤细胞的增殖、凋亡和迁移中发挥重要作用。已有研究[9]表明SP1在食管癌中高表达,且与预后不良有关。本文主要探讨miR-381-3p靶向SP1抑制mTOR/p70s6k信号通路对食管癌细胞的增殖和凋亡调控作用。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂 改良杜氏伊格尔培养基(dulbecco′s modified eagle medium,DMEM)购自上海善然生物科技有限公司;胎牛血清购自上海素尔生物科技有限公司;miR-381-3p mimic 质粒、miR-control质粒、SP1质粒及各引物均由上海基因制药有限公司设计并合成;Lipofectamine 2000转染试剂购自上海恪敏生物科技有限公司;QIAzol裂解试剂、cDNA逆转录试剂盒购自上海捷瑞生物工程有限公司; SYBR-Green PCR试剂盒购自上海赛默飞世尔科技公司,双荧光素酶报告基因检测试剂盒购自北京原平皓生物技术有限公司; RIPA裂解缓冲液购自南京海克尔生物科技有限公司; BCA试剂盒购自上海易色医疗科技有限公司; MTT试剂盒购自上海泽叶生物科技有限公司;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(WL02809)购自上海万类生物科技有限公司; Ki67抗体(AF1738)、半胱氨酸天冬氨酸蛋白酶3(cysteine aspartic acid protease 3,Caspase-3)抗体(AC031-2)、B淋巴细胞瘤2(b-celllymphoma,Bcl-2)抗体(AB112-1)购自上海碧云天生物技术研究所; Bcl-2相关X蛋白(Bax)抗体(ml120073)购自上海酶联生物科技有限公司;哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体(ab2732)、p-mTOR抗体(ab8440)购自上海艾博抗生物科技有限公司;p70s6激酶(the p70s6 kinase,p70s6k)抗体(SPC-1039D-A565)购自厦门研科生物技术有限公司;p-p70s6k抗体(AP0540)购自武汉爱博泰克生物科技有限公司,雷帕霉素购自上海爱必信生物科技有限公司。
1.1.2 细胞培养及标本来源 正常食管细胞(HEEC)和食管癌细胞(EC109、EC9706、TE1、KYSE450、KYSE790)购自美国模式培养物研究所,将细胞于含10% 胎牛血清、100 U/ mL的青霉素和100 μg/mL的链霉素的DMEM培养基中,在37 ℃,5%CO2下培养。收集患者术后新鲜食管癌组织及其癌旁正常组织( 距癌组织边缘≥2 cm) 作为检测样本,置于-80 ℃的冰箱中保存待检。
1.2 实验方法
1.2.1 细胞转染 取对数期细胞,接种于6孔板每孔(1×106个/mL)。当达到80% 融合,根据Lipofectamine 2000说明书将100 nmol/L 的miR-381-3p mimic 质粒、miR-control质粒、SP1质粒分别或联合转染进入EC9706细胞。
1.2.2 RT-qPCR 采用QIAzol裂解试剂提取总RNA,采用cDNA逆转录试剂盒合成cDNA。RT-qPCR采用SYBR-Green PCR试剂盒说明书操作进行。U6作为内参,使用2-ΔΔc t方法计算。miR-381-3p 的上游引物序列为:5′-CCAGUGCA CCGACCCUUGAG ACUGC-3′, miR-381-3p的下游引物序列为:5′-AGCCUAAACUCGGUCCAA GCAUC-3′; U6的上游引物序列:5′-CTCGCTTCG GCAGCACA-3′, U6的下游引物序列:5′-AACGC TTCACGAATTT GCGT-3′; SP1 的上游引物序列: 5′-TGGTGGGC AGTATGTTGT-3′,SP1 的下游引物序列: 5′-GC TATTGGCATTGGTGAA-3′。
1.2.3 靶基因预测 运用基因预测软件:TargetScan (http://www.targetscan.org)预测miR-381-3p的靶基因。
1.2.4 双荧光素酶报告检测靶向关系 〗收集对数期的EC9706细胞铺于96孔板,每孔约4×103个细胞,24 h后,分别转染miR-control+SP1 WT、miR-control+SP1 MUT 、miR-381-3p mimic+SP1 WT、miR-381-3p mimic +SP1 MUT,根据双荧光素酶报告基因试剂盒说明进行测定,用萤火虫荧光素酶活性和肾荧光素酶活性比值表示荧光素酶的相对活性。
1.2.5 MTT法检测细胞活性 根据MTT试剂盒说明进行操作:取对数期EC9706 细胞100 μL加入96孔板(1×104个/孔),转染后在37 ℃、5% CO2细胞培养箱培养48 h,加入10 μL溶液A,再培养4 h,小心吸弃培养基,加入溶液B,于摇床上低速振荡10 min,在570 nm波长处测定吸光值。
1.2.6 流式细胞术检测细胞凋亡 转染细胞培养24 h后离心, 按1×106个/mL的细胞浓度重悬。细胞悬液中加入5 μL异硫氰酸荧光素标记的磷脂结合蛋白V和5 μL碘化丙啶,在黑暗的房间里孵化15 min,然后用流式细胞仪分析细胞凋亡情况。
1.2.7 蛋白质印迹技术(Western blot) 收集各组EC9706细胞,用RIPA裂解液提取总蛋白,并用BCA试剂盒检测总蛋白浓度,然后经 12% SDS-PAGE分离蛋白后,用半干转膜仪转移蛋白质至硝酸纤维素膜,并用脱脂牛奶室温封闭蛋白2 h,再加入一抗(Ki67 1∶1 000、PCNA 1∶1 000、Bax 1∶500、Bcl-2 1∶1 000、Caspase-3 1∶1 000、mTOR 1∶1 000、p-mTOR 1∶2 000、p70s6k 1∶1 000、p-p70s6k 1∶1 000、SP1 1∶500)在4 ℃封闭过夜,加入辣根过氧化物酶偶联的二抗室温孵育1 h,最后滴ECL曝光。
1.3 统计学方法
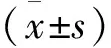
2 结果
2.1 miR-381-3p、SP1在食管癌组织和正常组织中的表达差异
通过qRT-PCR检测正常食管组织和食管癌组织中miR-381-3p和SP1 mRNA的表达,与正常食管组织相比,食管癌组织中miR-381-3p mRNA的表达明显下调,而SP1 mRNA的表达的表达明显上调(P<0.01)。
通过qRT-PCR检测正常食管细胞HEEC和食管癌细胞EC109、EC9706、TE1、KYSE450、KYSE790中miR-381-3p和SP1 mRNA的表达,与正常食管细胞HEEC相比,食管癌细胞EC109、EC9706、TE1、KYSE450、KYSE790中miR-381-3p mRNA的表达明显下调,而SP1 mRNA的表达的表达明显上调(P<0.01)。后续实验选择EC9706细胞株进行(图1)。
2.2 miR-381-3p直接靶向抑制SP1表达
根据TargetScan数据库的预测, miR-381-3p与SP1 3′UTR区存在结合位点。为了进一步验证 miR-381-直接作用于SP1,进行了荧光素酶报告基因实验。miR-381高表达明显抑制了含有野生型SP1质粒的荧光素酶活性,但对突变型SP1质粒的荧光素酶活性无影响(P<0.01)。进一步为了验证miR-381高表达对SP1的作用,Western blot检测各组细胞SP1 蛋白的表达。与control组细胞相比,miR-control组细胞中SP1 蛋白表达无明显变化,miR-381 mimic组细胞中SP1 蛋白表达明显下调(P<0.01),SP1组细胞中SP1 蛋白表达明显上调(P<0.01);与miR-381 mimic组相比,miR-381 mimic+SP1组细胞中SP1 蛋白表达明显上调(P<0.01)。因此,miR-381-3p直接靶向抑制SP1表达(图2)。
注:A:TargetScan数据库预测miR-381-3p与SP1 3′UTR区存在结合位点;B:双荧光素酶报告基因实验检测miR-381-3p与SP1靶向关系;C:Western blot检测各组细胞SP1 蛋白的表达,与control组相比,**P<0.01;与miR-381-3p mimic组相比,##P<0.01
2.3 miR-381-3p靶向SP1抑制食管癌细胞增殖、诱导食管癌细胞凋亡
MTT法检测细胞增殖情况可知,与Control组细胞相比,miR-control组细胞增殖无明显变化,miR-318 mimic组细胞增殖明显降低(P<0.01),SP1组细胞增殖明显增高(P<0.01);与miR-318 mimic组相比,miR-318 mimic+SP1组细胞增殖明显增高(P<0.01)。因此,miR-318 靶向SP1抑制食管癌细胞EC9706增殖。
为了进一步证实miR-381-3p对食管癌细胞增殖的作用,运用Western blot检测各组细胞增殖标记Ki67、PCNA的蛋白表达。与control组细胞相比,miR-control组细胞中Ki67、PCNA 蛋白表达无明显变化;miR-381 mimic组细胞中Ki67和PCNA蛋白表达明显下调(P<0.01);SP1组细胞中Ki67、PCNA 蛋白表达明显上调(P<0.01);与miR-381 mimic组相比,miR-381 mimic+SP1组细胞中Ki67、PCNA蛋白表达明显上调(P<0.01)。证实了miR-318 靶向SP1抑制食管癌细胞EC9706增殖。
流式检测各组细胞凋亡发现,与Control组细胞相比,miR-control组细胞凋亡率无明显变化,miR-318 mimic组细胞凋亡率明显降升高(P<0.01),SP1组细胞凋亡率明显降低(P<0.01);与miR-318 mimic组相比,miR-318 mimic+SP1组细胞凋亡率明显降低(P<0.01)。因此,miR-318 靶向SP1诱导食管癌细胞EC9706凋亡。
为了进一步证实miR-381-3p对食管癌细胞凋亡的作用,运用Western blot检测各组细胞凋亡标记蛋白Bax/Bcl-2、cleaved caspase-3的表达。与control组细胞相比,miR-control组细胞中Bax/Bcl-2和cleaved caspase-3蛋白表达无明显变化,miR-381 mimic组细胞中Bax/Bcl-2和cleaved caspase-3蛋白表达明显上调(P<0.01),SP1组细胞中Bax/Bcl-2和cleaved caspase-3蛋白表达明显下调(P<0.01);与miR-381 mimic组相比,miR-381 mimic+SP1组细胞中Bax/Bcl-2和cleaved caspase-3蛋白表达明显下调(P<0.01)。本实验证实了miR-318 靶向SP1诱导食管癌细胞EC9706凋亡(图3)。
注:A:MTT法检测各组细胞增殖情况,与control组相比,**P<0.01,与miR-381-3p mimic组相比,##P<0.01;B、C:Western blot检测各组细胞增殖标记蛋白Ki67和PCNA的表达水平,与control组相比,**P<0.01,与miR-381-3p mimic组相比,##P<0.01;D、E:流式检测各组细胞凋亡情况,与control组相比,**P<0.01,与miR-381-3p mimic组相比,##P<0.01;F、G:Western blot检测各组细胞凋亡标记蛋白Bax/Bcl-2和Cleaved caspase-3的表达,与control组相比,**P<0.01,与miR-381-sp mimic组相比,##p<0.01
2.4 miR-381-3p靶向SP1抑制食管癌细胞中mTOR/p70s6k信号通路激活
mTOR/p70s6k信号通路和癌症的发生和发展息息相关,假设miR-381-3p靶向SP1能够调控食管癌细胞中mTOR/p70s6k信号通路。通过Western blot检测p-mTOR/mTOR、p-p70s6k/p70s6k蛋白表达水平发现,与control组细胞相比,miR-control组细胞中p-mTOR/mTOR、p-p70s6k/p70s6k蛋白表达无明显变化,miR-381 mimic组细胞中p-mTOR/mTOR、p-p70s6k/p70s6k蛋白表达明显下调(P<0.01),SP1组细胞中p-mTOR/mTOR、p-p70s6k/p70s6k蛋白表达明显上调(P<0.01);与miR-381 mimic组相比,miR-381 mimic+SP1组细胞中p-mTOR/mTOR、p-p70s6k/p70s6k蛋白表达明显上调(P<0.01),说明miR-318 靶向SP1抑制食管癌细胞EC9706中mTOR/p70s6k信号通路激活(图4)。
2.5 抑制mTOR/p70S6K信号通路抑制EC9706细胞增殖、促进细胞凋亡
为了研究mTOR/p70S6K信号通路对食管癌细胞EC9706增殖和凋亡的作用,用100 nmol/L的雷帕霉素处理24 h,然后使用MTT、流式细胞术、Western blot评估细胞增殖、凋亡情况。与对照组相比,雷帕霉素处理组组细胞增殖明显降低(P<0.01),细胞凋亡率明显增加(P<0.01),增殖标记蛋白Ki67表达明显下调(P<0.01),凋亡标记蛋白cleaved caspase-3表达明显上调(P<0.01),而SP1蛋白表达无明显变化,说明雷帕霉素抑制mTOR/p70S6K信号通路,能够抑制EC9706细胞增殖、促进细胞凋亡,但不会影响SP1蛋白的表达。所有数据提示mTOR/p70s6k信号通路可能参与miR-381-3p调控食管癌细胞的增殖和凋亡(图5)。
注: A:MTT法检测各组细胞增殖情况,与control组相比,**P<0.01;B:流式检测各组细胞凋亡情况,**P<0.01;C:Western blot检测各组细胞Ki67、Cleaved caspase-3和SP1的表达,与control组相比,**P<0.01
3 讨论
miRNA是一类小的非编码,单链具有约18-25个核苷酸的RNA,通常通过与靶mRNA的3′-UTR的互补结构域结合来调节靶信使RNA表达的转录后水平。其与多种生物功能和病理学过程密切相关,包括细胞增殖、分化、细胞凋亡和自我更新等,在肿瘤发生中充当启动子或抑制因子[10]。miR-381在肿瘤细胞中低表达,过表达miR-381能够抑制肿瘤细胞的增殖,迁移和侵袭中。例如,miR-381在乳腺癌细胞中表达下调,过表达miR-381可通过靶向CXCR4抑制乳腺癌细胞增殖、上皮间质转化和转移[11]。本课题组研究发现,miR-381-3p在食管癌细胞EC9706中低表达,过表达miR-381-3p能够抑制细胞增殖和诱导细胞凋亡。这些结果有力地表明了miR-381-3p在食管癌中的潜在肿瘤抑制作用。
SP1在肿瘤存活、进展和转移所需的肿瘤相关基因的调节中发挥关键作用。如,SP1在乳腺癌中过度表达,可以调节TINCR-MIR-7-KLF4轴,从而刺激细胞增殖并抑制细胞凋亡[12]。本课题组发现,在食管癌细胞中SP1表达上调。已有研究[13]发现SP1是各种细胞行为包括细胞周期,增殖和凋亡的中介,且在癌症中SP1受多个miRNA调节,如,在骨肉瘤中,据报道miR-493通过靶向SP1抑制骨肉瘤细胞增殖和侵袭,因此可以开发miR-493/SP1轴作为潜在的治疗靶点。本课题组研究发现,在食管癌细胞中,miR-381-3p与SP1 3′UTR区存在结合位点,且miR-381-3p直接靶向抑制SP1表达,从而调控食管癌细胞增殖和凋亡。
本项研究发现,过表达miR-381-3p后,食管癌细胞增殖明显降低、Ki67和PCNA蛋白表达明显下调,细胞凋亡率明显降升高、Bax/Bcl-2和cleaved caspase-3蛋白表达明显上调;而高表达SP1可以逆转miR-381-3p对食管癌细胞增殖抑制和凋亡诱导作用。Ki67是细胞增殖相关蛋白,其表达水平越高表明处于增殖周期的细胞越多[14]。PCNA是增殖细胞核抗原,与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的良好指标[15]。Bcl-2是抗细胞凋亡蛋白, Bax是促细胞凋亡蛋白,Bax/Bcl-2比值决定细胞受到凋亡刺激信号时发生凋亡还是生存[16]。cleaved Caspase-3是凋亡程序中的主要执行者之一,是凋亡级联反应中的标志性蛋白[17]。因此,miR-381-3p靶向SP1抑制食管癌细胞增殖、诱导食管癌细胞凋亡。
mTOR是进化的保守的丝氨酸/苏氨酸激酶,作为调节因子参与多种细胞活动包括细胞增殖,代谢,生长和存活等过程,调节肿瘤细胞的增殖、存活和侵袭转移[18]。p70S6K是mTOR的下游靶标之一,其以雷帕霉素敏感的方式调节翻译起始复合物,是多种信号转导途径控制下的主要翻译调节因子[19]。mTOR可以促进p70S6K磷酸化,从而刺激翻译细胞从周期G1到S阶段所需的蛋白质,促进细胞生长[20]。已有研究[21]表明在食管癌中mTOR/p70S6K信号通路被异常活化。本研究发现,miR-381-3p靶向SP1抑制食管癌细胞中mTOR/p70s6k信号通路激活,用雷帕霉素抑制mTOR/p70S6K信号通路,能够抑制EC9706细胞增殖、促进细胞凋亡,提示miR-381-3p靶向SP1通过抑制mTOR/p70S6K信号通路来抑制EC9706细胞增殖、促进细胞凋亡。
综上所述,在食管癌细胞中,miR-381-3p与SP1 3′UTR区存在结合位点,且miR-381-3p直接靶向抑制SP1表达;miR-381-3p靶向SP1抑制食管癌细胞增殖、诱导食管癌细胞凋亡,抑制mTOR/p70s6k信号通路激活;同时,抑制mTOR/p70S6K信号通路能够抑制EC9706细胞增殖、促进细胞凋亡;提示miR-381-3p靶向SP1抑制mTOR/p70s6k信号通路,从而抑制食管癌细胞的增殖、诱导细胞凋亡。这为食管癌的诊断和治疗提供参考数据,其动物体内实验还有待进一步研究。

