抗磷脂综合征患者MPV、PDW及LP-PLA2水平分析
李宗锋 沈薇薇
抗磷脂综合征(antiphospholipid syndrome,APS)是以血小板减少、病理妊娠和反复发生动静脉血栓为临床表现,血清中持续存在高滴度抗磷脂抗体的一种非器官特异性自身免疫病[1]。APS最新诊断所用分类标准是2006年Sapporo综述的分类标准:出现一个特定的临床表现(血栓栓塞或病理妊娠)和一个实验室指标(抗心磷脂抗体、狼疮抗凝物、抗β2糖蛋白Ⅰ抗体)阳性,临床上即可诊断为APS[2]。目前按照这一标准部分异质性APS患者将会被漏诊,被漏诊的这些APS患者存在尚未作为分类的临床表现。APS还包括非典型临床表现:肾病,网状青斑、神经系统症状和心脏瓣膜病等[3]。探索新的、有效诊断APS以及预测APS患者血栓事件的临床检验指标对APS患者早期发现、及时治疗、改善预后尤为重要。脂蛋白磷脂酶A2(lipoprotein associated phospholipase A2,LP-PLA2),是一种独立的、高特异性的血管炎症反应标志物,有研究表明LP-PLA2浓度水平与缺血性脑卒中早期血栓的形成及进展相关[4]。平均血小板体积(mean platelet volume,MPV)和血小板分布宽度(platelet distribution width,PDW)是血常规检测的参数,能反映血小板活化、检测血小板功能的实验室指标[5],研究表明,MPV是血栓性疾病发病独立风险因子,MPV值越高表明血小板体积越大,大体积血小板所含的促凝因子的活性就越高,表明血栓事件更易发生[6]。PDW可反映血小板大小的一致性,在血栓形成前即可显示浓度水平升高,可预测血栓的发生、发展,PDW值升高提示血栓发生的风险随之提高[7]。本研究旨在检测APS患者外周血中LP-PLA2的浓度水平、MPV和PDW值,并评价其在APS中可能的临床意义。
1 资料与方法
1.1 一般资料 收集2012年5月至2018年10月在秦皇岛市第一医院就诊的APS患者28例(APS组),男6例,女22例;年龄16~64岁,平均年龄(40±6)岁,入选者均符合2006年Syndney国际会议诊断标准[8]。所有对象未经过免疫抑制剂治疗,且排除类风湿关节炎、系统性红斑狼疮等其他自身免疫性疾病及感染等。APS患者血栓事件经多普勒超声扫描、血管造影或组织病理证实。采用血小板计数<100×109/L作为APS患者血小板减少症阈值的上限[9],其中6例有静脉血栓史,18例发生过动脉血栓事件,4例有血小板减少史。收集同期在本院体检中心体检且性别、年龄匹配的健康体检者30例作为健康对照组,男6例,女24例;年龄20~58岁,平均年龄(39±5)岁。均无自身免疫性疾病史,且既往无动静脉血栓形成和不良妊娠等病史。2组性别比、年龄等差异无统计学意义(P>0.05)。
1.2 检测指标与方法
1.2.1 MPV、PDW的检测: 用真空采血管抽取受检者清晨空腹外周静脉血2 ml ,选用Sysmex XE-2100全自动血细胞分析仪及配套试剂进行检测。
1.2.2 LP-PLA2的检测: 用真空采血管抽取受检者清晨空腹外周静脉血4 ml,4 000 r/min,离心15 min,取血清保存于-70度冰箱中待测。参考LP-PLA2试剂说明书,采用酶联免疫吸附试验(ELISA)进行检测。试剂盒购自天津康克尔生物技术有限公司。
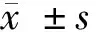
2 结果
2.1 APS患者组MPV、PDW值以及LP-PLA2水平分别为(12.25±1.06)fl、(17.30±2.10)%、(164.06±42.40)ng/ml;健康对照组MPV、PDW值以及LP-PLA2水平分别为(9.46±1.33)fl、(12.69±1.88)%、(91.92±34.53)ng/ml,差异有统计学意义(P<0.05)。见表1。
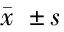

组别MPV(fl)PDW(%)LP-PLA2(ng/ml)APS组(n=28) 12.25±1.06∗17.30±2.10∗164.06±42.40∗健康对照组(n=30)9.46±1.3312.69±1.8891.92±34.53
注:与健康对照组比较,*P<0.05
2.2 二分类logistic回归分析结果 MPV、PDW、LP-PLA2为APS发病的危险因素。见表2。
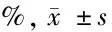

项目BSEχ2值P值OR值OR值的95%置信区间下限上线MPV 1.5060.6814.8870.0274.5061.18617.120PDW 0.6610.2925.1150.0241.9361.0923.432LP-PLA0.0430.0194.8050.0281.0441.0051.084常量 -30.05210.1528.7620.0030.000
2.3 ROC曲线评价各指标对APS的诊断效能 MPV曲线下面积(AUC)为0.716,渐近95%的置信区间(95%CI)为0.577~0.855(P<0.05),当MPV值为11.05 时,此时的约登指数最大为0.481, MPV对于诊断APS的敏感度66.7%,特异性为81.5%;PDW曲线下面积为0.813,95%CI为0.695~0.932(P<0.05),当PDW值为15.25时,此时的约登指数最大为0.593,PDW对于诊断APS的敏感度77.8%,特异性为81.5%;LP-PLA2曲线下面积为0.710,95%CI为0.567~0.853(P<0.05),当LP-PLA2值为144.04时,此时的约登指数最大为0.481, LP-PLA2对于诊断APS的敏感度63.0%,特异性为85.2%。见表3,图1。

表3 ROC曲线结果
3 讨论
APS是多发生于育龄期女性的,一种能影响全身各个器官,以血栓形成和流产为主要临床表现,少数表现为出血或血栓与出血同时存在的的自身免疫病,该病的主要自身抗体是抗磷脂抗体。反复的动静脉血栓、女性习惯性流产和血小板减少是APS的主要临床表现。此外还包括神经精神症状、溶血性贫血、肾病、皮肤溃疡等非典型临床表现。由于APS症状多样化,临床表现复杂,累及多系统、多器官,可导致部分患者确诊时间较长,漏诊、误诊率较高。寻找临床医师早期积极干预,从而有助于改善APS患者临床结局的临床检验指标显得尤为必要。
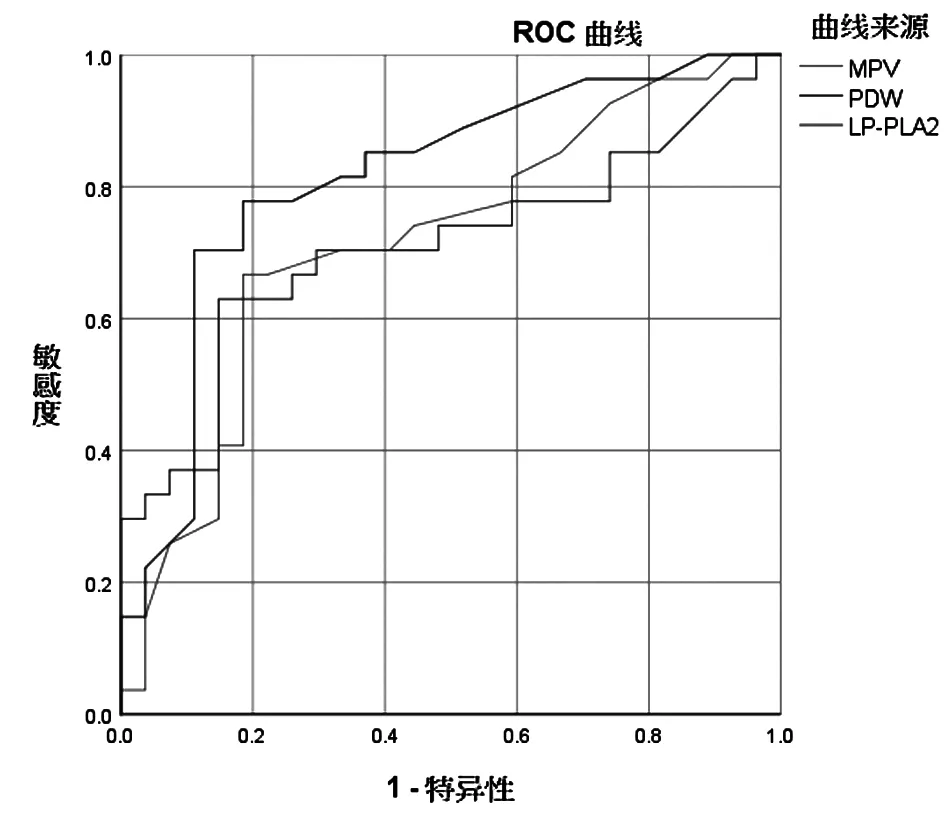
图1 ROC曲线评价结果
血栓是APS主要的病理特征,也是APS患者最突出的临床表现。研究显示,APS血栓的发病率为87.9%,其中动脉血栓发病率为42.2%,静脉血栓发病率为52.3%,同时发生动静脉血栓的患者约占15.2%;其中31.7%为深静脉血栓,发病率最高,脑梗死发病率为13.1%,肺栓塞发病率为9%[7]。国外报道显示,APS患者下肢深静脉血栓发病率为37%,脑梗塞为21%,肺栓塞为15%[9]。国内报道,APS患者下肢深静脉血栓发病率为36%[10],较国外略低,肺栓塞的发病率30%,与国外报道比较发病率要高些。综上,血栓给APS患者带来严重的危害,甚至威胁到患者的生命。因此,寻找APS血栓发生的危险因子,并监测其浓度水平的变化对减少APS血栓发生、控制其发展,改善患者的预后有重要的临床意义。
APS患者血栓形成的重要环节是血小板活化。血小板活化时,激活血小板的致密体可释放血栓烷A2(thromboxane A2,TXA2)和血小板因子4(platelet factor 4,PF4),TXA2能收缩血管、激活血小板并促进血小板聚集,PF4可使β2糖蛋白Ⅰ二聚化,促进血小板表面复合物的产生、形成,导致血栓形成[10]。外周血中,血小板基本处于静息状态,当血小板与血管外组织壁、受损的血管接触时而成为活化的血小板[11]。血小板的形态在血小板活化后产生了变化。活化后血小板体积增大,这将有利于血小板的粘附,同时体积较大血小板的酶和代谢比体积较小血小板的更活跃,能释放更多的5-羟色胺和β-凝血酶球蛋白,导致细胞内TXA2水平含量也更高,更容易促进血栓的形成[12]。MPV是平均单个血小板体积,是廉价、耗时短、便于监测且容易获得的血常规参数。有研究表明,MPV可以作为血小板活化的标记物[13],现如今已被当做评价血小板功能和活性的常用手段,在血小板活化早期其浓度水平即可升高。PDW是以血小板体积大小变异系数表示的,能够反映外周血血小板体积分布变异的参数,PDW浓度水平升高提示血小板体积差异较大,其浓度水平降低提示血小板体积均一[14],研究指出,PDW能反映血小板功能及形态的变化,活化后的血小板其球形发生改变并形成伪足,伪足大小的不同可影响PDW的值[15],因此PDW值亦可作为判断血小板活化的指标之一。二者均与血小板活化呈正相关,其升高说明血小板的聚集、粘附以及释放功能增强,体内的凝血活性增强[16],进而引发不良结局的发生[17]。在本研究中我们发现APS患者MPV、PDW值较对照组明显升高,二分类回归分析结果亦显示MPV和PDW是APS发病的危险因素。这说明APS患者较之正常人有着更高的血小板活化程度,这也是APS患者血栓发生的重要病理生理基础之一。这同时也说明MPV和PDW值增高可以同样预示APS患者的血小板活化程度的加强,机体向高凝状态转变。因此可以利用MPV和PDW来监测APS患者凝血功能的变化,指导临床医生及时的调整APS患者的抗凝治疗,从而防止恶性血栓事件的发生。
LP-PLA2分子量为45 kDa,属于磷脂酶A2超家族,又称血小板活化因子乙酰水解酶[18],在血管炎症的早期时浓度水平即可升高。是近年来研究较热的新型炎性标志物,而且是血管特异性的炎性标志物[19],也是机体中的一类炎性因子,亦是机体内促炎物质,还可介导局部炎性反应,反应代谢可生成多种炎性介质:血小板源性生长因子、白细胞介素等,这些炎性介质可激活血小板,活化后的血小板可进一步加强炎性介质的释放,促进了凝血过程。血管内皮受损时,LP-PLA2由血管内皮中的巨噬细胞、T细胞以及肥大细胞等分泌,伴随血小板活化而分泌增加,以结合脂蛋白颗粒的形式存在于机体内,血浆中存在的LP-PLA2是有活性的。LP-PLA2对机体的主要作用有,参与生物膜的稳定和磷脂酶的重建,平衡脂蛋白代谢、产生炎性介质、加速坏死组织自体消失等。目前已有研究证实LP-PLA2和冠心病、脑卒中等血栓相关性疾病的发生有密切关系[20]。在本研究中我们发现APS患者外周血中LP-PLA2水平较对照组明显升高,且LP-PLA2为APS发病的危险因素。说明LP-PLA2也是APS患者的血栓形成过程中的重要参与者,可能与活化的血小板一起加速APS患者的血栓形成。LP-PLA2水平越高机体发生血栓的危险就越大。因此,临床医生也应重视APS患者LP-PLA2水平的监测。
另外,从ROC曲线分析结果我们也可得出MPV、PDW、LP-PLA2对APS具有诊断效能。敏感度分别为66.70%、77.80%、63.00%,特异性分别为81.5%、81.5%、85.2%。因此,MPV、PDW、LP-PLA2三者亦有可能是APS新的辅助诊断指标。重视三者的检测可能对减少APS的漏诊及误诊具有重要意义。

