miR-204靶向SIRT1基因调控高糖作用下视网膜色素上皮细胞增殖的分子机制
桂玉敏 彭建军 郭敬
糖尿病性视网膜病变(diabetic retinopathy,DR)是一种以微血管异常、视网膜水肿、神经功能障碍和血-视网膜屏障(BRB)破坏为特征的进行性疾病,是糖尿病的主要并发症,也是成人失明的最常见原因[1]。视网膜色素上皮(RPE)细胞是外部BRB的重要组成部分,其选择性地调节分子流入和流出视网膜。有人提出,在糖尿病的情况下,持续的高血糖会阻碍RPE细胞增殖,从而促进糖尿病视网膜病变的进展[2]。微小RNA(microRNA,miRNA)是一类内源性、小的非编码RNA,涉及广泛的生物过程。它们通过与靶基因mRNA的3'-非翻译区(UTR)结合来调节基因表达,引起mRNA降解和/或翻译抑制。目前已经鉴定出许多miRNA可以调节糖尿病视网膜病变的发病机制[3,4]。如,miR-21在糖尿病视网膜中表达上调,敲除miR-21可通过靶向调节过氧化物酶体增殖物激活受体-α(PPARα)改善糖尿病视网膜中新生血管和炎症[5]。有报道发现miR-200b可预防糖尿病视网膜病变中血管内皮生长因子(VEGF)介导的通透性和血管生成[6]。尽管有这些报道,许多在糖尿病中失调的miRNA尚未有功能表征。据报道,miR-204能够维持静止状态下BRB的稳定,是人类多种眼部疾病中关键的miRNA[7]。miR-204在多种恶性肿瘤如视网膜细胞瘤、胃癌、胶质母细胞瘤等细胞的增殖中发挥重要作用[8-10],然而,miR-204在高血糖作用下对RPE细胞增殖的作用仍不清楚。本实验旨在探究miR-204在高糖诱导的RPE细胞增殖中的作用及可能的分子机制。
1 材料与方法
1.1 材料 人视网膜色素上皮细胞ARPE-19购于中国科学院上海生命科学学院细胞库;DMEM培养基、MTT试剂、胎牛血清购于美国Sigma公司;优质胎牛血清、蛋白提取试剂盒、BCA蛋白浓度检测试剂盒、ECL化学发光检测试剂盒均购于上海碧云天生物技术研究所;Lipofectamine 3000转染试剂盒购于美国Invitrogen公司;miR-204 inhibitor、NC-inhibitor、miR-204 mimics和NC-mimics购于广州市锐博生物科技有限公司;RNA提取试剂盒购于北京康为世纪生物科技有限公司;逆转录试剂盒和荧光定量PCR检测试剂盒购于大连宝生物工程有限公司;PVDF膜购于美国Abcam公司;鼠抗人SIRT1抗体、鼠抗人β-actin抗体购于美国CST公司;辣根过氧化物酶标记的山羊抗鼠IgG购于美国Abcam公司;荧光素酶报告基因载体pGL3质粒和Dual-Luciferase荧光素酶报告基因检测试剂盒购于美国Promega公司。
1.2 细胞培养、转染及分组 人视网膜色素上皮细胞ARPE-19复苏后使用含10%优质胎牛血清的DMEM培养基培养,在培养基中加入终浓度为100 U/ml青霉素和100 mg/ml链霉素,置5%CO2、饱和湿度、37℃恒温培养箱中培养,使用0.25%胰蛋白酶进行消化传代,取对数生长期的细胞进行转染实验。ARPE-19细胞使用0.25%胰蛋白酶进行消化并计数,以1×105个/孔接种到6孔板中,置37℃培养箱继续培养,待细胞生长密度至60%时,更换为不含血清的DMEM培养基,使用Lipofectamine 3000转染试剂盒分别转染miR-204 inhibitor或阴性对照NC-inhibitor,具体操作步骤参照试剂盒说明书进行。转染后使用不含血清的培养基继续培养24 h,然后加入终浓度为30 mmol/L的葡萄糖进行诱导。实验分为4组,正常葡萄糖组(NG组):不转染任何序列,DMEM培养基中添加5 mmol/L的葡萄糖;高葡萄糖组(HG组):不转染任何序列,DMEM培养基中添加30 mmol/L的葡萄糖;anti-NC组:转染NC-inhibitor序列,DMEM培养基中添加30 mmol/L的葡萄糖;anti-miR-204组:转染miR-204 inhibitor序列,DMEM培养基中添加30 mmol/L的葡萄糖。
1.3 qRT-PCR检测miR-204表达水平 高糖诱导48 h 后分别收集各组ARPE-19细胞,使用RNA提取试剂盒提取细胞总RNA,使用核酸蛋白检测仪测定RNA的质量和浓度,使用逆转录试剂盒合成cDNA,分别采用荧光定量PCR检测试剂盒进行PCR扩增,反应体系为:cDNA 1 μl,上下游引物分别1 μl,2×Green Mix 10 μl,去离子水7 μl。反应条件设置为:94℃ 2 min,94℃ 10 s,58℃ 15 s,72℃ 10 s,采用40个循环。以U6为内参,使用相对定量2-ΔΔCt法计算各组ARPE-19细胞中miR-204的相对表达水平,实验重复3次。miR-204引物:F-5’-GCGCTCCCTGACTGAGGAT-3’; F-5’-GAAGGTCCGGTTGCAGAACA-3’。U6引物:F-5’-ATTGGAACGATACAGAGAAG-3’; F-5’-GGAACGCTTCACGAATTTG-3’。
1.4 MTT法检测细胞增殖能力 取对数生长期的ARPE-19细胞接种到96孔板中,接种密度为6×103个/ml,按照上述1.2的方法转染和处理0、24、48、72 h时,向每组各孔细胞中加入10 μl MTT溶液,37℃孵育4 h,取出96孔板,弃上清,再向细胞中加入150 μl 二甲基亚砜,避光振荡反应10 min,待沉淀完全溶解后在酶标仪上测定各孔细胞吸光度值(OD值),波长设置为450 nm,实验重复3次。
1.5 Western blot检测PCNA和SIRT1蛋白表达水平 按照1.2方法分组和处理ARPE-19细胞,高糖诱导48 h后收集各组ARPE-19细胞,提取细胞中总蛋白,BCA法测定蛋白浓度,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转印至PVDF膜上,在含5%脱脂奶粉中室温封阻1 h。TBST洗膜后分别加入PCNA(1∶500稀释)一抗和SIRT1(1∶500稀释)一抗,4 ℃孵育过夜,TBST洗膜后加入1∶3 000稀释的二抗,室温孵育2 h,TBST洗膜后加入ECL化学发光液,显影,曝光,拍照。使用β-actin为内参,以Image J图像分析软件分析各组ARPE-19细胞中PCNA和SIRT1蛋白相对表达水平。
1.6 双荧光素酶报告基因实验 采使用生物信息学在线数据库TargetScan等预测miR-204的靶基因,预测结果显示SIRT1基因3’ UTR存在与miR-204结合位点,表明SIRT1可能是miR-204的靶基因。根据生物信息学预测结果,分别扩增出含miR-204结合位点的SIRT1 3’UTR(SIRT1-Wt)及miR-204结合位点突变的SIRT1 3’UTR(SIRT1-Mut)序列,分别插入荧光素酶报告基因载体上,构建野生型SIRT1-Wt和突变型SIRT1-Mut重组载体质粒,该部分实验由广州市锐博生物科技有限公司完成。将ARPE-19细胞接种到96 孔板中,37℃过夜培养,分别将SIRT1-Wt或SIRT1-Mut分别与miR-204 mimics或NC-mimics共转染ARPE-19细胞,转染后培养48 h,收集各组ARPE-19细胞,使用双荧光素酶报告基因检测试剂盒测定细胞的萤火虫荧光素酶活性及海肾荧光素酶活性,计算细胞相对荧光素酶活性,相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性,实验重复3次。
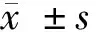
2 结果
2.1 4组ARPE-19细胞中miR-204表达水平比较 与NG组相比较,HG组和anti-NC组ARPE-19细胞中miR-204的表达水平明显升高(P<0.05),与HG组和anti-NC组相比较,anti-miR-204组ARPE-19细胞中miR-204的表达水平显著降低(P<0.05)。见表1。
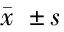

组别miR-204NG组1.00±0.09HG组3.26±0.40∗anti-NC组3.31±0.35∗anti-miR-204组1.47±0.18∗#△ F值53.427 P值0.000
注:与NG组比较,*P<0.05;与HG组比较,#P<0.05;与anti-NC组比较,△P<0.05
2.2 4组ARPE-19细胞增殖能力比较 与NG组比较,HG组和anti-NC组ARPE-19细胞24、48、72 h时OD值均显著降低(P<0.05),与HG组和anti-NC组相比较,anti-miR-204组ARPE-19细胞24、48、72 h时OD值均显著升高(P<0.05)。见表2。
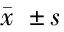
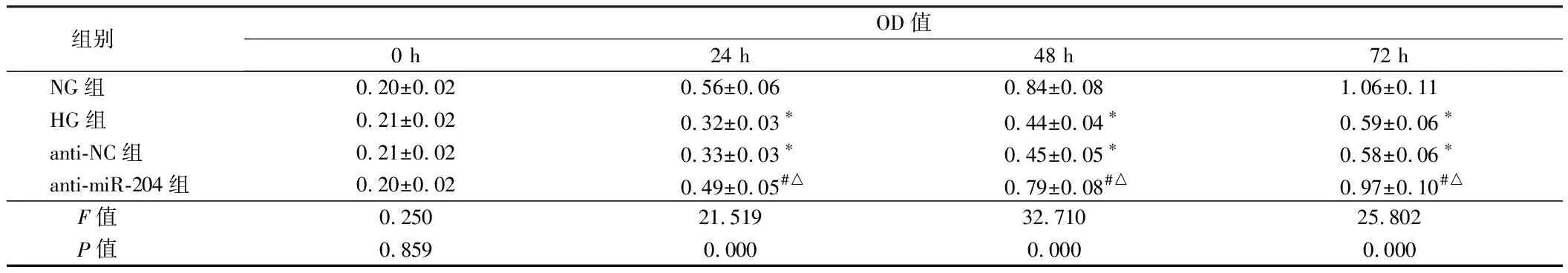
组别OD值0 h24 h48 h72 hNG组0.20±0.020.56±0.060.84±0.081.06±0.11HG组0.21±0.020.32±0.03∗0.44±0.04∗0.59±0.06∗anti-NC组0.21±0.020.33±0.03∗0.45±0.05∗0.58±0.06∗anti-miR-204组0.20±0.020.49±0.05#△0.79±0.08#△0.97±0.10#△ F值0.25021.51932.71025.802 P值0.8590.0000.0000.000
注:与NG组比较,*P<0.05;与HG组比较,#P<0.05;与anti-NC组比较,△P<0.05
2.3 4组ARPE-19细胞中PCNA和SIRT1蛋白表达水平的比较 与NG组相比较,HG组和anti-NC组ARPE-19细胞中PCNA和SIRT1蛋白表达水平均明显下调(P<0.05),与HG组和anti-NC组相比较,anti-miR-204组ARPE-19细胞中PCNA和SIRT1蛋白表达水平均明显上调(P<0.05)。见表3,图1。
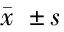

组别PCNASIRT1NG组0.76±0.080.31±0.03HG组0.42±0.04∗0.05±0.01∗anti-NC组0.40±0.04∗0.04±0.01∗anti-miR-204组0.65±0.06#△0.27±0.03#△ F值28.265121.750 P值0.0000.000
注:与NG组比较,*P<0.05;与HG组比较,#P<0.05;与anti-NC组比较,△P<0.05
2.4 miR-204靶向SIRT1 生物信息学在线软件TargetScan预测分析结果显示,miR-204与SIRT1基因3’UTR上存在碱基互补结合位点。双荧光素酶报告基因实验检测结果发现,与SIRT1-Wt共转染组中NC相比较,miR-204细胞相对荧光素酶活性明显降低(P<0.05);与SIRT1-Mut共转染组中NC相比较,miR-204细胞相对荧光素酶活性无明显改变(P>0.05)。见图2。
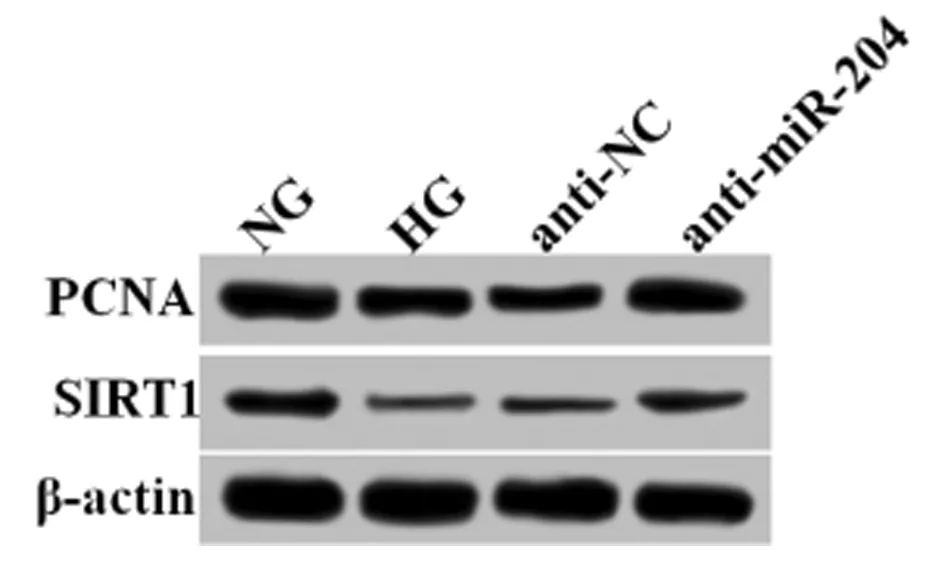
图1Western blot检测4组ARPE-19细胞中PCNA和SIRT1蛋白表达情况
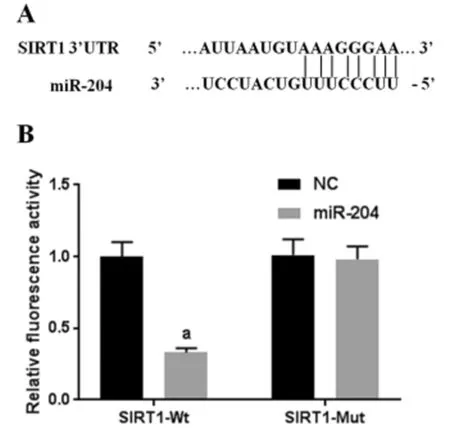
图2miR-204靶向SIRT1;A miR-204和SIRT1基因3’UTR存在碱基互补结合位点;B 双荧光素酶报告基因实验验证SIRT1是miR-204直接靶基因
3 讨论
糖尿病视网膜病变是糖尿病常见的微血管并发症之一,其临床表现通常为有视物模糊,视力下降,失明等症状。糖尿病视网膜病变的发生与患者体内葡萄糖水平持续呈高水平有关,然而随着人们生活水平的提高以及生活习惯的改变,我国糖尿病患者逐渐增多,糖尿病视网膜病变的患者亦随之增加[11]。因此,寻找与糖尿病视网膜病变相关的分子并探索其作用机制,有望成为治疗糖尿病视网膜病变的关键方法之一。越来越多的研究表明,miRNA的表达具有组织特异性、时序性,在进化上具有保守性等,可参与机体多种生理病理过程,如细胞增殖、分化、生长发育及凋亡等[12]。近年来研究显示,miR-204在眼部中的表达具有多维性,其可能作为眼部疾病早期诊断的标志物[13,14]。本实验发现,在高糖诱导的ARPE-19细胞中miR-204的表达水平明显升高,提示miR-204可能参与糖尿病视网膜病变过程。为进一步探究miR-204的作用机制,本实验通过转染miR-204 inhibitor部分回复高糖诱导的miR-204表达上调,MTT检测结果发现下调miR-204能够部分逆转高糖诱导的ARPE-19细胞增殖抑制作用。增殖细胞核抗原PCNA因只存在正常增殖的细胞和肿瘤细胞中而得名,其以细胞中DNA的合成密切相关,目前已将其作为反映细胞处于增殖状态的重要指标之一[15]。本实验Western blot检测结果显示,高糖诱导的ARPE-19细胞中PCNA表达下调,而抑制miR-204的表达后细胞中PCNA的表达水平明显上调。提示miR-204可能通过调节PCNA的表达影响高糖诱导ARPE-19细胞增殖。
本实验Western blot检测结果还显示,抑制miR-204的表达后ARPE-19细胞中沉默信息调节因子1(silent information regulator1,SIRT1)的表达水平也明显上调。SIRT1是一种烟酰胺腺苷二核苷酸(NAD +)依赖性脱乙酰酶,在调控细胞凋亡、衰老以及氧化应激损伤等过程中发挥重要作用[16,17]。Maugeri等研究发现,在视网膜退行性疾病中白藜芦醇能够通过调节SIRT1恢复ARPE-19细胞在氧化应激和炎症下的长链散点核因子-1(LINE-1)甲基化水平[18]。研究显示,SIRT1参与糖尿病视网膜病变的发生和发展,在抑制视网膜细胞凋亡中扮演重要角色。一项研究表明,SIRT1能够调节细胞凋亡、炎症和氧化应激,从而改善糖尿病视网膜病变[19]。Zhao等[20]研究发现,miR-23b-3p通过SIRT1依赖的信号通路诱导糖尿病视网膜病变中高糖的细胞代谢记忆。最近解晓丹等[21]研究表明,miR-204在人晶状体上皮细胞SRA01/04凋亡模型中表达上调,且通过调控SIRT1的表达参与SRA01/04细胞凋亡。提示miR-204可能通过调控SIRT1参与糖尿病视网膜病变。本实验使用生物信息学软件预测miR-204的靶基因,结果发现SIRT1可能是miR-204的直接靶基因,下调miR-204的表达可促进SIRT1的表达。后续通过双荧光素酶报告基因实验证实了SIRT1是miR-204的靶基因。结合以往研究,提示miR-204通过靶向SIRT1调控高糖作用下ARPE-19细胞增殖,参与糖尿病视网膜病变发生和发展。
总之,本实验结果显示,高糖能够诱导视网膜上皮细胞ARPE-19中miR-204的表达,抑制miR-204的表达能够通过靶向调控SIRT1逆转高糖诱导的ARPE-19细胞增殖抑制作用。深入探究miR-204靶向SIRT1参与ARPE-19增殖的相关机制,可能为糖尿病视网膜病变的靶向治疗提供新的作用靶点。

