鸡可食性组织中尼卡巴嗪残留的测定高效液相色谱法
蒋永嘉,肖 霞,蓝玮璇,江礼捷,谢恺舟,卜仕金,王志强
(1.扬州大学兽医学院 兽医药理毒理教研室,扬州 225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;3.扬州大学动物科学与技术学院,扬州 225009)
尼卡巴嗪(Nicarbazin)又名球虫净,主要应用于防治鸡和火鸡等禽类球虫病,是由4,4′—二硝基苯缩脲(1,3-Bis(4-nitrophenyl)urea,DNC)和α-羟基-4,6-二甲基嘧啶(α-Chloro-4-nitroo-cresol,HDP)组成的复合物[1]。前者通过粪便排出,代谢缓慢;后者在动物体内由尿液排出,代谢消除迅速[2],因此国际上和我国均规定尼卡巴嗪在鸡组织中的残留标识物为DNC,我国规定其在鸡的所有组织中最高残留限量(maxium residue limit,MRL)为200 μg/kg[3]。目前,尼卡巴嗪的检测方法有高效液相色谱法[4]、微柱高效液相色谱法、分光吸光度测定法[5]、气相色谱法、高效液相色谱串联质谱法[6]、酶联免疫吸附法[7]等。周伟伟等[8]建立了鸡肌肉、肝脏、肾脏中尼卡巴嗪的高效液相色谱(high performance liquid chromatography,HPLC)检测方法;章虎等[9]建立了鸡饲料中尼卡巴嗪的残留检测方法;Dhamendr等[10]建立了蛋中尼卡巴嗪的超临界流体萃取方法;侯婷等[6]建立了鸡皮脂中尼卡巴嗪的高效液相色谱串连质谱法。高效液相色谱法具有灵活、通用、选择性强、灵敏度高、检测限低等优点,但有关检测皮脂中尼卡巴嗪含量的HPLC方法未见报道[5,11]。本研究建立了鸡皮脂中尼卡巴嗪含量测定的HPLC检测法,同时对肌肉、肝脏、肾脏中尼卡巴嗪的检测方法进行优化,经HPLC检测,尼卡巴嗪色谱图峰形良好,药物回收率满足标准,而且该方法前处理简单省时,不用固相萃取,节约试验成本,为尼卡巴嗪的检测提供了方法学基础。
1 材料和方法
1.1 药品 4,4′-二硝基均二苯脲(DNC)标准品由Sigma公司提供,生产批号为390151,纯度为99.9%。
1.2 试剂 乙腈,HPLC级,购自美国TEDIA有限公司;甲醇,HPLC级,购自美国TEDIA有限公司;正己烷,HPLC级,购自国药集团化学试剂有限公司;N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF),HPLC级,购自国药集团化学试剂有限公司。其他所用试剂,除特殊注明外均为分析纯试剂;水为符合《GB/T6682-2008分析实验室用水国家标准》规定的超纯水。
1.3 仪器 Agilent-1260型高效液相色谱仪,配有紫外检测器和色谱工作站,购自Agilent Technologies公司;色谱柱为Agilent HC-C18柱(4.6 mm×250 mm,5 μm),购自Agilent Technologies公司;KS-250D超声仪购自宁波科生仪器厂产品;水浴氮吹仪购自Organomation America;Centrifuge 5810R高速冷冻离心机购自Eppendorf。
1.4 溶液的配制 准确称取DNC标准品(10.0±0.2 mg)于10 mL棕色容量瓶中,加入适量DMF,超声波辅助溶解15 min,冷却后定容至刻度,即配成浓度为1000 μg/mL DNC标准储备液,分装后置-20℃下保存,有效期6个月;精密量取1000 μg/mL DNC储备液1.0 mL,于10 mL容量瓶中,用甲醇溶解并稀释至刻度,即配成浓度为100 μg/mL DNC标准工作液,分装后2~4℃条件下保存,有效期一周;分别取乙腈、超纯水,按55:45的体积比混合后,经孔径0.22 μm滤膜过滤,超声脱气。流动相现配现用。
1.5 鸡组织样品前处理过程 称取均质组织(1.00±0.02)g于50 mL离心管中,加入乙腈5 mL,60℃水浴下超声10 mim,涡旋1 min,4000×g离心10 min,取上清移至10 mL离心管中。重复提取一次,合并两次上清液,40℃氮吹至干。加入乙腈1 mL复溶,60℃水浴下超声10 min,加入正己烷5 mL,涡旋3 min,4000×g离心6 min,弃上层正己烷液。再加正己烷5 mL,涡旋3 min,4000×g离心6 min,取下层液。溶液经孔径0.22 μm有机滤膜过滤,收集滤液供HPLC检测。
1.6 色谱条件优化 色谱柱为Agilent HC-C18柱(4.6 mm×250 mm, 5 μm),流动相为乙腈:超纯水(55∶45,v/v),流速为1 mL/min,柱温为40℃,进样量为10 μL,紫外检测波长为347 nm。
1.7 方法学研究
1.7.1 标准曲线和线性范围 精密量取100 μg/mL DNC标准工作液适量,依次用流动相稀释成10、5、4、2、1、0.5 μg/mL系列标准工作液。称取空白鸡可食性组织1 g加入50 mL离心管中,再分别加入100 μL上述工作液,使皮脂添加浓度分别为1000、500、400、200、100和50 μg/kg,另设空白组织对照。以1.5方法处理各样品。以DNC色谱峰面积对应DNC浓度进行线性回归,求出回归方程和相关系数。每个浓度重复3次。
1.7.2 检测限(limit of detection,LOD)和定量限(limit of quantity,LOQ) 取空白皮脂添加DNC标准工作液,使得DNC在空白组织中的浓度分别为10、50和100 μg/kg,按1.5组织样品前处理方法处理后,进行HPLC分析。测定基线噪声值,将信噪比(S/N)≥3定为检测限(LOD);定量限则结合精密度和准确度测定结果确定,以S/N≥10时的添加浓度作为定量限(LOQ)。
1.7.3 回收率的测定 将一定浓度的DNC标准工作液各100 μL加至1 g空白组织中,制得50、200和400 μg/kg 3个浓度的DNC空白组织添加样品,按1.5组织样品前处理方法处理后,吸取下层液10 μL供HPLC分析,测定峰面积。然后与相应标准品加入空白组织处理后样品进样的峰面积进行比较,计算相对添加回收率。每个添加浓度重复4次。
1.7.4 准确度和精密度的测定 将一定浓度的DNC标准工作液各100 μL加至1 g空白组织中,制得50、200和400 μg/kg三个浓度的DNC空白组织添加样品,按1.5组织样品前处理方法处理后,吸取下层液10 μL供HPLC分析。每个水平设4个平行(日内),共重复3批(日间)。据此分别求出日内和日间变异系数。
1.7.5 数据处理 Agilent-1260型高效液相色谱工作站提取并处理色谱图,数据用SPASS软件进行处理。
2 结果
2.1 皮脂样品中DNC色谱结果 鸡空白组织、鸡组织加标样品色谱图分别见图1。在本试验建立的检测条件下,DNC与组织中其他基质组分完全分开,皮脂、肝脏、肾脏中DNC的出峰时间在9.1 min左右,肌肉中的在9.4 min左右。
2.2 线性关系 DNC药物浓度在50~1000 μg/kg范围内,药物浓度与峰面积呈良好的线性关系(R2≥0.9992),见图2。
2.3 检测限和定量限 取信噪比S≥3时的浓度为最低检测限,该方法检测限为10 μg/kg;根据精密度和准确度测定结果,确定方法的定量限为50 μg/kg。
2.4 回收率和精密度 DNC在空白皮脂、肌肉、肝脏和肾脏50 μg/kg、200 μg/kg和400 μg/kg 三个添加浓度下,其回收率测定结果见表1,精密度测定结果见表2。回收率大于78.47%,日内和日间变异系数分别小于4.20%和4.30%。
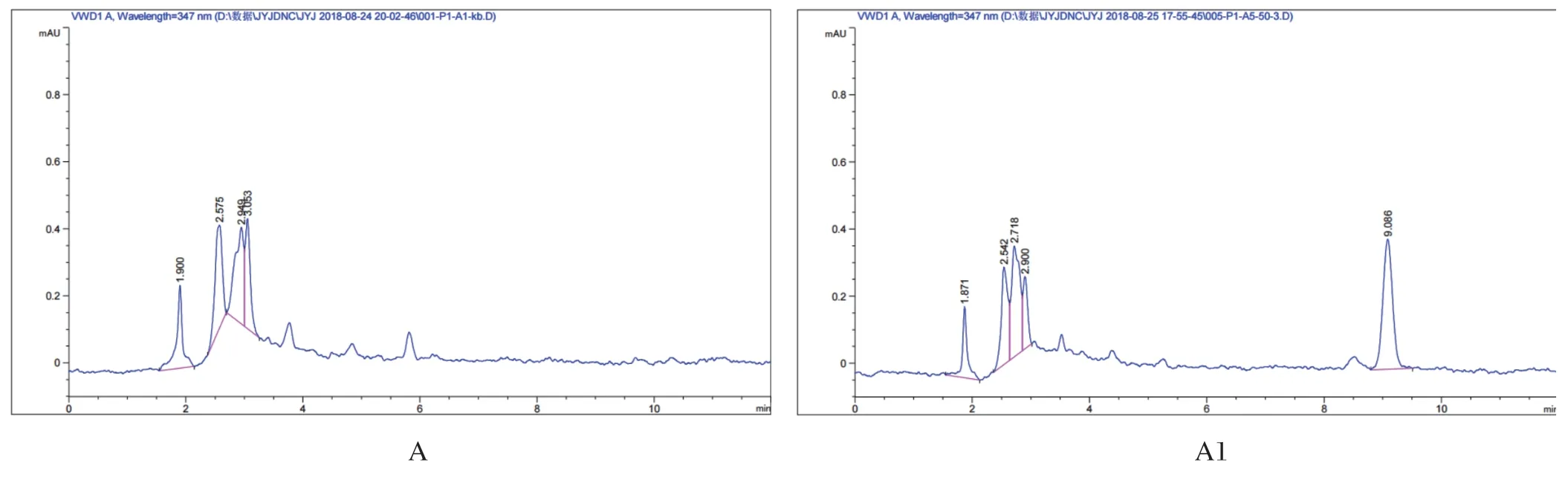
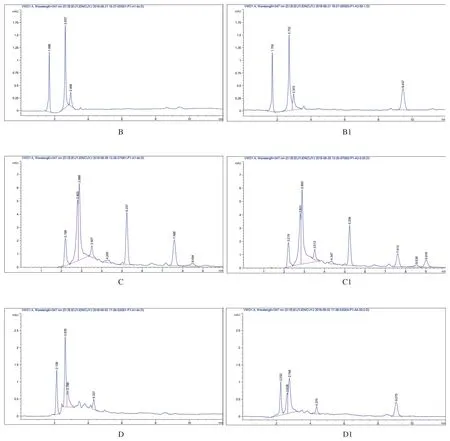
图1 鸡各组织中4,4-二硝基均二苯脲的色谱图Fig.1 The chromatogram of DNC in chicken edible tissues
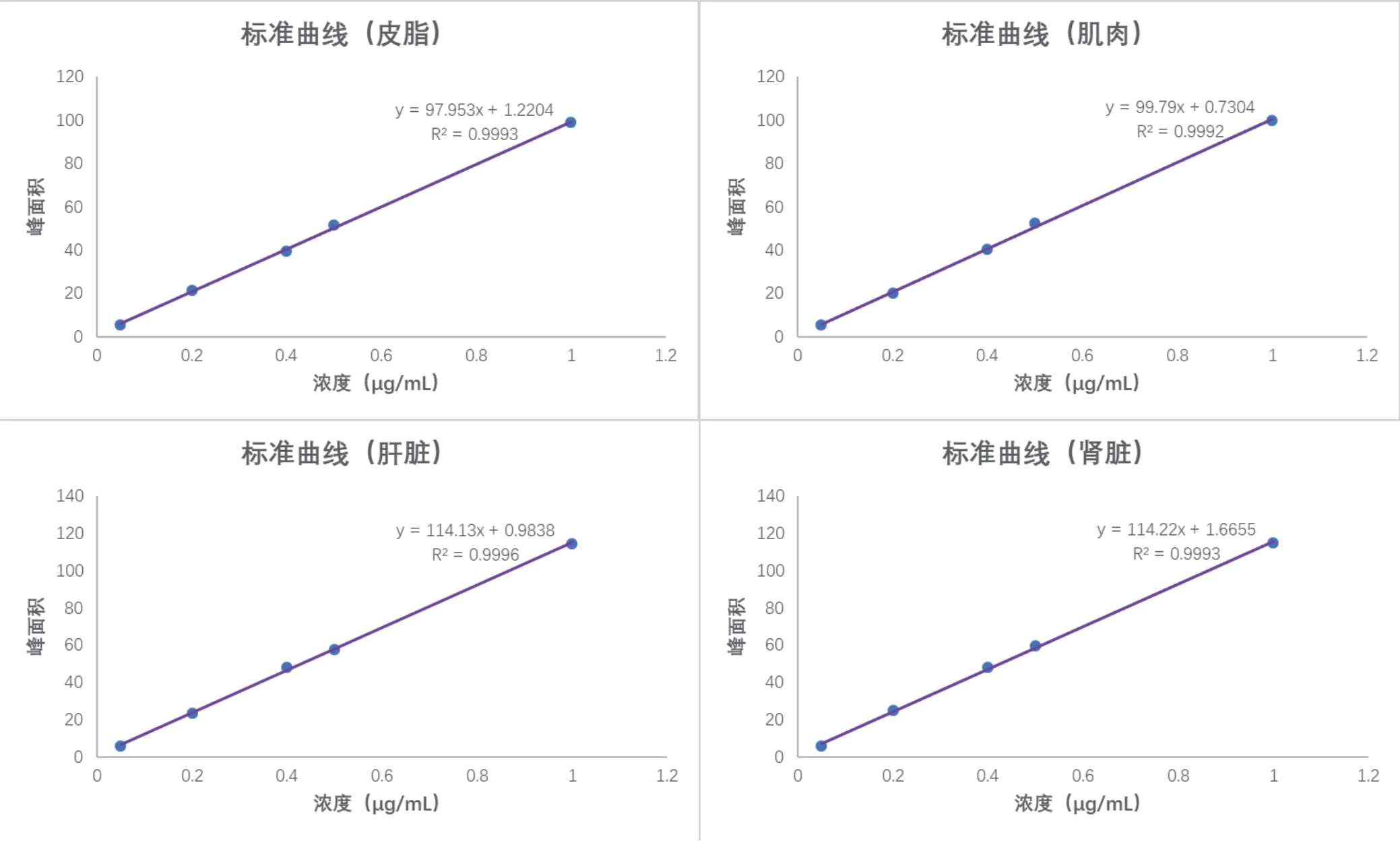
图2 标准曲线Fig.2 The standard curve of DNC in tissues of chicken

表1 鸡组织中DNC添加回收率(n=4)Table 1 The recoveries of DNC in tissues of chicken at different spiked concentrations(n=4)
3 讨论
尼卡巴嗪在鸡可食性组织包括肌肉、肝脏和肾脏中均有残留检测方法的报道[12-14],但目前尚无鸡皮脂中尼卡巴嗪的高效液相色谱残留检测方法。本研究在皮脂前处理方法中参考了之前报道过的其他组织的前处理方法[15-18],并结合鸡皮脂的特点,摸索出了可除去大量杂质,又不影响回收率,且对仪器要求不高、操作较为简单方便的鸡皮脂中尼卡巴嗪含量的检测方法,同时将该方法在已有的其他组织中进行验证,发现同样适用,并在回收率和日内日间变异系数上有较大提升和优化。

表2 鸡组织中DNC精密度测定结果(n=4)Table 2 The coefficient of variation of DNC in tissues of chicken at different spiked concentrations (n=4)
3.1 色谱条件的选择 本试验采用HPLC法测定尼卡巴嗪在鸡可食性组织中的药物浓度。周伟伟等[8]建立鸡肌肉、肝脏和肾组织中尼卡巴嗪残留的HPLC检测法,采取流动性配比为乙腈:水(50∶50,v/v),紫外检测波长在340 nm处,柱温控制在25℃。本试验在其基础上,结合Capurro等[19]的报道,对流动相的配比进行了优化,最终确定流动相配比为乙腈:超纯水(55∶45,v/v)。在色谱条件的选择上,Capurro等[19]采用紫外检测波长在350 nm处,孙转莲等[20]采用紫外检测波长在345 nm处,陈丽等[12]采用紫外检测波长在265 nm处,本试验实测柱温控制在40℃,紫外检测波长在347 nm处,尼卡巴嗪的检测取得较满意的效果。
3.2 提取 样品提取是样品前处理中的重要环节。尼卡巴嗪药物极性弱,不易溶于水。孙转莲等[20]比对了甲醇、乙腈、甲醇/水、乙腈/水的提取效果,测定结果表明:采用乙腈提取效率可达到85%,甲醇为65.4%,甲醇/水和乙腈/水提取回收率均低于60%。因此本方法选用乙腈作为提取溶剂,提取效果良好。本试验也发现在常温下超声溶解,尼卡巴嗪的溶出度很低。而在60℃水浴超声条件下,尼卡巴嗪能更好的溶解出来,这和陈丽等[12]得出的结论相一致。提取过程多次利用尼卡巴嗪这个特性,使得二次提取更加完全,氮吹复溶更加充分,达到提高回收率的目的。氮吹液体总体积仅10 mL,省时高效。采取氮吹后再除脂的方法,较好的降低药物损失,用5倍体积的正己烷二次除脂,能够较好的去除杂质,同时参考文献[13-15],在操作手法方面做出了优化,最终选择的前处理方法简单省时,不用固相萃取,节约试验成本。
3.3 方法学确证 本试验测定尼卡巴嗪在鸡皮脂中的检测限和定量限分别为10 μg/kg和50 μg/kg,与周伟伟等[8]报道的鸡组织中尼卡巴嗪的定量限相近,检测限由20 μg/kg降低至10 μg/kg。在添加50~400 μg/kg时,空白添加试样的平均回收率为80.77%~93.33%,其中DNC在肌肉中的平均回收率与周伟伟等[8]构建的方法相比由80.21%提升至93.33%,在肝脏中由75.37%提升至80.77%,在肾脏中由78.84%提升至85.27%。日内日间变异系数由分别小于7%和小于10%降低至均小于4.5%,方法具有较好的回收率和精密度。我国在2002年农业部第235号公告中规定尼卡巴嗪的MRL为200 μg/kg。本试验的定量限和检测限符合目前此化合物的残留检测技术指标要求。
本研究首次成功建立了鸡皮脂中尼卡巴嗪的高效液相色谱检测方法,所建立的方法专一性强、灵敏度高、灵活通用,补充了尼卡巴嗪在鸡可食性组织中的HPLC检测方法之皮脂一项的空白,同时对尼卡巴嗪在鸡可食性组织(肌肉、肝脏、肾脏)中原有HPLC检测方法改进优化,为尼卡巴嗪的残留检测提供了方法学基础。

