C端断裂型内含肽Npu DnaE介导的抗体片段及免疫毒素在大肠埃希菌中的可溶性表达与纯化
曹 津,陈 浩,张 静,朱建伟,陈俊升
(上海交通大学药学院细胞工程及抗体药物教育部工程研究中心,上海 200240)
长期以来,大肠埃希菌一直是外源蛋白的首选表达系统,但由于重组蛋白在大肠埃希菌中合成速度过快导致没有足够的时间进行折叠、含硫氨基酸过多不易正确配对、胞内pH接近蛋白等电点、缺乏真核生物中翻译后修饰所需的酶类和辅助因子等原因,重组蛋白在大肠埃希菌中非常容易形成包涵体,导致其应用受到了限制[1-2]。目前,国内外对蛋白质体外复性研究较多,过程主要包括破菌、包涵体洗涤、包涵体溶解、复性等步骤。蛋白质复性是一个非常复杂的环节,其复性结果除与蛋白质复性的过程控制相关外,还很大程度上与蛋白质本身的性质有关,该过程费时费力,且不经济。虽然添加促溶标签可以促进蛋白在大肠埃希菌中的可溶性表达,但含有促溶标签的重组蛋白需要用多种蛋白酶切除标签,在大规模生产时使用蛋白酶降解成本很高,应用也受到了限制。因此,探索重组蛋白在大肠埃希菌中的可溶性表达以及低成本的标签纯化方式具有广泛的应用前景。
SS1是小鼠中提取的抗间皮素单克隆抗体的单链二硫键稳定抗体(scdsFv)片段,可与间皮素特异性结合。其与假单胞菌外毒素A(Pseudomonas exotoxin A)的衍生毒素PE38KDEL连接的产物SS1P目前已进入临床Ⅱ期阶段,主要用于针对间皮瘤、卵巢癌等的治疗[5]。
内含肽是一种可介导前体蛋白质自我切除,将两侧外显肽连接在一起的功能性蛋白质。内含肽按照结构特征分类,可分为标准蛋白内含肽、微小蛋白内含肽和断裂蛋白内含肽[7-8]。其中,标准蛋白内含肽由蛋白剪接结构域和归巢核酸内切酶结构域组成;微小蛋白内含肽仅含有剪接结构域;断裂蛋白内含肽的剪接结构域则位于两个不同的编码框中[6-7]。断裂内含肽如NpuDnaE可有效避免体内提前断裂,具有广泛应用前景[8-12]。Zetteler等[13]证实,NpuDnaE具有很高的反应速率,且适用条件宽泛。研究表明,天然内含肽分子内的半胱氨酸之间形成了二硫键,降低了内含肽的剪切反应速率,加入DTT会破坏分子内的二硫键,可能会提高断裂反应速率[14]。Ramirez等[15]建立了NpuDnaED118G的突变体,这种突变体可以在有效抑制N端断裂的同时提高C端的断裂效率,在重组蛋白生产纯化中被广为应用。
本实验中将断裂内含肽与促溶标签联用,实现免疫毒素在大肠埃希菌中的可溶性表达;同时,内含肽的自我断裂可以很容易地将标签从免疫毒素中除去,避免通过蛋白酶等方法去除标签,降低了实验成本。
1 材 料
1.1 试 剂
PCR所用DNA聚合酶、连接酶和限制性内切酶(大连宝生物工程有限公司);同源重组试剂盒(南京诺唯赞生物科技有限公司);质粒抽提试剂盒、PCR产物回收试剂盒(美国Axygen公司);ECL发光显色液(美国Millipore生物公司);异丙基β-D硫代半乳糖苷(IPTG,美国Sigma公司);抗组氨酸标签抗体、羊抗鼠二抗(anti His,goat anti mouse IgG,上海生工生物工程股份有限公司);生物素化人源间皮素(北京义翘神州生物科技有限公司);其他试剂均为市售分析纯。
1.2 仪 器
Dextrin Beads 6FF柱和镍柱(常州天地人和生物科技有限公司);DNA凝胶电泳仪和凝胶成像分析系统(上海天能科技有限公司);蛋白凝胶电泳仪(美国BioRad公司);型号为Octet RED 96生物分子相互作用工作站(Fortebio,上海交通大学生命学院)。
1.3 菌株和质粒
大肠埃希菌DH5α、SHuffle T7感受态均为实验室自制;包含促溶标签麦芽糖结合蛋白(MBP)片段的质粒pET30a/MBP、包含断裂内含肽NpuDnaE的C端内含肽的质粒pET32a/NpuC、包含断裂内含肽NpuDnaE的N端内含肽的质粒pET30a/NpuN均为实验室保存[16];包含毒素PE38KDEL片段的质粒pET32a/PE38KDEL为实验室保存[17];包含scdsFv片段的质粒pUC57/SS1由金斯瑞生物科技有限公司合成。
2 方 法
2.1 重组表达质粒的构建
本研究以断裂内含肽NpuDnaE(NpuDnaED118G突变体)为工具,通过外显肽与NpuC端连接构建4种重组质粒(图1),分别在大肠埃希菌SHuffle T7中表达后比较重组蛋白的溶解性。实验所用到的引物见表1,所需构建的质粒、所用模板等信息见表2。其中,6H为His标签的缩写,TH为硫氧还蛋白促溶标签(thioredoxins,Trx)与His标签联用的缩写。
由式(17) 可知,策略概率更新规则{P(t),t≥0}实际上是一个马尔柯夫更新过程,当前状态由N个M×L概率矩阵构成,策略空间为Ω={P∈[0,1]M*L},用户基于随机学习博弈的目标函数为:
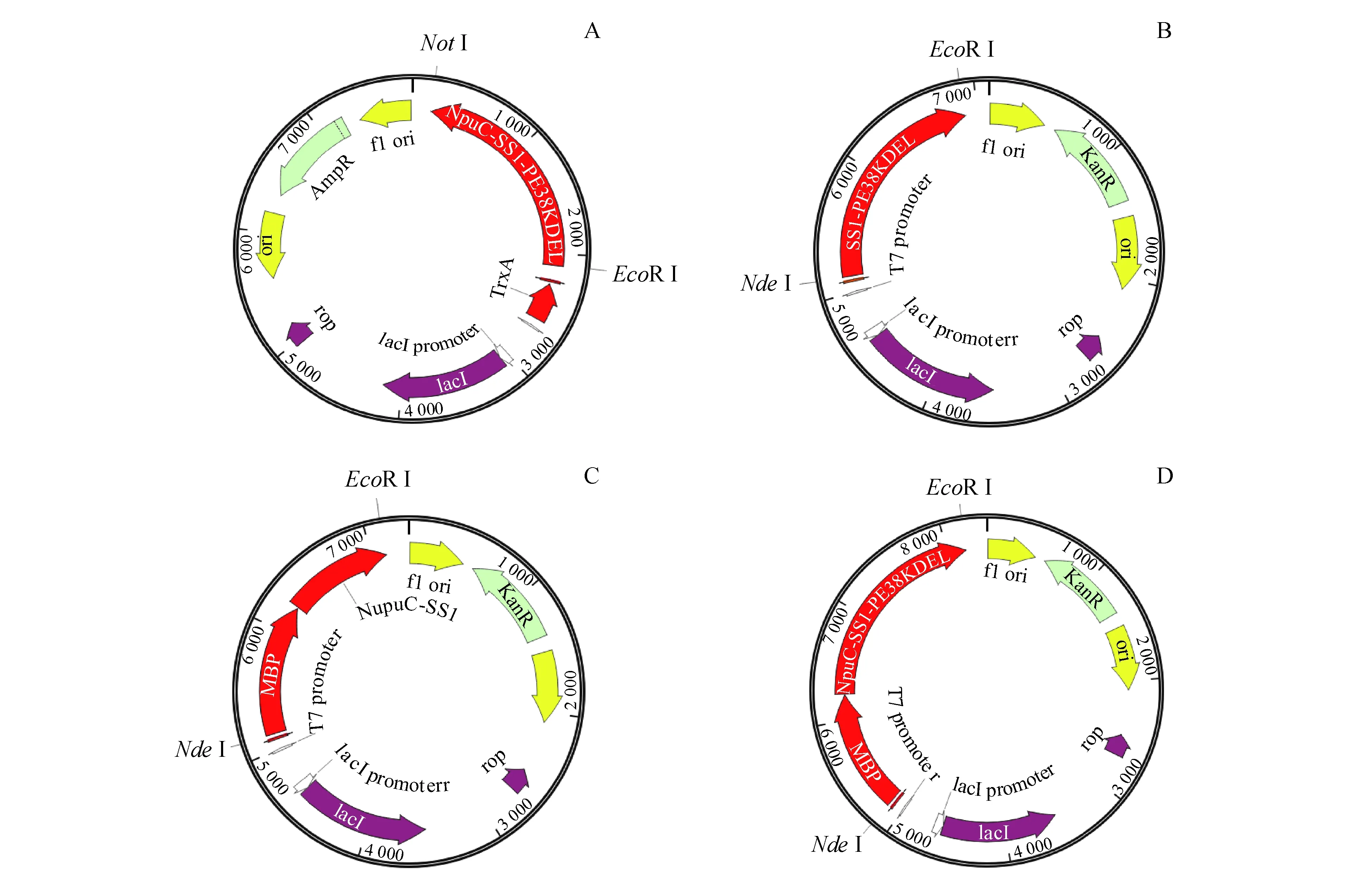
Figure1 Schematic diagram of plasmids
A:pET32a/TH-NpuC-SS1-PE38KDEL;B:pET28a/6H-SS1-PE38KDEL;C:pET28a/6H-MBP-NpuC-SS1;D:pET28a/6H-MBP-NpuC-SS1-PE38KDEL
Table1 Primers used to construct plasmids

No.Sequence15'-CATGGCTGATATCGGATCCGAATTCATGATCGAGATAGCCACAGAGAAATA-3'25'-CCAGACTGCTGCAGTTGTACCTGCATATTAGAAGCTATGAAGCCATTCTCGAGTGCAAA-3'35'-CCAGACTGCTGCAGTTGTACCTGCAT-3'45'-GCAAGCGGAGGACCAGAA-3'55'-GTGCTGGGACAAAGTTGGAAATAGGCGGCAGCCTGGCCGCGCTGACCGCGCACCAG-3'65'-TGGTGGTGGTGCTCGAGTGCGGCCGCTCACAGCTCGTCTTTCGGCGG-3'75'-TGAAAGAGTTCCTCGACGCTAACCTGGCCATGATCAAAATAGCCACACGTAAATATTT-3'85'-GCCGGACTACGCCAGCCAGCCCGGCAAACCGCCGAAAGACGAGCTGTGAGGAATTCAAA-3'95'-TGCTGTCCACCAGTCATGCTAGCCATATGAAAATCGAAGAAGGTAAACTGGTA-3'105'-CTCGTATCACCAAGGGCGGAGGCGGATCTGGTGGTGGCGGATCCGGAGGTGGCGGAAGC-3'115'-GGATCCGGAGGTGGCGGAAGCATGATCAAAATAGCCACACGTAAATATTTAGGCAAAC-3'125'-AGGGACCACGGTCACCGTCTCCTCATGAGAATTCGAGCTCCGTCGACAAGCTTGC-3'
Table2 Template,primers and restriction enzymes used to construct plasmids and bp of insert gene

Plasmids NameTemplatePrimersRestriction enzymebppET32a/TH-NpuC-SS1-PE38KDELpET32a/NpuCpUC57/SS1pET32a/PE38KDEL1-6EcoRⅠNotⅠ1 887pET28a/6H-SS1-PE38KDELpET32a/NpuC-SS1-PE38KDEL7-8NdeⅠEcoRⅠ1 770pET28a/6H-MBP-NpuC-SS1pET30a/MBPpET32a/NpuC-SS19-12NdeⅠEcoRⅠ2 008pET28a/6H-MBP-NpuC-SS1-PE38KDELpET28a/MBP-NpuC-SS1pET32a/PE38KDEL5,89,12NdeⅠEcoRⅠ3 054
2.1.1 pET32a/TH-NpuC-SS1-PE38KDEL质粒构建 使用引物1和引物2从pET32a/NpuC中扩增NpuC片段;使用引物3与引物4从pUC57/SS1中扩增SS1片段;使用引物5与引物6从pET32a/PE38KDEL中扩增PE38KDEL片段。胶回收后用引物1和引物4通过重叠PCR连接NpuC、SS1两个片段得到NpuC-SS1;质粒pET32a用EcoRⅠ,NotⅠ酶切后,使用多片段同源重组酶将NpuC-SS1、PE片段与pET32a质粒相连接;将连接产物转入大肠埃希菌DH5α感受态中,挑取单菌落培养后抽提质粒并送测序。
2.1.2 pET28a/6H-SS1-PE38KDEL质粒构建 使用引物7和引物8从pET32a/NpuC-SS1-PE38KDEL中扩增SS1-PE38KDEL片段,胶回收后用NdeⅠ 和EcoRⅠ酶切;pET28a用NdeⅠ和EcoRⅠ酶切,分别胶回收后用连接酶SolutionⅠ连接;将连接产物转入大肠埃希菌DH5α感受态中,挑取单菌落培养后抽提质粒并送测序。
2.1.3 pET28a/6H-MBP-NpuC-SS1质粒构建 使用引物9和引物10从pET30a/MBP中扩增MBP片段;使用引物11和引物12从pET32a/NpuC-SS1中扩增NpuC-SS1片段;pET28a质粒用NdeⅠ和EcoRⅠ酶切;分别胶回收后使用多片段同源重组酶将两个扩增片段与酶切回收后pET28a质粒相连接;将连接产物转入大肠埃希菌DH5α感受态中,挑取单菌落培养后抽提质粒并送测序。
2.1.4 pET28a/6H-MBP-NpuC-SS1-PE38KDEL质粒构建 使用引物9和引物12从pET28a/MBP-NpuC-SS1中扩增MBP-NpuC-SS1片段;使用引物5和引物8从pET32a/PE38KDEL中扩增PE38KDEL片段;pET28a用NdeⅠ和EcoRⅠ酶切;分别胶回收后使用多片段同源重组酶将两个扩增片段与pET28a质粒相连接,将连接产物转入大肠埃希菌DH5α感受态中,挑取单菌落培养后抽提质粒并送测序。
2.2 重组蛋白的诱导表达及纯化
2.2.1 重组蛋白的诱导表达 将以上所得重组表达质粒分别转入大肠埃希菌SHuffle T7中得到相应的重组蛋白表达菌株。SHuffle T7菌株在含有相应抗性平板上37 ℃培养过夜后挑取单菌落接种到含有相同抗性的LB 5 mL培养基中培养。其中,含有pET32a/TH-NpuC-SS1-PE38KDEL质粒的菌株为Amp抗性,其余3种表达菌株均为Kan抗性。将LB 5 mL培养基在37 ℃、220 r/min培养12 h后,按1%的接种量接种到含有相同抗性的LB 500 mL培养基中,37 ℃、200 r/min培养3~4 h,当A600达到0.5时,加入IPTG至终浓度为0.5 mmol/L,20 ℃、180 r/min过夜培养。分别取诱导前、诱导后、裂解后上清液与裂解后沉淀制样,用考马斯亮蓝方法检测蛋白表达情况和可溶性,用GraphPad Prisim(8.3.0版)软件做统计学分析。本实验中表达的蛋白及其基本性质见表3。用Western blot方法验证蛋白。
Table3 Theoretical molecular weight and pI of proteins expressed in this study
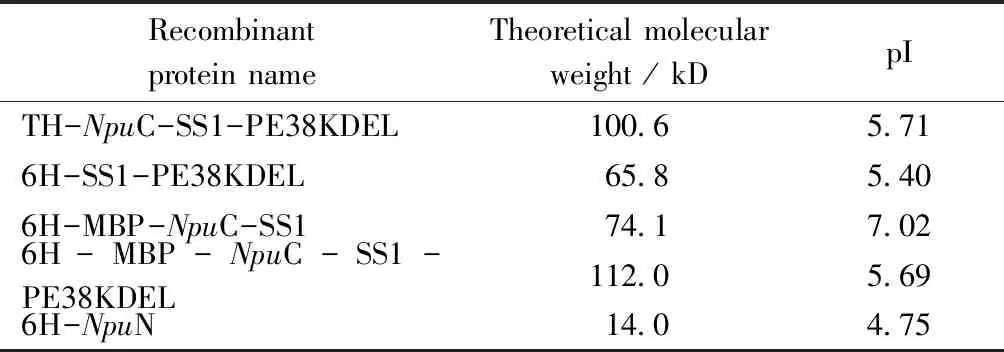
Recombinant protein nameTheoretical molecular weight / kDpITH-NpuC-SS1-PE38KDEL100.65.716H-SS1-PE38KDEL65.85.406H-MBP-NpuC-SS174.17.026H-MBP-NpuC-SS1-PE38KDEL112.05.696H-NpuN14.04.75
2.2.26H-MBP-NpuC-SS1,6H-MBP-NpuC-SS1-PE38KDEL重组蛋白纯化 过夜诱导后,7 000 r/min离心10 min收集菌体,用纯化用缓冲液(20 mmol/L Tris,200 mmol/L NaCl,1 mmol/L EDTA 咪唑,pH 7.4)40 mL将沉淀菌重悬,高压均质机加压至900 bar(1 bar=0.1 MPa),4 ℃破碎3 min后逐渐减压并收集菌液。后迅速在离心机内4 ℃、4 000 r/min 离心30 min,收集上清液备用,收集裂菌沉淀并制备蛋白电泳样品。用Dextrin Beads 6FF重力柱纯化,使用洗脱液(20 mmol/L Tris,200 mmol/L NaCl,1 mmol/L EDTA,10 mmol/L麦芽糖,pH 7.4)洗脱,分管收集蛋白。利用考马斯亮蓝法对蛋白纯化结果进行检测,将含有目的蛋白的洗脱液合并,放置在-20 ℃冻存待用。
2.2.3 6H-NpuN重组蛋白纯化 纯化采用镍柱。上样缓冲液为含有40 mmol/L咪唑的PBS缓冲液(pH 7.4);洗脱缓冲液分别为含有60、80、200 mmol/L咪唑的PBS缓冲液(pH 7.4),每个浓度洗脱10 mL,分管收集蛋白。利用考马斯亮蓝法对蛋白纯化结果进行检测,将含有目的蛋白的洗脱液合并,放置在-20 ℃冻存待用。
2.3 内含肽的体外剪切反应
2.3.1 内含肽的体外剪切反应的检测NpuN端反应底物为6H-NpuN,分别与NpuC端反应底物6H-MBP-NpuC-SS1、6H-MBP-NpuC-SS1-PE38KDEL混合加入,其中6H-NpuN过量。加入二硫苏糖醇(D,L-dithiothreitol,DTT)至终浓度为1 mmol/L,30 ℃反应2 h。以上反应均加入蛋白电泳的5×上样缓冲液终止反应,用考马斯亮蓝染色法对内含肽剪切反应进行检测。剪切后可能包括的产物如表4。使用Image J软件扫描SDS-PAGE电泳图上对应条带的光密度并计算产物生成率,产物生成率计算公式如下:
产物生成率(%)=目的蛋白条带的光密度与相对分子质量的比值/(剩余前体蛋白光密度与相对分子质量的比值+目的蛋白条带的光密度与相对分子质量的比值)×100。
Table4 Theoretical molecular weight and pI of intein cleavage product
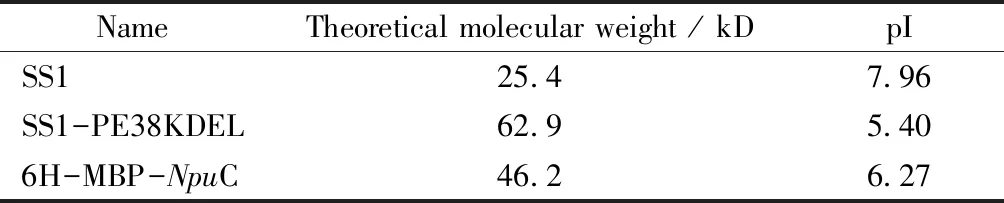
NameTheoretical molecular weight / kDpISS125.47.96SS1-PE38KDEL62.95.406H-MBP-NpuC46.26.27
2.3.2 影响内含肽体外剪切反应的因素 为了进一步优化断裂反应条件,提高断裂反应效率,本实验以6H-MBP-NpuC-SS1和6H-MBP-NpuC-SS1-PE38KDEL为例,在6H-NpuN过量条件下,对可能影响内含肽断裂的几个因素进行探索,包括DTT浓度、反应温度、反应时间3个方面。在时间为2 h,DTT浓度为1 mmol/L条件下,探究在4,30,37 ℃ 3个温度条件下内含肽剪切产物生成率;在温度为30 ℃,DTT浓度为1 mmol/L条件下,探究在5,30,60 min 3个时间点时内含肽剪切产物生成率;在温度为30 ℃,反应时间为2 h条件下,探究不加DTT和DTT浓度为5 mmol/L 2个条件下内含肽剪切产物生成率。用Graphpad Prisim(8.3.0版)软件作统计学分析,通过不同条件下断裂内含肽剪切产物生成率的比较,考察内含肽对剪切反应不同条件的耐受度。使用ImageJ软件扫描SDS-PAGE电泳图上对应条带的光密度并计算产物生成率,生成率计算公式同“2.3.1”项。
2.4 蛋白除杂与目的蛋白的浓缩
断裂反应完成后产物在4 ℃下用3 kD滤膜按照1∶1 000的比例透析,透析液为PBS(pH 7.4),每隔6小时换液1次,共换液2次。透析样品稀释5倍后用镍柱除去未完全断裂的6H-MBP-NpuC-SS1、6H-MBP-NpuC-SS1-PE38KDEL和断裂后的产物杂质6H-MBP-NpuC,接流穿。用Capto L柱浓缩流穿中的目的蛋白,洗脱液为柠檬酸缓冲液(pH 2.6),洗脱后立即加入1 mol/L Tris-HCl(pH 9)调节pH至7.4,所得到的蛋白立即用PBS(pH 7.4)透析,透析步骤同上。
2.5 Fortebio检测亲和力
SS1是鼠源的抗间皮素片段抗体,可与间皮素特异性结合,实验以生物素化人源间皮素为抗原,以pH 7.4的PBS作为蛋白稀释缓冲液,将抗体SS1与免疫毒素SS1-PE38KDEL分别稀释成20,50,100,200,300 nmol/L 5个浓度梯度检测其亲和力。其中传感器采用SA传感器,在PBS浸泡30 min后使用。抗原结合时间设定为300 s,之后用含有0.05% BSA的0.02% PBST封闭300 s,在PBS浸泡120 s后,用抗体亲和300 s,然后在PBS中解离300 s,循环3次再生步骤后(pH 3的10%甘氨酸浸泡15 s,0.05%PBST浸泡5 s),相同步骤测定下一个浓度的抗体亲和情况。
3 结 果
3.1 重组表达质粒的构建
PCR产物经1%琼脂糖凝胶电泳鉴定,结果显示NpuC-SS1片段、PE38KDEL片段、NpuC片段、SS1片段、SS1-PE38KDEL片段、MBP-NpuC-SS1片段、MBP片段均与理论片段大小一致,电泳结果如图2。同源重组或酶切连接后转入DH5α中,抽提质粒后送测序,结果表明质粒均为正确序列。
3.2 重组蛋白的诱导表达及纯化
3.2.1 重组蛋白的诱导表达 将大肠埃希菌SHuffle T7作为宿主细胞表达重组蛋白,探索含有不同促溶标签的蛋白可溶性。其中6H-SS1-PE38KDEL重组蛋白不含有促溶标签。TH-NpuC-SS1-PE38KDEL、6H-MBP-NpuC-SS1、6H-MBP-NpuC-SS1-PE38KDEL分别与6H-SS1-PE38KDEL对比可溶性,结果如图3。对比看出,相较无促溶标签的6H-SS1-PE38KDEL,含有Trx促溶标签的TH-NpuC-SS1-PE38KDEL上清液中蛋白由43%提高到47%;含有MBP促溶标签的6H-MBP-NpuC-SS1上清液中蛋白约为87%,6H-MBP-NpuC-SS1-PE38KDEL上清液中蛋白约为98%。可见MBP促溶标签对本实验中重组蛋白促溶效果更佳,因此实验选用MBP作为促溶标签的重组蛋白用于后期纯化。用Western blot验证蛋白,一抗为抗组氨酸标签抗体(anti His),二抗用羊抗鼠二抗(goat anti mouse IgG),结果如图4,结果表明4种表达蛋白为所构建的重组蛋白。
3.2.2 重组蛋白的纯化 6H-MBP-NpuC-SS1与6H-MBP-NpuC-SS1-PE38KDEL重组蛋白经过Dextrin Beads 6FF(MBP标签亲和柱)纯化后,使用SDS-PAGE进行鉴定,结果如图5-A。结果显示条带大小均符合理论相对分子质量。6H-NpuN蛋白经过镍柱纯化后,结果如图5-B。蛋白在60 mmol/L咪唑浓度条件下开始洗脱,在200 mmol/L咪唑条件下洗脱集中。将含有目的蛋白较多的收集液合并,以待下一步反应。
Figure2 PCR products detected by 1% agarose gel electrophoresis
Lane M:Nucleic acid marker;(A) Lane 1:PCR productNpuC-SS1 amplified by primer 1 and primer 4;Lane 2:PCR productNpuC-SS1 amplified by primer 11 and primer 12;(B) Lane 1:PCR product PE38KDEL amplified by primer 5 and primer 6;Lane 2:PCR product PE38KDEL amplified by primer 5 and primer 8;(C) Lane 1:PCR productNpuC amplified by primer 1 and primer 2;Lane 2:PCR product SS1 amplified by primer 3 and primer 4;(D) Lane 1:PCR product SS1-PE amplified by primer 7 and primer 8;(E):Lane 1:PCR product MBP-NpuC-SS1 amplified by primer 9 and primer 12;Lane 2:PCR product MBP amplified by primer 9 and primer 10
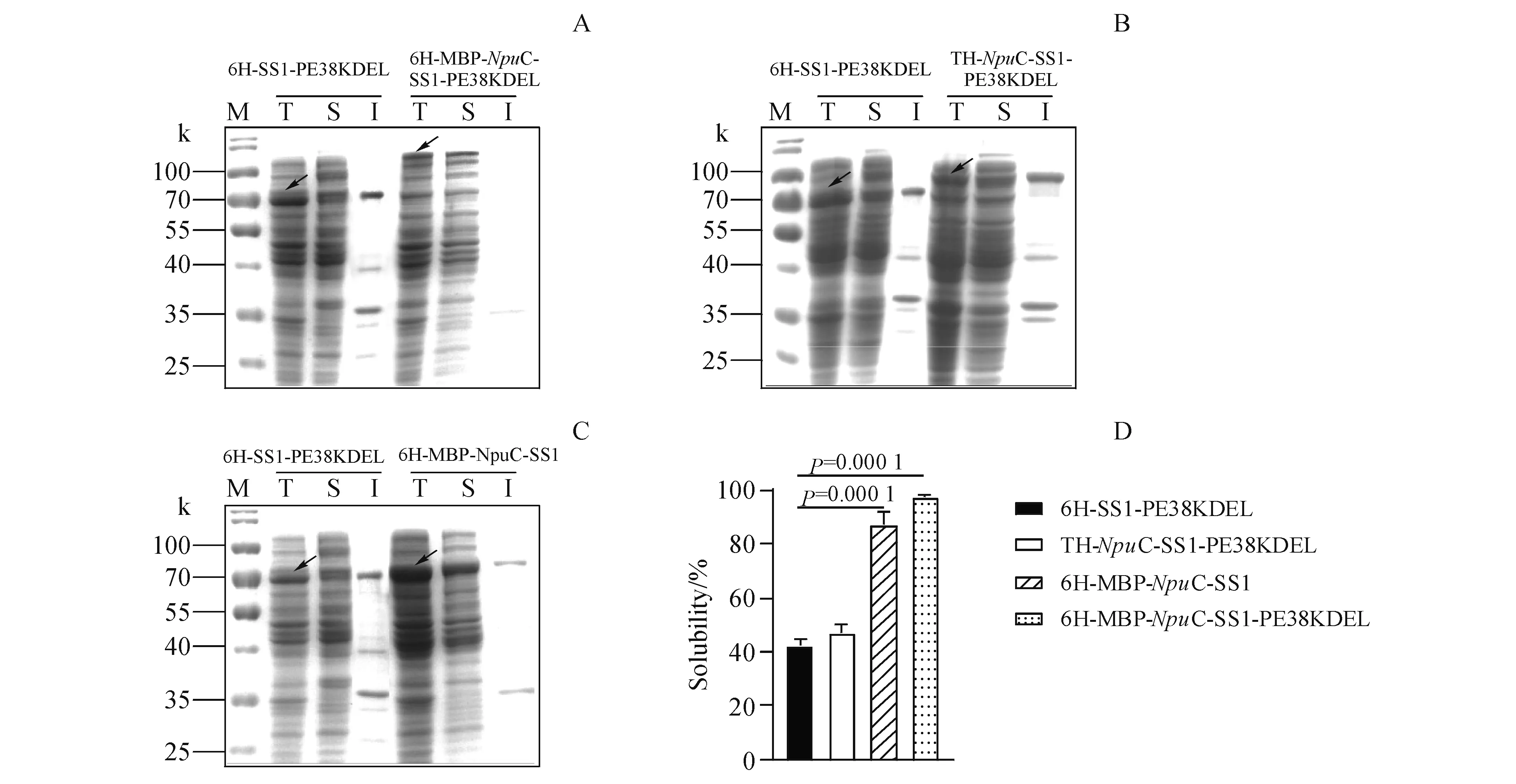
Figure3 12% SDS-PAGE analysis of the expression of recombinant proteins
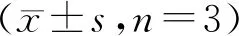
Lane M:Molecular weight marker;Lane T:Whole cell lysates;Lane S:Soluble fraction;Lane I:Insoluble fraction;Full-length fusion proteins are indicated with arrows

Figure4Western blot of four kind of recombinant proteins
The primary antibody is anti His antibody,and the secondary antibody is goat anti mouse IgG antibody
Lane M:Molecular weight marker;(A) Lane 1:Western blot of 6H-NpuC-SS1-PE38KDEL;Lane 2:Western blot of 6H-SS1-PE38KDEL;(B) Lane 1:Western blot of 6H-MBP-NpuC-SS1;Lane 2:Western blot of 6H-MBP-NpuC-SS1-PE38KDEL

Figure5 12% SDS-PAGE of purification ofNpuC recombinant proteins andNpuN 6H-MBP-NpuC-SS1-PE38KDEL and 6H-MBP-NpuC-SS1 purified by Dextrin Beads 6FF column,6H-NpuN purified by nickel column.Full-length fusion proteins are indicated with arrows
(A) Lane M:Molecular weight marker;Lane S:Supernatant after induction;Lane F:Flow through;Lane 1- 5:Elution of 6H-MBP-NpuC-SS1-PE38KDEL using 10 mmol/L maltose;Lane 6- 10:Elution of 6H-MBP-NpuC-SS1 using 10mmol/L maltose;(B) Lane M:the molecular weight marker;Lane S:Supernatant after induction;Lane F:Flow through;Lane 1:Elution of 6H-NpuN using 60 mmol/L imidazole;Lane 2-3:Elution of 6H-NpuN using 80 mmol/L imidazole;Lane 4-8:Elution of 6H-NpuN using 200 mmol/L imidazole
3.3 内含肽的体外剪切反应
3.3.1 内含肽的体外剪切反应的检测NpuC端反应底物6H-MBP-NpuC-SS1和6H-MBP-NpuC-SS1-PE38KDEL分别与NpuN端表达产物6H-NpuN反应,结果如图6所示。反应体系中出现了SS1预期分子大小产物和SS1-PE38KDEL预期分子大小产物。由ImageJ计算得6H-MBP-NpuC-SS1的转化率约为74%,6H-MBP-NpuC-SS1-PE38KDEL的转化率约为70%。

Figure6 12% SDS-PAGE of intein mediated cleavage of recombinant proteins((t=2 h,T=30 ℃,c(DTT )=1 mmol)
Lane M:Molecular weight marker;Lane 1:NpuC cleavage product of 6H-MBP-NpuC-SS1 when add excess 6H-NpuN;Lane 2:NpuC cleavage of 6H-MBP-NpuC-SS1-PE38KDEL when add excess 6H-NpuN
3.3.2 影响内含肽的体外剪切反应的因素 6H-MBP-NpuC-SS1断裂效率受温度影响较小,在4,30,37 ℃下断裂产物生成率基本相当;在DTT浓度为5 mmol/L条件下断裂产物生成率明显高于DTT不存在时断裂产物生成率,且断裂反应5 min之内即可达到平衡。
6H-MBP-NpuC-SS1-PE38KDEL在低温下剪切效率受到较大影响,在30 ℃或37 ℃条件下断裂产物生成率较高;在DTT浓度为5 mmol/L条件下断裂产物生成率明显高于DTT不存在时断裂产物生成率,且断裂反应在30 min内达到平衡。
3.4 内含肽断裂后蛋白纯化
内含肽断裂后产物用镍柱除去未反应底物和断裂杂质后,目的蛋白SS1与SS1-PE38KDEL保留在流穿中,浓度较低。由于Capto L柱对于抗体可变区域Kappa片段具有很强的亲和力,因此在本实验中用于富集镍柱流穿中的目的蛋白。结果表明,Capto L可捕获SS1蛋白,对SS1-PE38KDEL无明显富集作用。SDS-PAGE检测结果如图7所示。图7-A为SS1除杂后Capto L捕获结果,图7-B为镍柱除杂后流穿中剩余的SS1-PE38KDEL。
Figure7 Protein purification after intein cleavage
Nickel column removes precursor protein and impurities afterNpuC cleavage.Then Capto L column capture SS1
Lane M:Molecular weight marker;(A)Lane 1:SS1 captured by Capto L column;(B) Lane 1:SS1-PE in flow through after removal of impurities by nickel column
3.5 Fortebio检测亲和力
SS1及其免疫毒素SS1P能够特异性的与人源mesothelin蛋白结合。利用生物膜干涉技术检测断裂后纯化的SS1与SS1-PE38KDEL与生物素化人源间皮素之间的亲和常数,检测结果显示(图8),断裂纯化后的SS1与mesothelin的亲和力常数Kd为1.59×10-7mol/L,SS1P与mesothelin的亲和力常数Kd为2.03×10-7mol/L,二者的亲和力常数相当。
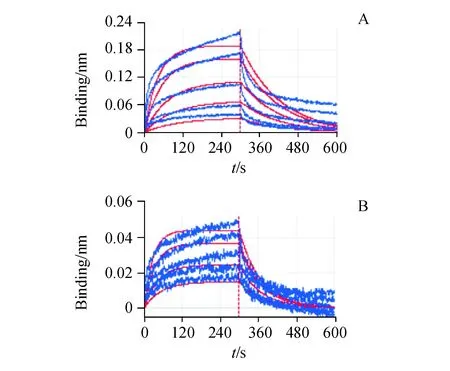
Figure8 Affinity and dissociation between recombinant protein and human mesothelin
Concentration of human mesothelin is 100 nmol,concentration of recombinant protein is 20,50,100,200,300 nmol/L
A:Affinity and dissociation between SS1 and human mesothelin (Kd1.59×10-7mol/L);B: Affinity and dissociation between SS1-PE38KDEL and human mesothelin (Kd2.03×10-7mol/L)
4 讨 论
本实验中,应用断裂内含肽实现蛋白SS1与免疫毒素SS1-PE38KDEL的可溶性表达,既可以省略包涵体复杂的变复性过程,又可以降低去除促溶标签的成本,对今后免疫毒素的生产过程优化具有重要借鉴意义。
本课题中,内含肽NpuDnaE断裂效率略大于70%,断裂效率还有待于进一步提高。推测较低的断裂效率可能由于目的蛋白的首三位氨基酸残基与NpuC天然的C端外显肽首三位氨基酸残基不同导致。大部分DnaE内含肽C端连接的外显肽首三位氨基酸残基为高度保守的“CFN”(半胱氨酸、苯丙氨酸、天冬氨酸),尤其是外显肽首位半胱氨酸对内含肽剪接、剪切活性具有重要作用[18],而本研究是为了探索开发适合于抗体片段及免疫毒素等药用重组蛋白的纯化方法,需避免在目的蛋白中引入外源氨基酸,因此NpuC与目的蛋白之间并未使用连接子进行连接,NpuC的C端外显肽首三位氨基酸残基即为SS1的首三位氨基酸残基“DIE”(天冬氨酸、异亮氨酸、谷氨酸),外显肽首三位氨基酸的差异可能在一定程度上降低了断裂效率[19-20]。此外,本实验发现SS1P相较于SS1而言,剪切效率较低,且受温度影响较大,推测是由于外显肽自身构象会影响内含肽的断裂[21],片段抗体SS1及其免疫毒素SS1P,结构上毒素分子的差异可能造成了断裂产物生成率与剪切速度上的差异。本实验还观察到SS1-PE38KDEL不能很好地与Capto L柱结合,同样提示PE38KDEL片段的存在可能影响了SS1与Capto L柱子的亲和。为进一步探究断裂效率的具体影响因素,可分别通过在外显肽中引入外源氨基酸“CFN”探究连接外显肽的首三位残基的影响,进一步可通过定向进化筛选对外显肽首三位氨基酸宽泛性更佳的内含肽突变体;此外,由于NpuDnaE等天然断裂内含肽在有变性剂存在的条件下仍能保持优异的活性,可尝试通过加入尿素破坏蛋白空间结构的方式探究外显肽构象对断裂效率的影响。
经Fortebio验证,借由本研究表达纯化方法得到的SS1与SS1-PE38KDEL均具有亲和活性,表明方案设计的免疫毒素可溶性表达工艺具有潜在实际应用价值。同时,本研究仍有许多方面需要进行更加深入的研究,例如内含肽剪接反应后产物的进一步纯化方法的开发,空间结构的因素是否影响断裂反应效率等。
——一道江苏高考题的奥秘解读和拓展

