雷公藤红素联合用药对HepG2细胞增殖的抑制作用
张 雪,欧阳惠枝,徐 伟,王晓颖
(福建中医药大学药学院,福州 350122)
雷公藤红素(celastrol,Cela)是中药雷公藤(TripterygiumwilfordiiHook.f.)的有效成分之一,是一种天然的蛋白酶体抑制剂,具有免疫调节、抗炎、抗肿瘤等多种药理作用[1]。近年来研究表明,Cela可抑制多种肿瘤的引发、转移和增殖,对胰腺癌、胃癌、前列腺癌等均有较好疗效[2-3]。Cela可以通过抑制肿瘤细胞新血管生成、激活ROS产生诱导细胞凋亡等机制抑制肝癌细胞增殖[4-5]。但其靶向性低、不良反应大,限制了其临床应用。
大黄酸(rhein,Rh)、紫杉醇(paclitaxel,PTX)和甘草次酸(glycyrrhetinic acid,GA)均具有抗肝癌活性,它们均可以通过诱导细胞凋亡以及阻滞细胞周期来抑制HepG2细胞增殖[6-8]。有实验表明Rh、GA具有保肝作用[9-10],可以降低药物带来的肝损伤;PTX为临床一线抗肿瘤药,临床研究表明其与其他药物联用能达到对肝癌更好的治疗效果[11]。综上考虑,本研究希望探索一种以Cela为主的联合给药系统,在达到良好的抗肝癌效果的同时减少对正常组织的副作用。因此,本研究采用MTT法考察了Cela分别与Rh、PTX、GA 3种中药有效成分联用对HepG2细胞增殖抑制的影响,根据药物协同指数、金氏公式、凋亡检测、细胞周期检测分析Cela分别与Rh、PTX、GA联用时对HepG2细胞增殖抑制作用效果,以期未来为Cela联合用药、增效减毒以及剂型设计奠定研究基础。
1 材 料
1.1 药品与试剂
雷公藤红素(成都普菲德生物技术有限公司);大黄酸(分析级,南京景竹生物科技有限公司);紫杉醇(上海金和生物制药有限公司);甘草次酸(β型,上海阿拉丁生化科技股份有限公司);DMEM高糖培养基(美国HyClone公司);胎牛血清、青霉素-链霉素溶液、0.25%胰蛋白酶(美国Gibco公司);二甲基亚砜(DMSO,上海泰坦科技股份有限公司);AnnexinV-FITC/PI细胞凋亡检测试剂盒(广州美仑生物科技有限公司)。
1.2 仪 器
流式细胞仪(美国BD公司);多功能酶标仪(瑞士Tecan公司);细胞培养箱(美国赛默飞公司);低速离心机(安徽中科中佳科学仪器有限公司)。
1.3 细 胞
人肝癌细胞HepG2(中科院干细胞与再生医学创新研究院)。
2 方 法
2.1 细胞培养
将HepG2细胞于含10%胎牛血清、1%青霉素-链霉素溶液的DMEM高糖培养基中,置于37 ℃、5% CO2恒温细胞培养箱中培养。每2天或3天传代1次,取对数生长期细胞进行实验。
2.2 MTT法测定药物对细胞的抑制作用
取对数生长期的HepG2细胞接种于96孔板中,每孔细胞数为5×103个,置于培养箱中培养24 h后,分对照组和实验组进行实验。对照组为不加任何药物,正常培养的细胞;实验组分别为:Cela组、Rh组、PTX组、GA组,Cela+Rh组、Cela+PTX组和Cela+GA组。Cela组质量浓度依次为0.01,0.1,0.25,0.5,1,2.5,5 μg/mL;Rh组、PTX组、GA组,质量浓度为0.01,0.1,1,5,10,20,40,60 μg/mL;联合用药组固定Cela质量浓度,选择使用不同质量浓度的Rh、PTX、GA。每组设6个复孔。处理48 h后,吸弃培养基,每孔加入1 μg/mL MTT 100 μL,继续培养4 h后,吸弃MTT溶液,加入DMSO 150 μL振摇均匀。用酶标仪在检测波长570 nm检测波长下测定吸收度,计算肿瘤细胞的存活率。存活率=(给药组吸收度的平均值-空白组吸收度的平均值)/(对照组吸收度的平均值- 空白组吸收度的平均值)×100%。
2.3 药物协同作用分析
为判断两药合用是拮抗、相加或增强的协同效应,采用Chou-Talalay法以及金氏公式,利用Compusyn 1.0软件计算不同浓度Cela分别和Rh、PTX、GA药物以非固定比例组合的协同指数(CI)并且绘制Fa-CI图,Fa-CI图可根据观测比较实际测量点落入图中所在区域的位置,可直观判断联用药物在剂量、效应二者之间的关系,以及变化趋势。CI<1表示两药相互协同;CI=1表示两药作用相加;CI<1表示两药作用拮抗;CI<0.3表示两药协同作用强烈[12]。利用金氏公式求q值:q=EA+B/[EA+(1-EA)×EB],EA+B表示两药合用的抑制率;EA、EB为单独用药的抑制率;q<0.85表示两药合用有拮抗作用;q>1.15表示两药合用有协同作用;0.85≤q≤1.15表示两药合用有相加作用[13]。利用GraphPad Prism 5计算Cela单独用药以及联合用药的IC50。
2.4 细胞凋亡检测
取对数生长期的HepG2细胞以2×105个细胞的密度接种于6孔板中,培养箱培养过夜后,吸弃培养基,用PBS洗2遍。分别设置对照组、Cela组、Rh组、PTX组、GA组、联合用药组,每组设3个复孔,培养箱培养48 h后,采用AnnexinV-FITC/PI细胞凋亡检测试剂盒进行样品处理,用流式细胞仪进行检测。
2.5 细胞周期检测
取对数生长期的HepG2细胞以每孔4×105个细胞的密度接种于6孔板中,培养箱培养过夜,吸弃培养基,用PBS洗2遍。分别设置对照组、Cela组、Rh组、PTX组、GA组和联合用药组,每组设3个复孔,培养箱培养24 h后,采用细胞周期检测试剂盒进行样品处理,用流式细胞仪进行检测。
2.6 统计分析

3 结 果
3.1 雷公藤红素对肿瘤细胞增殖的影响
单独应用Cela对HepG2细胞增殖抑制的实验中,各浓度Cela处理细胞48 h后,细胞存活率见图1-A。结果显示,Cela在质量浓度低时对HepG2细胞增殖无明显抑制作用,随着质量浓度的升高,抑制作用明显加强,呈明显剂量依赖性;Cela质量浓度为0.75和1 μg/mL时,细胞存活率与空白对照组相比具有显著差异(P<0.05),Cela质量浓度为2.5和5 μg/mL时,细胞存活率与空白对照组相比具有极显著差异(P<0.001)。
3.2 协同用药组Rh、PTX、GA终浓度确定
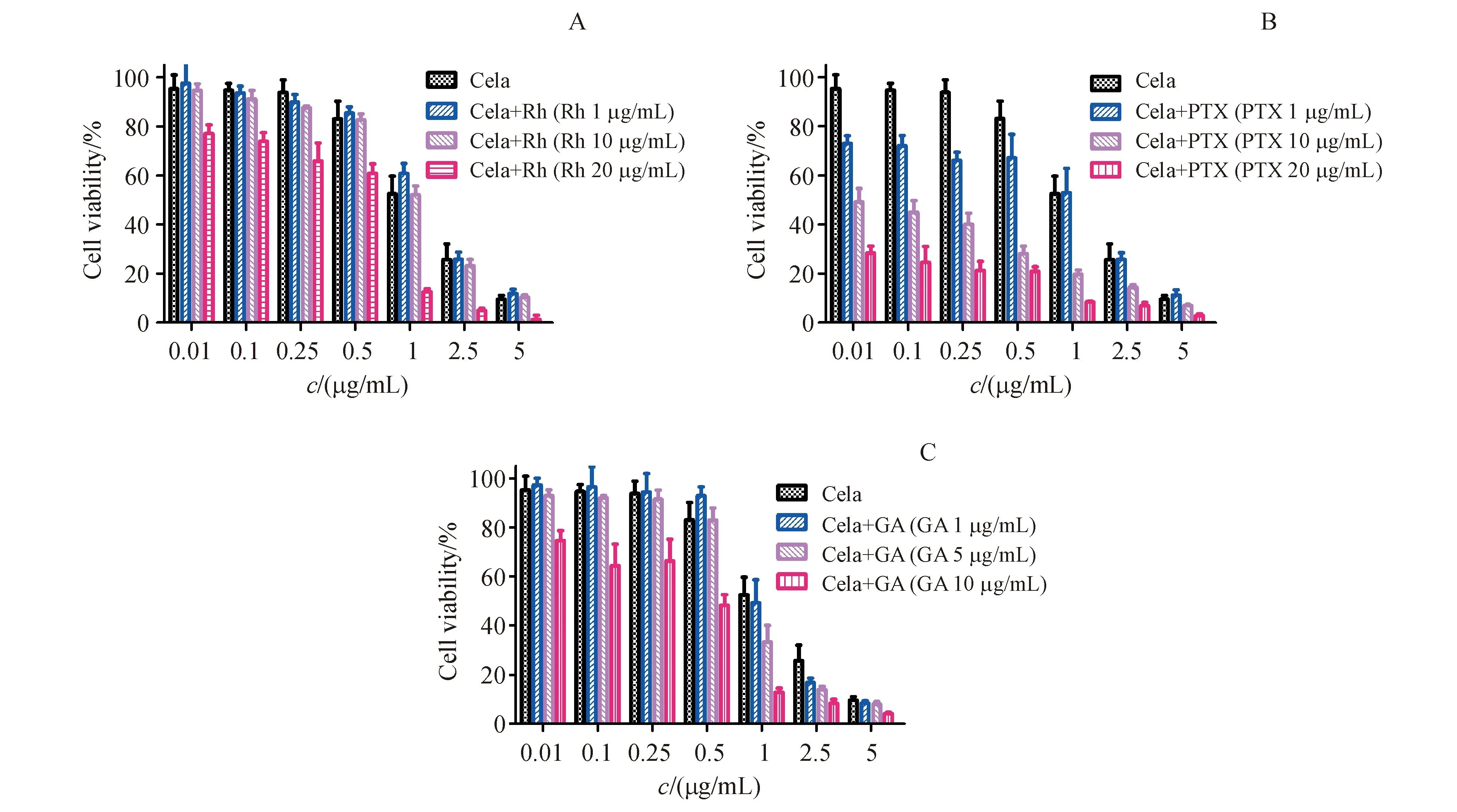
单独使用Rh、PTX、GA作用于HepG2细胞,给药后48 h后,细胞存活率结果分别如图1-B、1-C和1-D所示,Rh、PTX、GA均可以抑制HepG2细胞增殖,细胞生长抑制率随着Rh、PTX、GA质量浓度增加而增加的趋势,呈现一定剂量依赖性。根据Rh、PTX、GA抑制HepG2细胞增殖的存活率图,最终选用协同药物质量浓度分别为:Rh 1、10、20 μg/mL;PTX 0.1、10、20 μg/mL;GA 1、5、10 μg/mL。


A:MTT assay of celastrol (Cela) on the proliferation of HepG2 cells;B:MTT assay of rhein (Rh) on the proliferation of HepG2 cells;C:MTT assay of paclitaxel (PTX) on the proliferation of HepG2 cells;D:MTT assay of glycyrrhetinic acid (GA) on the proliferation of HepG2 cells
*P<0.05,**P<0.01,***P<0.001vscontrol group
3.3 联合用药对肿瘤细胞增殖的影响
Cela与Rh、PTX、GA联合用药对肿瘤细胞增殖抑制的结果见图2。结果表明,Cela与Rh联合用药时,Rh在20 μg/mL质量浓度时,Cela+Rh组在Cela 0.01、0.1、0.25 μg/mL质量浓度时对HepG2细胞的增殖抑制作用效果是Cela单独使用的5倍;Cela+PTX联合用药组在Cela 0.01、0.1、0.25 μg/mL质量浓度时抑制HepG2细胞增殖的效果比Cela单独用药组高出10倍以上,抑制作用呈质量浓度依赖性,Cela低质量浓度时增殖抑制效果更优;Cela+GA联合用药组与Cela单用组相比,10 μg/mL GA与Cela合用48 h,抑制率由Cela单独用药组的(4.70±5.67)%~(90.40±1.48)%提高到(25.36±4.02)%~(95.86±0.45)%,低浓度时抑制作用更明显。以上结果说明Cela单用仅在高质量浓度时对HepG2细胞有明显增殖抑制作用,Rh、PTX、GA均有增强Cela对HepG2细胞增殖抑制作用的效果,并且在Cela低质量浓度时增强作用更好,联合用药组比Cela单用组细胞增殖抑制效果更优。
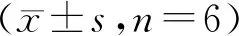
A:MTT assay of Cela combined with Rh on the proliferation of HepG2 cells;B:MTT assay of Cela combined with PTX on the proliferation of HepG2 cells;C:MTT assay of Cela combined with GA on the proliferation of HepG2 cells
通过GraphPad Prism 5软件的非线性回归计算Cela单用及各药物联用组用于HepG2细胞48 h后的IC50(表1)显示,与Cela单独使用时IC50相比,Cela分别与20 μg/mL Rh和10 μg/mL GA联用时,IC50明显降低,Cela与0.1、10、20 μg/mL PTX联用后,IC50皆有明显降低。说明Cela与PTX联用对HepG2细胞增殖抑制作用更佳。
实验采用协同指数法以及金氏公式对Cela分别与Rh、PTX、GA之间的相互作用类型(相加性、协同性或拮抗性)进行了评价,并绘制了Fa-CI图(见图3)。结果表明,Cela质量浓度为0.01~0.5 μg/mL时,Cela分别与Rh、GA联合用药组均表现为拮抗作用,随着Cela质量浓度增大,联合用药组CI<1,q>0.85(q值见表1),且绝大部分CI<0.7、q>1.15,表现出显著协同以及相加作用;Cela与PTX合用时,当两者都处于低浓度时表现为拮抗作用,随着两药的浓度增大,表现出协同作用,尤其是PTX质量浓度增大到20 μg/mL后,协同作用非常显著。由Fa-CI图可看出,联合用药组在较宽浓度范围内,CI始终低于1,表明Cela与Rh、PTX、GA联用的协同效果良好。

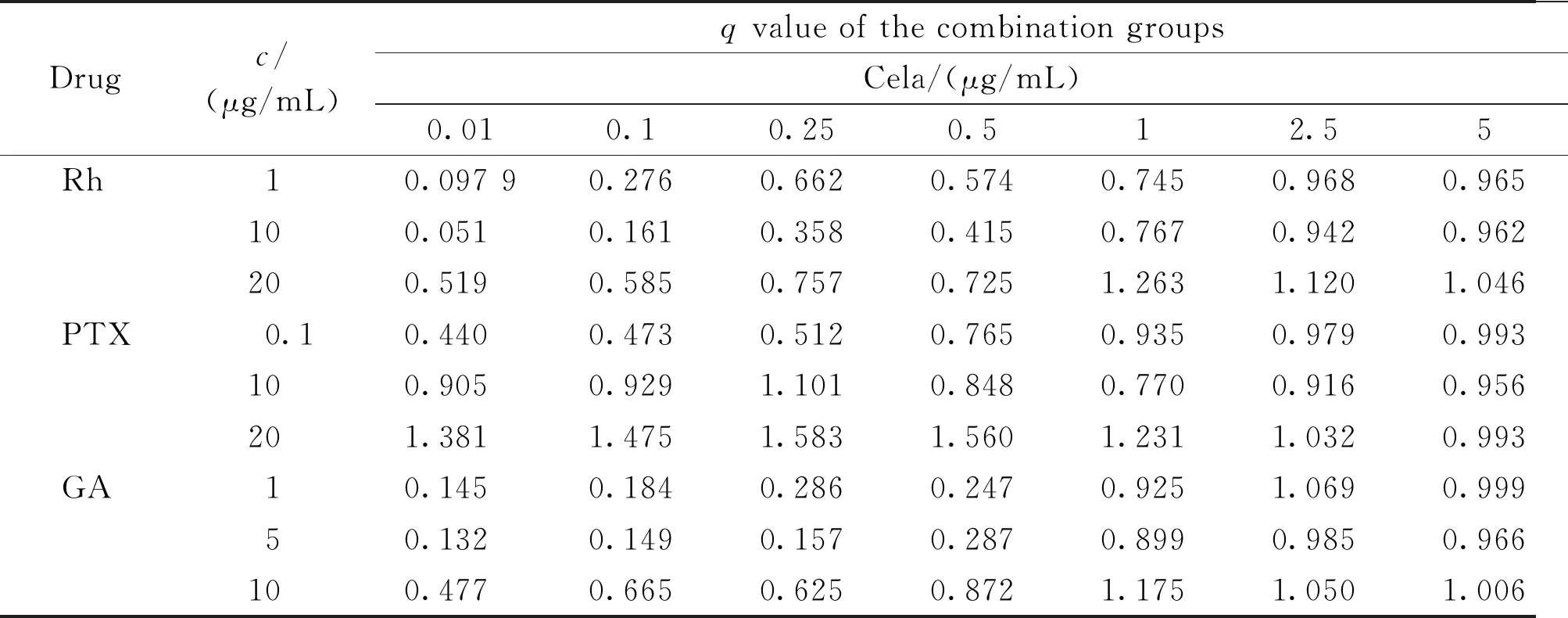
Drugc/(μg/mL)q value of the combination groupsCela/(μg/mL)0.010.10.250.512.55IC50 of the combination groups/(μg/mL)Rh10.097 90.2760.6620.5740.7450.9680.9651.360100.0510.1610.3580.4150.7670.9420.9621.157200.5190.5850.7570.7251.2631.1201.0460.413PTX0.10.4400.4730.5120.7650.9350.9790.9930.682100.9050.9291.1010.8480.7700.9160.9560.023201.3811.4751.5831.5601.2311.0320.9930.001GA10.1450.1840.2860.2470.9251.0690.9991.09650.1320.1490.1570.2870.8990.9850.9660.837100.4770.6650.6250.8721.1751.0501.0060.280
q<0.85 indicates that the two drugs have an antagonistic effect;q>1.15 indicates that the two drugs have a synergistic effect;0.85≤q≤1.15 indicates that the two drugs have an additive effect


A:Fa-CI plot of Cela combined with Rh on HepG2 cells;B:Fa-CI plot of Cela combined with PTX on HepG2 cells;C:Fa-CI plot of Cela combined with GA on HepG2 cells
Above the line indicates the antagonistic effect between the two drugs,on the line indicates the additive effect between the two drugs,below the line indicates the synergy between the two drugs
3.4 细胞凋亡率
采用AnnexinV-FITC/PI标记法结合流式细胞仪检测,Cela、Rh、PTX、GA单独用药和Cela与Rh、PTX、GA联合用药组作用于HepG2细胞48 h后,细胞凋亡率(图4)结果显示,单独使用Cela 0.5 μg/mL、Rh 10 μg/mL、PTX 0.1 μg/mL、GA 10 μg/mL作用于HepG2细胞48 h时,细胞凋亡率分别为(9.67±0.60)%、(10.43±0.93)%、(23.33±1.20)%和(5.40±0.95)%。GA 10 μg/mL、PTX 0.1 μg/mL、Rh 10 μg/mL分别与Cela 0.5 μg/mL合用48 h后,细胞凋亡率均提高,Cela+Rh、Cela+PTX、Cela+GA依次为(23.50±2.91)%、(57.57±2.34)%和(11.77±0.32)%。结果显示4种药物均可诱导细胞凋亡,联合用药组细胞凋亡率显著提高,差异均有统计学意义(P<0.01)。
3.5 细胞周期检测
将HepG2细胞分别用Cela、Rh、PTX、GA、Cela+Rh、Cela+PTX、Cela+GA干预24 h后,采用流式细胞仪检测细胞周期分布,并在细胞G0/G1期、S期和G2/M期观察分析数据(图5)。结果表明,HepG2细胞在药物干预下,周期发生明显变化,Cela、GA、PTX单独处理组可引起G2/M期阻滞,Rh单独处理组可引起G0/G1期阻滞。而联合用药组的G0/G1期细胞百分率明显减少,S期和G2/M期细胞比例相应地增加,说明联合用药组使得细胞更多地阻滞于G2/M期,进而抑制细胞增殖。

A:Apoptosis rate of Cela,Rh,PTX,GA alone on HepG2 cells;B:Apoptosis rate of Cela and Rh (Cela 0.5 μg/mL,Rh 10 μg/mL),Cela and PTX(Cela 0.5 μg/mL,PTX 0.1 μg/mL),Cela and GA (Cela 0.5 μg/mL,GA 10 μg/mL) on HepG2 cells
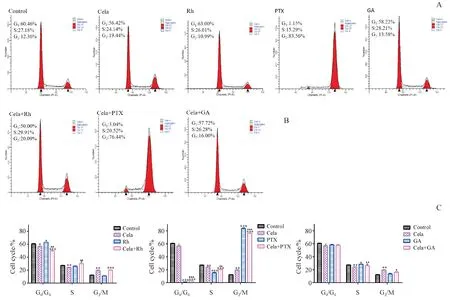
A:Flow cytometry analysis of Cela,Rh,PTX,GA alone on the cell cycle of HepG2 cells;B:Flow cytometry analysis of Cela and Rh (Cela 0.5 μg/mL,Rh 10 μg/mL),Cela and PTX (Cela 0.5 μg/mL,PTX 0.1 μg/mL),Cela and GA (Cela 0.5 μg/mL,GA 10 μg/mL) on the cell cycle of HepG2 cells;C:Statistical of G1,S and G2phase distribution in histograms
*P<0.05,**P<0.01,***P<0.001vscontrol group;▲P<0.05,▲▲P<0.01,▲▲▲P<0.001vsCela group
4 讨 论
Cela是一种具有潜力的抗肿瘤药物,自2006年Yang等[14]首次报道了Cela可以诱导前列腺癌细胞凋亡,引发了对Cela抗肿瘤作用的热点研究。但Cela具有全身性不良反应,如心脏毒性、肾毒性、生殖毒性等,胃肠道反应严重[15-16]。为解决其不良反应大的缺陷,本研究从抑制肿瘤细胞增殖的角度考虑,以具有抗肿瘤作用的中药有效成分GA、PTX、Rh与其联合应用,以期通过减少用量或在制备新型制剂时实现肝靶向、减轻不良反应的同时获得更好的临床治疗效果的目的,为Cela的临床应用探索新路。GA由于肝细胞表面存在大量甘草次酸受体而具有肝靶向性[17],为GA修饰纳米制剂载体肝靶向递送Cela提供可能,并且结合本研究结果,GA还能够与Cela协同对HepG2肝癌细胞增殖起抑制作用,为Cela联合应用GA制备肝靶向制剂的研究拓展思路。Rh可通过刺激ROS产生和Ca2+释放进而引发内质网应激效应[18-19],本研究中Rh与Cela协同抑制肿瘤细胞增殖,诱导细胞凋亡,两者合用可提高Cela疗效。PTX是一线抗肿瘤药物,但容易产生耐药性,而Cela可以降低PTX耐药乳腺癌细胞的耐药性[20],本研究结果表明Cela与PTX联用具有非常显著的协同作用,二者联用可减少各自用药剂量从而降低肿瘤细胞耐药现象的出现。综上,Cela分别与GA、PTX、Rh联用,为Cela增效减毒、制剂设计以及临床应用提供了可行的方案。
本实验采用不同质量浓度的Cela分别与不同质量浓度GA、PTX、Rh联合用药作用于HepG2肿瘤细胞,结果显示Cela、GA、PTX、Rh单独作用时,均可以抑制肿瘤细胞生长,并呈剂量依赖性。Cela分别与GA、PTX、Rh合用时,肿瘤细胞生长受到明显抑制,在一定浓度范围内具有明显协同作用,说明在两药联用过程中,可通过调节两药配伍剂量达到提高Cela疗效或减少Cela用量以减少其不良反应的目的。Cela在体外可通过诱导HepG2细胞凋亡并且可以阻滞细胞的G2/M期,从而抑制HepG2肿瘤细胞增殖,与GA、PTX、Rh联合使用后凋亡率增加,阻滞作用更强,抑制细胞增殖效果更好。这一结果对临床药物联用以及开发Cela药物剂型提供了研究基础。

