金黄色葡萄球菌核酸酶对2,4,6-三硝基苯磺酸诱导的小鼠结肠炎的保护作用
张婷婷,梅银柳,董万法,王镜勋,金 亮,吴 洁
(中国药科大学生命科学与技术学院微基因药学实验室,南京 210009)
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性肠道疾病,包括溃疡性结肠炎(ulceration colitic,UC)和克罗恩病(Crohn′s disease,CD),在西方国家较为常见,北美和欧洲分别有超过150万和200万人患病,近年来,随着生活方式的改变,亚洲国家发病率逐年提高[1]。IBD发病机制不明,一般认为与环境因素、遗传因素、肠道微环境和免疫因素等相关。目前IBD治疗手段主要依赖手术切除和病症缓解,但存在不良反应强、易复发等缺点,因此寻找新的治疗靶点是十分必要。
中性粒细胞是机体抵抗病原体入侵的第一道屏障,在固有免疫中发挥重要作用。2004年,研究人员发现中性粒细胞可通过一种新型方式达到杀灭病原体的作用——中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs),它是活化的中性粒细胞释放核内包括染色质DNA在内的核酸,并包裹自身胞质颗粒蛋白酶所形成的纤维网状结构[2]。研究发现,NETs在杀伤病原菌的同时也会对机体黏膜组织造成损伤,NETs的过度强盛或者不及时清除与类风湿关节炎、系统性红斑狼疮等多种自身性免疫疾病密切相关[3-4]。蛋白组学分析发现溃疡性结肠炎患者结肠组织中有多种NETs成分蛋白[5],另有研究发现对中性粒细胞蛋白如蛋白酶3(PR3)、髓过氧化物酶(MPO)、中性粒细胞弹性蛋白酶(NE)和组蛋白的抗中性粒细胞胞浆抗体(ANCA)可成为IBD诊断和预后的生物标志物[6],这些蛋白会在NETs形成过程中释放并成为ANCA的来源[7-8],从而增强机体免疫反应,造成组织损伤。由此可见,NETs形成参与IBD疾病发展。
DNA是NETs主要的结构成分,NETs抗原性也需DNA维持结构完整性[9],因此破环NETs的DNA骨架可以阻止其导致的异常自身免疫。国内外也有多项研究证明,DNase可用于改善和治疗因NETs增多而引发的疾病[10]。金黄色葡萄球菌分泌的葡萄球菌核酸酶(SNase)是一种具有磷酸二酯酶活性的单链蛋白,能迅速切割DNA和RNA长链形成的3′-核苷酸产物,且pH 4.8~9.2之间具有很好的酶活等优点[11]。
乳酸菌(lactis acid bacteria,LAB)是公认的食品级安全菌,试验表明,乳酸乳球菌(Lactococcuslactis,L.lactis)可以逃离胃酸的过度侵袭(存活率90%~98%),并成功定植肠道,以乳酸乳球菌表达载体已逐渐成为口服疫苗的热点[12]。本课题组前期构建制备的重组乳酸菌L.lactispCYT:SNase可以稳定表达SNase,并用于递送基于自身抗原设计的重组蛋白疫苗[13]。前期的实验结果表明:灌胃给予表达SNase的重组乳酸菌一方面可以稳定定植于NOD小鼠肠道中并表达SNase蛋白[14]。在本次研究中将已表达SNase的重组乳酸菌灌胃给TNBS诱导的结肠炎模型小鼠,以探究其基于NETs降解而对小鼠肠道炎症的保护机制。
1 材 料
1.1 药品与试剂
5% TNBS水溶液(美国Sigma公司);乳链菌肽(上海源叶生物科技有限公司);胰蛋白胨、酵母提取物(德国Oxoid公司);M17肉汤粉(青岛海博生物技术有限公司);兔Ly6G抗体(美国Santa Cruz公司),兔citH3抗体(英国Abcam公司);隐血试剂盒(上海雷根生物科技有限公司);LEGENDplexTM多因子检测试剂盒(美国Biolegend公司);TMB显色液(上海碧云天生物技术有限公司);逆转录试剂盒(武汉艾瑞科生物科技有限公司);SYBR Green Premix试剂盒(上海天根生物科技有限公司),其他试剂均为市售化学或分析纯。
1.2 仪 器
Spark多功能酶标仪(瑞士Tecan公司);离心机(湖南湘仪实验仪器开发有限公司);7300 Plus Real-Time PCR system、FACS Calibur流式细胞仪(美国BD公司);数理切片扫描仪(日本Hamamatsu公司);超声破碎仪、LGJ-12冷冻干燥机、ZXZ-2型旋片式真空泵(台州市博雯真空设备有限公司);研磨仪(北京赫得科技有限公司);MylabTMShaker SLST3(韩国Seoulin公司)。
1.3 菌 种
L.lactisNZ9000和L.lactispCYT:SNase均为本实验室保存。
1.4 动 物
清洁级BALB/c小鼠,雌性,体质量20~22 g,购自上海西普儿-必凯实验动物有限公司,合格证号:SCXK(沪)2018-0006。所有动物实验均符合动物伦理操作。
2 方 法
2.1 给药乳酸菌L.lactis pCYT:SNase的制备
给药乳酸菌L.lactispCYT:SNase的制备方法参见文献[14],即从保存的L.lactispCYT:SNase甘油管按照体积分数1%加到GM17培养基中30 ℃恒温静置过夜培养。次日按体积分数4%的接种量将活化的菌液转接到GM17大瓶培养基中培养。当培养液A600达到0.5左右时加乳链菌肽(nisin)诱导培养,至A600达到1.2时停止培养。收集菌体,用无菌水对沉淀进行重悬,调整菌体浓度至2×1010CFU/mL。L.lactisNZ9000(以下简称NZ9000)同法培养和制备,但不加诱导剂。
2.2 TNBS诱导小鼠结肠炎模型的建立及给药
小鼠清洁级环境下适应饲养1周,实验前按体质量随机分为4组:健康对照组(Control)、TNBS模型组(TNBS)、TNBS+NZ9000组(LL)、TNBS+L.lactispCYT:SNase组(LL-SNase);每组12只。造模前小鼠禁食不禁水24 h,4%水合氯醛按照10 μL/g 的剂量腹腔注射麻醉小鼠,用3.5F橡胶软管甘油浸润后从肛门缓慢插入4 cm处,按照100 mg/kg的剂量灌入5% TNBS水溶液加等体积乙醇的混合液,静置30 s拔出,倒置5 min放回笼中,待其自然清醒。每天观测小鼠体质量、粪便性状及隐血状况,根据表1的疾病活动指数(DAI)评分标准计算出每组小鼠的平均DAI分数[15]。给药流程见图1,具体为造模前3天提前乳酸菌灌胃给药,每天1次,剂量均为每只4×109CFU。于第6天处死小鼠,分离结肠和脾脏,后续进行组织学分析。
Figure1 Schematic representation ofL.lactisadministration and induction of colitis in mice by 2.5%2,4,6-trinitro-benzene sulfonic acid(TNBS)
Table1 Disease activity index (DAI) score after TNBS induction in mice

ScoreBody weight loss/%Stool consistencyBleeding0<0NormalNegative11-5--26-10Loose stoolHemoccult positive311-15--4>15DiarrheaGross bleeding
2.3 结肠组织HE分析
分别取各组结肠于4%多聚甲醛中固定,经石蜡包埋,制成5 μm切片,HE染色后,在显微镜下观察结肠黏膜肌层结构完整性、杯状细胞数量、隐窝结构及炎性细胞浸润等情况,根据影响的程度对各组小鼠结肠组织进行评分[16]:无影响(0)、轻(1)、重(2)。每组最终评分为各项指标的平均数。
2.4 结肠组织MPO酶活测定
分别取各组结肠组织20 mg左右,加入生理盐水研磨成10%的组织匀浆液,4 ℃,12 000 r/min离心15 min收集上清液,取10%结肠匀浆上清 10 μL 和TMB溶液100 μL,37 ℃反应5 min,加入2 mol/L硫酸50 μL终止反应,于450 nm处测定吸收度。MPO相对酶活(U/g组织湿重)=(测定吸收度-对照吸收度)/取样量(g)。
2.5 结肠组织QPCR检测
称取结肠组织50 mg,加入Trizol 500 μL,提取总RNA,定量后取2 μg RNA按照逆转录试剂盒合成cDNA,用SYBR Green进行扩增,反应条件如下:95 ℃ 30 s循环1次,95 ℃ 5 s,60 ℃ 30 s循环40次。GAPDH作为每次扩增内参,相对表达水平用2-ΔΔCt表示,引物序列见表2。
Table2 Sequences of real time PCR primers
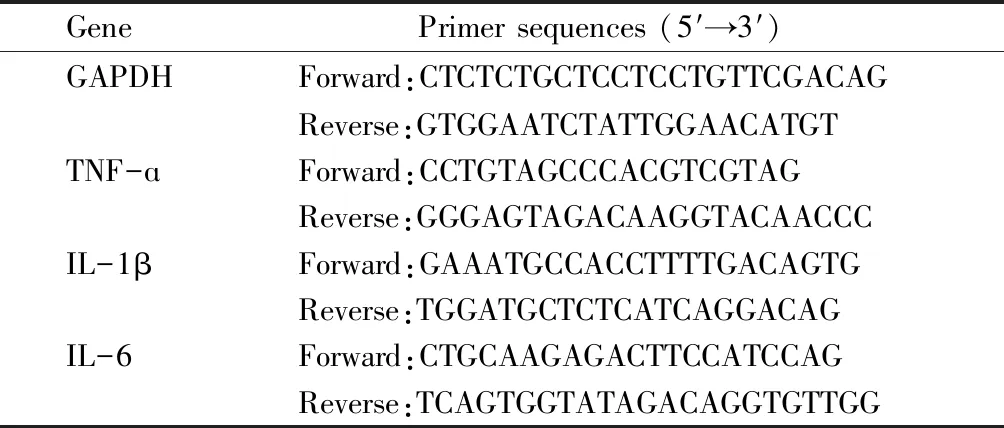
GenePrimer sequences (5′→3′)GAPDHForward:CTCTCTGCTCCTCCTGTTCGACAGReverse:GTGGAATCTATTGGAACATGTTNF-ɑForward:CCTGTAGCCCACGTCGTAGReverse:GGGAGTAGACAAGGTACAACCCIL-1βForward:GAAATGCCACCTTTTGACAGTGReverse:TGGATGCTCTCATCAGGACAGIL-6Forward:CTGCAAGAGACTTCCATCCAGReverse:TCAGTGGTATAGACAGGTGTTGG
2.6 血清流式多细胞因子检测
采用LEGENDplexTM多因子检测试剂盒,流式检测血清与炎症相关的炎性细胞因子。简要流程为:标准品和血清稀释样本分别与磁珠室温孵育2 h,加抗体后继续室温孵育1 h,加PE荧光标记的链霉亲和素室温孵育30 min,离心加缓冲液混悬上流式细胞仪检测,用Legendplex软件进行数据分析。
2.7 结肠组织免疫组化分析
各组石蜡包埋的结肠组织切成5 μm的切片,进行Ly6G和citH3抗体染色,用数字病理切片扫描仪进行扫描,Image Pro Plus软件分析阳性信号。
2.8 统计分析
3 结 果
3.1 重组乳酸菌SNase表达的鉴定
如图2所示,乳链菌肽诱导的工程菌L.lactispCYT:SNase能稳定表达SNase。在本课题组前期研究中,重组乳酸菌诱导表达的SNase可在体外有效降解中性粒细胞刺激形成的NETs,并能通过灌胃乳酸菌成功被递送至肠道发挥其降解NETs的作用[14]。
3.2 SNase缓解TNBS诱导的小鼠结肠炎疾病指征
用TNBS建立小鼠结肠炎模型,提前3 d乳酸菌给药,观测小鼠生存情况,体质量变化,DAI评分。在实验第6天处死小鼠,分离结肠和脾脏,测量结肠长度和称量脾脏重量。TNBS造模后小鼠生存3只,经过LL处理小鼠生存4只,LL-SNase组小鼠生存3只。结果显示,相比较于健康对照组,TNBS诱导小鼠体质量下降(图3-A)更明显,DAI评分(图3-B)显著提高,结肠长度明显缩短(图3-C,图3-D),脾脏质量也明显增加(图3-E)。经LL-SNase给药处理后,体质量下降有所缓解,DAI评分也有下降,结肠长度明显变长。从宏观指标上看,SNase可以缓解TNBS诱导的小鼠结肠炎的发展。
为进一步观察SNase对结肠组织组织结构和炎性细胞浸润的影响,对结肠组织进行HE染色分析。由图4-A可以看出,相比较于健康对照组,TNBS组结肠组织黏膜肌层结构被破环,腺上皮细胞大量较少,结构紊乱,而经LL-SNase处理后,黏膜肌层结构较为完整,腺上皮细胞增多,排布整齐。根据黏膜肌层结构破环程度,杯状细胞数量,隐窝结构及中性粒细胞,淋巴细胞浸润情况对各组结肠HE切片进行评分(图4-B),LL-SNase组中TNBS小鼠的结肠组织损伤得到明显改善。结果表明,SNase能够很好地缓解TNBS诱导的小鼠结肠炎的发展。
3.2 SNase缓解小鼠结肠组织炎性水平
为了探究乳酸菌递呈的SNase对结肠组织炎性水平的影响,本研究测定了小鼠结肠组织MPO酶活。如图5-A所示,相比较于健康对照组,TNBS组MPO酶活显著提高,而LL-SNase处理明显下调 TNBS 诱导小鼠结肠组织MPO酶活性,提示SNase能够改善TNBS小鼠结肠组织中性粒细胞浸润状况。本研究进一步对小鼠结肠组织炎性细胞因子TNF-ɑ、IL-1β和IL-6进行mRNA水平分析。如图5B-5D显示,相比较于健康对照组,TNBS组IL-1b mRNA水平明显提高,TNF-ɑ和IL-6也有上升趋势,但经数据统计无显著性差异。经LL-SNase处理后,IL-1b mRNA水平得到显著抑制,TNF-ɑ和IL-6均有不同程度的下调。总的来说,SNase能从mRNA水平上改善TNBS结肠炎小鼠结肠组织的炎性水平。
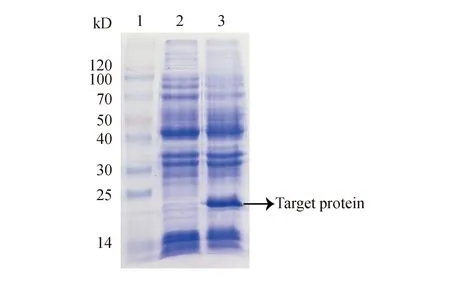
Figure2 12% SDS-PAGE analysis of SNase induced by nisin inL.lactispCYT:SNase
Lane 1:Protein marker;Lane 2:Supernant of the lysate ofL.lactispCYT:SNase;Lane 3:Supernant of the lysate ofL.lactispCYT:SNase induced by nisin (50 ng/mL)
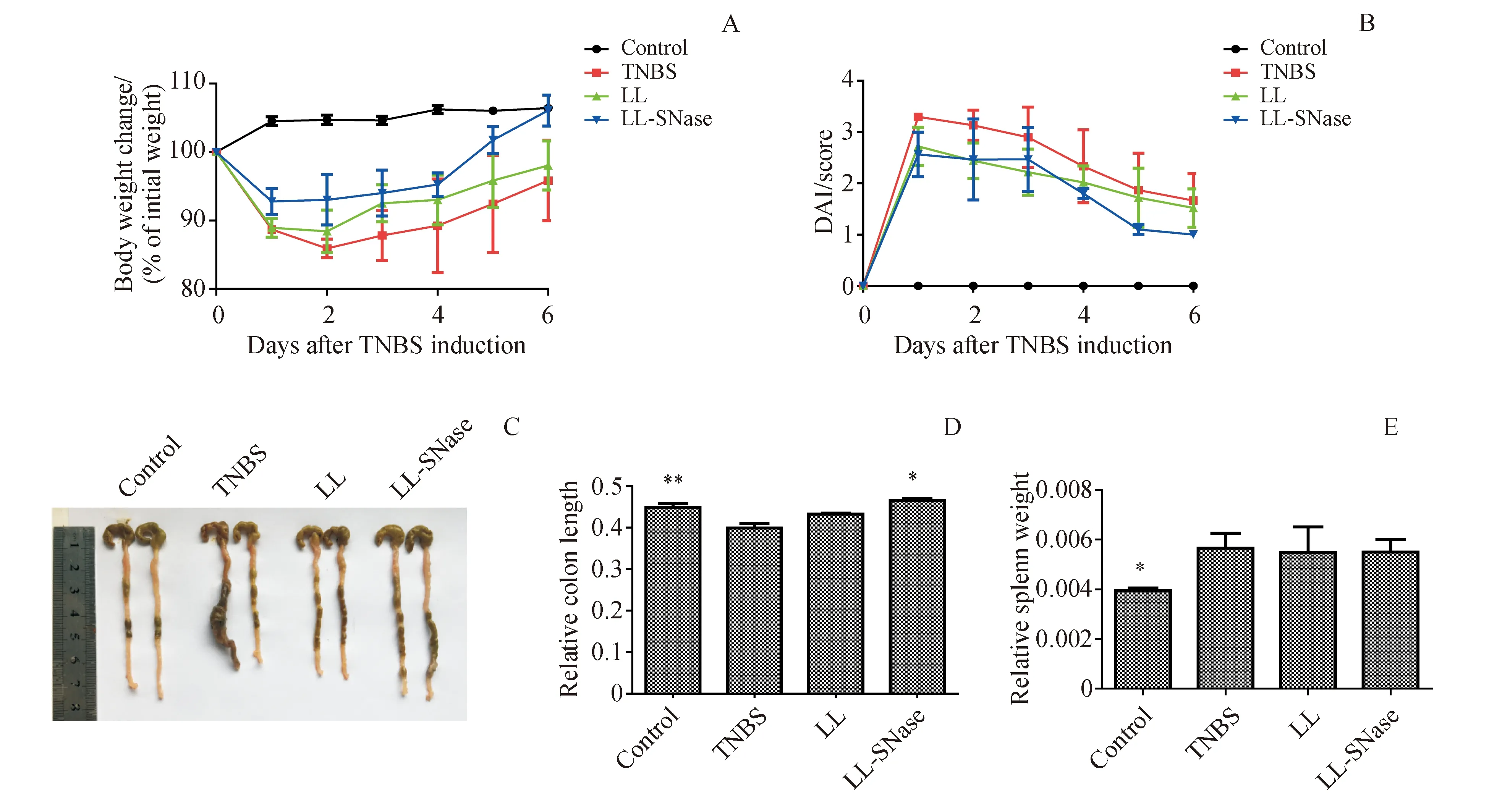
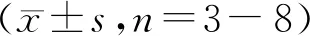
A:Body weight changes;B:Disease activity index (DAI) scores;C:Images of colon;D:Relative colon lengths;E:Relative spleen weights LL:TNBS+NZ9000;LL-SNase:TNBS+L.lactispCYT:SNase
*P<0.05,**P<0.01vsTNBS group
A:Histological micro-photographs of hematoxylin/eosin-stained sections of distal colon (×200);B:Histological scores for histological change
*P<0.05,***P<0.001vsTNBS group
3.3 SNase改善结肠炎小鼠体内炎性因子水平
本研究对各组血清中与炎症相关的细胞因子水平进行含量测定。如图6所示,TNBS诱导的小鼠血清促炎细胞因子IL-6水平显著提高,抑炎细胞因子IL-10显著下降,TNF-ɑ、IL-1β、IL-17A和IFN-γ水平均有上升趋势,但数据分析无显著性差异。而LL-SNase处理能显著上调TNBS结肠炎小鼠的抑炎细胞因子IL-10水平,不同程度下调促炎细胞因子水平。由此可以看出,SNase能改善小鼠体内的炎症水平。
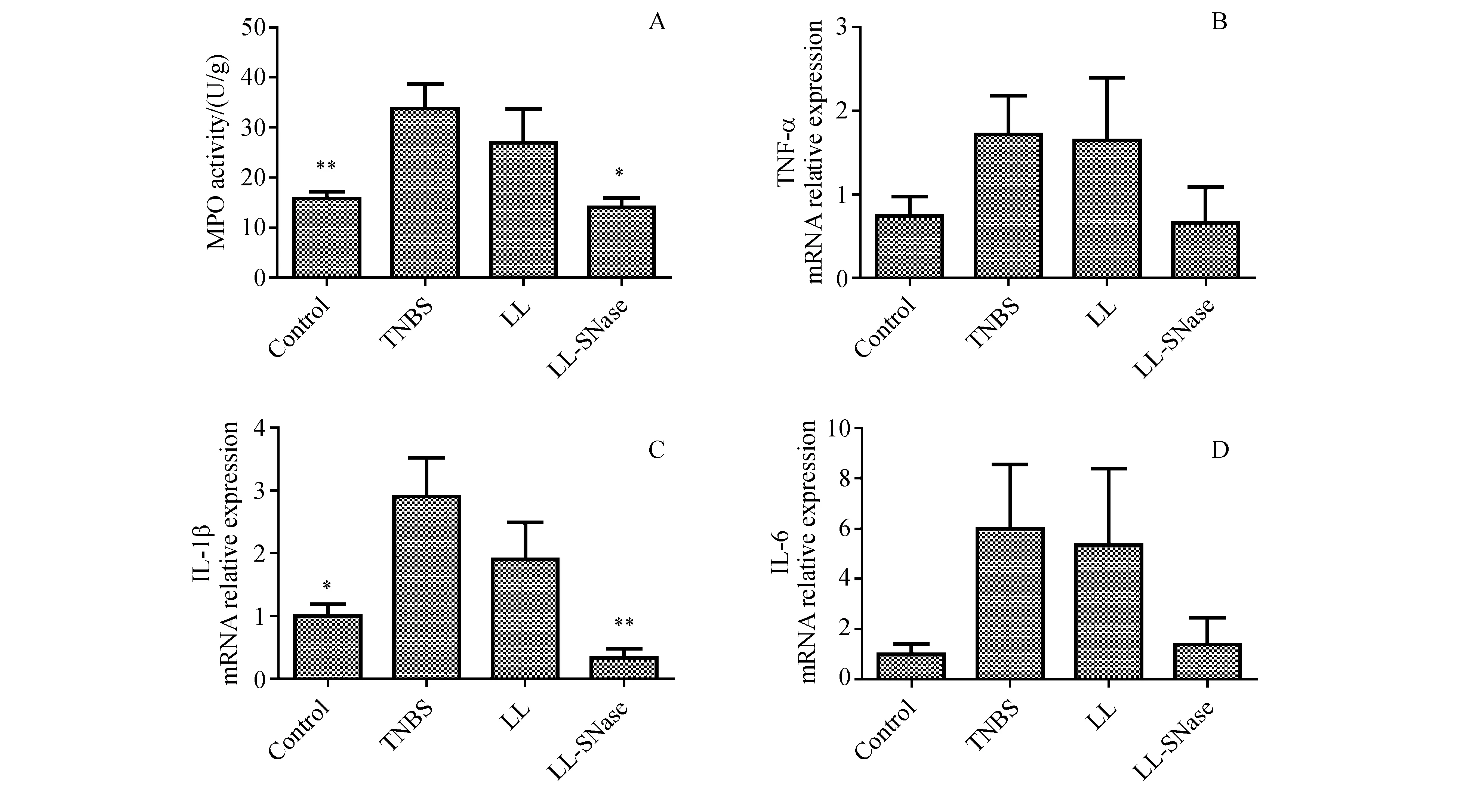
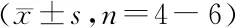
A:Activity of myeloperaxidase (MPO) enzyme in colon;B:Relative mRNA expression level of TNF-ɑ;C:Relative mRNA expression level of IL-1β;D:Relative mRNA expression level of IL-6
*P<0.05,**P<0.01vsTNBS group
A:TNF-ɑ;B:IL-1β;C:IL-6;D:IL-17A;E:IFN-γ;F:IL-10
*P<0.05vsTNBS group
3.4 SNase能够减少TNBS诱导小鼠结肠组织中NETs水平标志物含量
为了探究SNase靶向肠道是否可以抑制肠道NETs形成,本研究对各组结肠组织NETs水平标志物表达进行评估,通过免疫组化染色检测结肠组织中NETs水平标志物citH3和中性粒细胞标记分子Ly6G表达。如图7所示,TNBS组中Ly6G和citH3 含量明显高于健康对照组,提示TNBS组小鼠体内存在更显著的NETs水平,而LL-SNase处理均能够显著下调TNBS小鼠结肠组织Ly6G和 citH3 含量。此外,MPO也是NETs水平的一个重要标志物,LL-SNase给药处理也大大降低了其在TNBS小鼠结肠组织MPO酶的活性(图5-A)。结果表明,SNase经口给药可以减少TNBS诱导小鼠结肠组织中NETs水平标志物含量,抑制肠道NETs形成。
A:Representative immunohistochemical images showing Ly6G-positive cell and citH3-positive cell in colon section (×200);B:Percentages of Ly6G-positive cell and citH3-positive cell in colon section
**P<0.01vsTNBS group
4 讨 论
炎症性肠病是一种病因不明的慢性肠道炎症疾病,包括溃疡性结肠炎和克罗恩病。这两种疾病类型临床诊断、发病部位及致病机制有所不同。克罗恩病在整个胃肠道均可发病,多见于结肠部位,伴有肠道狭窄症状,主要是由Th1细胞引起的免疫反应[17]。TNBS诱导的结肠炎与临床上克罗恩病的病症表现相似,可用来研究克罗恩病的发病机制[18]。越来越多的证据表明NETs形成参与炎症性肠病的致病形成,尽管部分研究表明NETs成分在溃疡性结肠炎患者中检测要比克罗恩病患者更为显著。不可否认的是,确有多项研究表明NETs形成与克罗恩病相关。在克罗恩病患者粪便、血清和活检组织中确实可检测到NETs主要成分,包括citH3,NE,MPO等[19-22]。Cl-amidine是PAD4酶抑制剂,能抑制NETs的前期形成,Chumanevich等[23]发现腹腔注射Cl-amidine能够缓解葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎。由此看出,干预NETs降解是IBD治疗的一个方向。
为探究SNase降解NETs对小鼠结肠炎的影响,同时为了让SNase直接靶向到肠道而发挥作用,本研究选择重组乳酸菌作为递呈载体。结果发现,乳酸菌递呈的SNase能缓解TNBS造模小鼠体质量下降,降低DAI评分,增加结肠长度以及减轻结肠组织病理损伤。MPO酶作为中性粒细胞特异性表达的酶,其活力水平可以反应组织中性粒细胞浸润情况。TNF-ɑ、IL-1β、IL-6等炎性细胞因子上调是结肠炎炎症的显著表现。通过表达SNase的重组乳酸菌LL-SNase灌胃给药,结果表明SNase能下调结肠组织MPO酶活水平以及TNF-ɑ、IL-1β、IL-6炎性细胞因子转录水平。进一步利用免疫组化检测结肠组织NETs水平标志物citH3水平,结果发现,TNBS模型组citH3含量明显上调,提示结肠炎中NETs形成活跃,经LL-SNase处理后,中性粒细胞浸润以及citH3含量明显下调,而乳酸菌NZ9000也能改善NETs相关指标,可能因为乳酸菌本身作为益生菌,可以调节肠道微生态从而抑制NETs形成。本研究结果初步表明,SNase能通过抑制NETs形成从而缓解小鼠结肠炎症。
虽然本项研究存在一些不足,例如:TNBS造模病死率偏高,导致样本较少,在统计学分析时部分指标只出现差异趋势,未能得到理想的显著性差异结果。但是,实验结果依然可以初步显示NETs参与克罗恩病小鼠的疾病发展,本研究通过SNase处理,靶向NETs降解可以缓解TNBS诱导的小鼠结肠炎,保护结肠组织结构,缓解炎性浸润下调促炎细胞因子和上调抑炎细胞因子等。后续本课题组将增加实验动物数量,继续深入探究SNase对TNBS造模小鼠结肠炎症影响的机制。总的来说,SNase靶向NETs降解是克罗恩病的一个治疗方向,其具体机制还需进一步探索。

