PNU-282987对大鼠脑缺血再灌注损伤后神经元凋亡和学习记忆能力的影响
李晓敏,樊文香
(东南大学附属中大医院药学部,南京 210009)
缺血性脑血管病是危害人类生命与健康的常见病和多发病,具有发病率高、病死率高、复发率高和致残率高的“四高”特点。在急性脑血管病中,缺血性脑卒中约占脑卒中总数的85%[1]。近年来,α7 nAChR在心肌缺血/再灌注损伤、脑卒中、动脉粥样硬化和高血压等心血管系统疾病中均有研究,且激活α7 nAChR可抑制神经元细胞凋亡,促进神经细胞的存活[2-5]。但对于脑缺血再灌注损伤中α7 nAChR的作用却鲜有报道。PNU-282987已被证明是α7nAChR的一种有效激动剂,与其他nAChR亚型的相互作用可以忽略不计,是目前合成的最特异的α7nAChR激动剂。因此,本研究选择PNU-282987作为研究对象,通过研究其在大鼠脑缺血再灌注损伤中的作用和可能机制,进一步阐述α7 nAChR在脑缺血再灌注损伤中的影响。
1 材 料
1.1 药品与试剂
PNU-282987(美国MedChemexpress公司);水合氯醛(国药集团化学试剂有限公司);多聚甲醛(上海凌峰化学试剂有限公司);红四氮唑(TTC,中国Biosharp公司);甲醛溶液(西陇化工股份有限公司)。
1.2 仪 器
MG-3迷宫刺激器(张家港市教学实验器械厂);BS 224S型电子天平(北京赛多利斯仪器系统有限公司)。
1.3 动 物
SD大鼠44只,雄性,体质量250~280 g,由上海杰思捷实验动物有限公司提供,生产许可证号:SCXK(沪)2013-0006,所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 大鼠局灶性脑缺血再灌注损伤(MCAO/R)模型的建立
SD大鼠40只,随机分为4组,每组11只,分别为假手术组、模型对照组,PNU-282987低剂量(1.2 mg/kg)和PNU-282987高剂量(2.4 mg/kg)治疗组。各组大鼠在造模手术前24 h禁食不禁水。手术过程参照Longa[6]方法:大鼠用3%水合氯醛300 mg/kg(1 mL/100 g)麻醉,分离右侧颈外动脉(ECA)、颈内动脉(ICA)、颈总动脉(CCA)、枕动脉(OA)、甲状腺上动脉((STA)。结扎并剪断OA及STA。结扎ECA远心端。于ECA主干切口向ICA入颅方向插入尼龙线(长40 mm,直径0.26 mm)。插入深度以距CCA分叉处(18±0.5)mm为宜,可感到明显的阻力及尼龙线的弯曲和牵张,此时达到大脑前动脉内,阻断了大脑中动脉(middle cerebral artery,MCA)供血来源。记录缺血时间,扎紧ECA根部,缺血90 min后拔出尼龙线,为再灌注开始。假手术组仅做钝性分离,不闭塞MCA。术后治疗组分别腹腔注射PNU-282987(1.2 mg/kg或2.4 mg/kg),假手术组和模型对照组大鼠腹腔注射相应量的生理盐水,每天给药1次,连续给药3 d。
2.2 Y-迷宫实验
给药第2天30 min后对大鼠进行Y-迷宫实验。将受试大鼠放入Y型电迷宫内适应环境3 min,然后给大鼠以电刺激,设定电击电压50 V,延迟时间2 s。改变电击区和安全区,大鼠遭遇电击时直接逃避至安全区为正确反应,否则为错误反应。每10次电击后休息5 min。学习评分以达到连续10次电击中有9次正确反应(9/10正确反应)前所受的累计电击次数来表示。24 h后测定连续10次电击中正确反应次数,作为记忆评分[7]。
2.3 神经功能学评分、脑梗死面积和脑含水量的测定
给药第3天30 min后对动物的神经功能缺陷进行分级评分并记录,标准如下[6]。0分:未观察到神经症状;1分:提尾悬空时,动物的手术对侧前肢表现为腕肘屈曲,肩内旋,肘外展,紧贴胸壁;2分:将动物置于光滑平面上,推手术侧肩向对侧移动时,阻力降低;3分:动物自由行走时向手术对侧环转或转圈;4分;软瘫,肢体无自发活动。
神经功能评分结束后,前8只大鼠脱颈椎处死,迅速取出全脑,用镊子去除小脑、嗅球和低位脑干。将大脑迅速置于-20 ℃冰箱中冷冻15~0 min,至大鼠脑变硬时,用锋利的刀片在视交叉及其前后各2 mm处,做冠状切5刀,将脑组织切成5片,迅速将切好的脑片置于含有1%TTC的PBS缓冲溶液约4 mL中(过程中要避光),避光温孵15 min。15 min后轻轻取出脑片,按顺序排列好,擦干脑片周围的水分,用数码相机对染好的脑片进行拍照。数码照片使用Image-Pro Plus图像分析软件进行分析,计算梗死百分比[8]的公式:梗死百分比(%)=梗死部分面积/全脑面积×100。
用数码相机对脑片进行拍照后,称取大脑湿重并记录。将称重后的脑组织放入110 ℃烘箱里进行烘干(12 h),达到恒重后称取脑组织干重并记录,计算脑含水量百分比[9]。
2.4 HE和TUNEL染色
神经功能评分结束后,每组后3只大鼠脱颈椎处死,迅速取出全脑,将脑组织浸入10%福尔马林溶液中固定并制备石蜡切片。对蜡块进行常规切片5 μm,再进行脱蜡处理。脱蜡结束后用苏木精染料染色5~6 min,染色结束后用流水冲洗返蓝。接着进行脱水、透明,之后进行中性树脂封片。最后显微镜下进行阅片,拍照。染色后细胞核呈蓝色,胞浆呈红色,其他成分呈深浅不同红色。观察大脑皮质区细胞形态学改变,根据病变程度分别记为0分,1分,2分,3分,4分[10]。
脑组织的石蜡切片进行脱蜡处理后,根据试剂盒说明书,用末端脱氧核苷酸转移酶介导dUTP缺口末端标记(TUNEL)法进行染色。经过常规的脱水、透明、封片后,用显微镜进行观察、拍照。染色后阳性细胞呈现棕黄色,细胞浆呈现紫蓝色。拍好的照片使用Image-Pro Plus图像分析软件分析数据。
2.5 统计学方法
3 结 果
3.1 PNU-282987降低缺血再灌注后大鼠脑梗死面积
由表1可见,脑缺血再灌注后,缺血大鼠连续给药3 d,末次给药后脱颈椎处死并经TTC染色,结果显示假手术组未见明显的梗死区,模型对照组则出现显著的梗死区。与模型对照组比较,PNU-282987高剂量组可以显著降低大鼠脑梗死面积(P<0.01),PNU-282987低剂量组也可以显著降低大鼠脑梗死面积(P<0.05)。
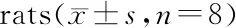

GroupDose/(mg/kg)Infarct size/%Sham--Model-34.43±4.31##PNU-2829872.420.35±5.17∗∗PNU-2829871.229.09±4.56∗
##P<0.01vssham group;**P<0.01,*P<0.05vsmodel group
3.2 PNU-282987降低缺血再灌注后大鼠神经功能评分及脑含水量
由表2可见,脑缺血再灌注后,与假手术组比较,模型对照组大鼠的神经功能评分和脑含水量均显著上升(P<0.01),提示造模成功。与模型对照组比较,PNU-282987治疗组可显著降低大鼠神经功能评分(P<0.01,P<0.05),PNU-282987高剂量组可显著降低缺血大鼠脑含水量(P<0.01)。
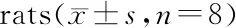
GroupDose/(mg/kg)Neurological deficit scoresBrain edema/%Sham--77.19±2.01Model-2.75±0.46##81.61±1.84##PNU-2829872.41.75±0.46∗∗78.69±1.65∗∗PNU-2829871.22.13±0.64∗79.90±2.20
##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group
3.3 PNU-282987改善缺血再灌注后大鼠脑组织病理学损伤
脑缺血再灌注后,假手术组大脑组织结构正常,细胞排列整齐,轮廓清楚,神经元未见坏死;模型对照组组织结构不清,排列紊乱,见严重坏死;PNU-282987治疗后,神经元的形态得到改善(图1-A)。对病理图片进行评分,结果显示,与假手术组比较,模型组脑缺血病变评分显著增高(P<0.01)。与模型组比较,PNU-282987治疗组脑缺血病变评分降低,且PNU-282987高剂量组具有显著性(P<0.01)(图1-B)。
3.4 PNU-282987抑制缺血再灌注后神经元凋亡
由图2可见,脑缺血再灌注后,与假手术组比较,模型组大鼠凋亡神经元的数量显著增加(P<0.01)。与模型对照组比较,PNU-282987治疗组大鼠脑组织中凋亡神经元的数量均显著性降低(P<0.01)。
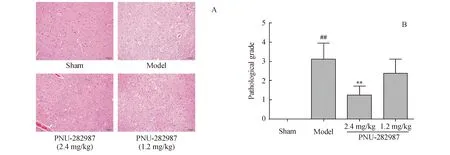
Figure1 Effects of PNU-282987 on neuronal injury in the ischemic cerebral cortex of rats
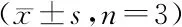
##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group
Figure2Effects of PNU-282987 on neuronal apoptosis in the ischemic cerebral cortex of rats
##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group
3.5 PNU-282987提高缺血再灌注后大鼠空间学习记忆能力
脑缺血再灌注后,采用Y-电迷宫对大鼠进行空间学习记忆能力的检测。结果显示,与假手术组比较,模型对照组大鼠的学习能力和记忆能力均有所下降,且具有显著性(P<0.01)。与模型对照组比较,PNU-282987治疗组大鼠的学习和记忆能力均不同程度提高,且PNU-282987高剂量组具有显著性(P<0.01)。结果提示,PNU-282987可提高缺血大鼠的空间学习记忆能力。结果见表3。
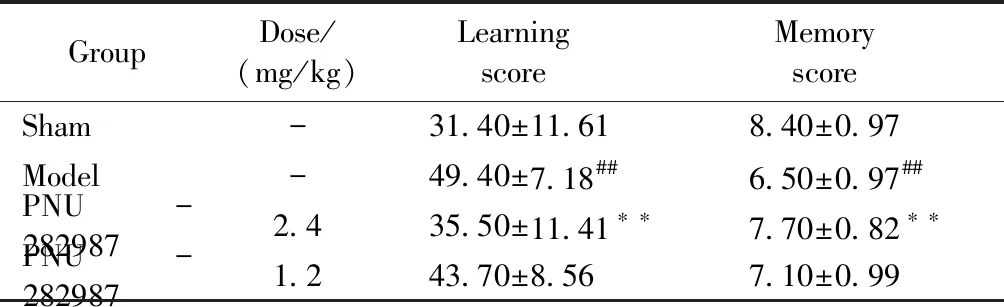
GroupDose/(mg/kg)Learning score Memory scoreSham-31.40±11.618.40±0.97Model-49.40±7.18##6.50±0.97##PNU-2829872.435.50±11.41∗∗7.70±0.82∗∗PNU-2829871.243.70±8.567.10±0.99
##P<0.01vssham group,**P<0.01vsmodel group
4 讨 论
本实验采用经典的线栓法制备大脑中动脉闭塞(MCAO)模型来研究PNU-282987在大鼠脑缺血再灌注损伤中的作用。MCAO模型是脑缺血再灌注损伤研究中的经典模型,能够高度模拟人脑的缺血过程[11]。实验结果显示,模型组大鼠脑梗死面积、神经功能评分和脑含水量较假手术组均显著性增高,模型组大鼠表现出明显的神经功能损伤,表明造模成功。病理检查发现缺血大鼠大脑皮质区出现明显的病理损伤,主要表现为组织结构不清,排列紊乱,严重坏死;TUNEL法检测神经元凋亡情况,发现缺血大鼠大脑皮质区神经元凋亡数量增加。有文献报道,脑缺血再灌注后引起神经元凋亡,而神经元与学习记忆功能密切相关,神经元的损伤会引起患者认知功能障碍,从而影响患者生活质量[12-14]。因此,接下来对缺血大鼠进行了Y-电迷宫实验。在实验中,发现模型组大鼠第1天训练时达到(9/10正确反应)结果前所受的累计电击次数明显增加,而第2天连续10次电击中正确反应次数明显减少,表明缺血大鼠的学习记忆能力受到影响。以上结果提示,脑缺血再灌注损伤后,大脑神经元凋亡增加,引起神经功能损伤,造成学习记忆能力下降。
以前的研究报道显示,α7 nAChR的激活可防止神经元死亡或凋亡[15-16]。因此,本实验选用α7 nAChR激动剂PNU-282987来研究其对脑缺血再灌注损伤大鼠的作用。实验结果显示,连续灌胃给药3天后,与模型组比较,PNU-282987高、低剂量组均对脑缺血再灌注损伤具有良好的保护作用,尤其是PNU-282987高剂量组可显著性改善脑缺血再灌注损伤后的神经功能损伤、脑梗死面积和脑含水量以及脑组织病理组织学损伤,降低神经元凋亡数量,还可以显著性的提高缺血大鼠的空间学习记忆能力,改善缺血大鼠的认知功能障碍。各项结果显示,PNU-282987能够治疗脑缺血再灌注损伤所致神经元凋亡,降低脑梗死率,减轻脑细胞病理损伤,改善神经功能,提高缺血大鼠的学习记忆能力,PNU-282987对脑缺血再灌注损伤具有神经保护作用。PNU-282987对脑缺血再灌注损伤的神经保护作用可能与抑制缺血后神经元凋亡有关。

