原发性门静脉、肠系膜静脉广泛血栓伴发小肠梗阻1例治疗体会
包海波,邵 雪,孔晓露,郭 梦,李东复
吉林大学第二医院肝胆胰内科,吉林 长春 130000
病例患者,男,67岁,因“腹痛3 d,加重伴恶心、呕吐5 h”于2017年8月27日入院。该患者入院3 d前无明显诱因出现腹痛,以左下腹为著,呈持续性胀痛,无放散痛,与进食及体位无明显关系,余无明显不适。5 h前开始腹痛加重,全腹均有疼痛,呈持续性剧痛,无放散痛,伴恶心、呕吐,呕吐物为胃内容物,未见咖啡样物、血块及鲜血等,呕吐后腹痛无缓解,无腹胀,无反酸、嗳气,无呕血、黑便,有乏力、大汗,为求进一步诊治就诊于我院。既往:22年前因“阑尾炎”行“阑尾切除术”。17年前因左下肢静脉曲张行手术治疗(具体不详)。6年前行冠脉造影检查示心肌桥,后服用阿司匹林治疗,现已停药2年。3年前因右上腹疼痛诊断为慢性胆囊入院治疗14 d,临床治愈出院。此次入院查体:一般状态欠佳,急性病面容,被动体位,呼吸平稳,全身皮肤及黏膜苍白湿冷;腹平坦,右下腹可见一斜形10 cm手术瘢痕,未见胃型及胃肠蠕动波,未见腹壁静脉曲张;腹壁柔软,全腹压痛,无反跳痛及肌紧张,墨菲征阴性,肝脾肋下未触及;移动性浊音阴性,肝区叩击痛阴性,肠鸣音6次/min。入院后辅助检查,血常规:WBC 11.3×109L-1,NEUT% 75.9%。凝血常规:PT 13.7 s,APTT 29.8 s,D-二聚体 17.48 μg/ml。肝功:TBil 25.80 μmol/L,DBil 8.40 μmol/L,IBil 11.6 μmol/L,Alb 39.8 g/L,ALT 14 U/L,AST 18 U/L,ALP 69 U/L,GGT 62 U/L。心电图正常。立位腹平片未见异常。主动脉CTA未见异常。全腹CT平扫+增强示:门静脉、脾静脉及肠系膜上静脉可见条状充盈缺损,考虑静脉血栓可能性大(见图1)。经院腹部外科、血管外科等多学科会诊初步诊断:门静脉血栓、肠系膜静脉血栓(mesenteric venous thrombosis,MVT)、脾静脉血栓。立即给予抗凝(低分子肝素钙,4 100.00 AXa IU)、抗感染、解痉、补液、改善循环等对症及支持治疗,经上述观察治疗,腹痛未见明显缓解,入院第5天出现暗红色血便50 ml,查体:全腹压痛,无反跳痛及肌紧张,急检便常规+潜血示阳性,复查全腹CT提示升结肠局部管壁出血坏死改变,考虑患者病情继续加重,内科抗凝治疗效果不佳,转入血管外科进一步治疗,经进一步评估患者病情,给予经肠系膜动脉置管间接溶栓术治疗约2周,患者腹痛症状逐步缓解,此后患者病情稳定出院,持续口服利伐沙班(20 mg,1次/d)维持巩固治疗。直至2017年11月患者因饮食不当出现腹痛,进食后加重,伴恶心、呕吐,伴腹泻、水样便,约10次/d,上述症状呈周期性发作,曾去南方疗养及治疗,症状未见好转, 于2018年6月18日为进一步明确诊断与治疗再次入我院,入院查体:腹部可见胃型及胃肠蠕动波,全腹压痛,行腹部X线示肠梗阻(见图2);全消化道造影示小肠不全梗阻;复查全腹CT平扫+增强未见明显新发生的条状充盈缺损,排除门脉、肠系膜血栓再次发生。给予禁食水、止泻补液、通便、康复理疗等对症及支持治疗,症状可明显缓解,但治疗期间腹痛,进食后加重,伴恶心、呕吐、腹泻,水样便等可再次出现,行胃肠镜检查示慢性浅表性胃炎、慢性结肠炎、直肠多发息肉,无明显食管胃底静脉显露。经多学科会诊及与患者家属沟通,转入腹部外科行腹腔镜下剖腹探查术,术中距回盲部约140 cm处小肠与乙状结肠系膜粘连,局部形成束带与盆腔粘连,近端小肠肠管扩张,肠壁水肿,蠕动较差,行肠粘连松解+小肠部分切除术,术中切除小肠40 cm,并送病理检查,观察近段、远段小肠两断端血运均良好,关腹,术毕。病理结果:小肠黏膜急、慢性炎伴肠壁全层充血、出血及坏死。结合临床符合小肠不完全梗阻后病理改变。两侧切缘未见病变。肠周淋巴结反应性增生(0/4)。术后规律随访,至今小肠不完全梗阻已根治,患者一般状态良好。

图1 全腹CT增强 A:门静脉右支血栓;B:门静脉左支血栓;C:肠系膜上静脉血栓;D:脾静脉血栓Fig 1 Whole abdominal CT enhancement A: thrombus of right branch of portal vein; B: thrombus of left branch of portal vein; C: superior mesenteric venous thrombosis; D: splenic vein thrombosis
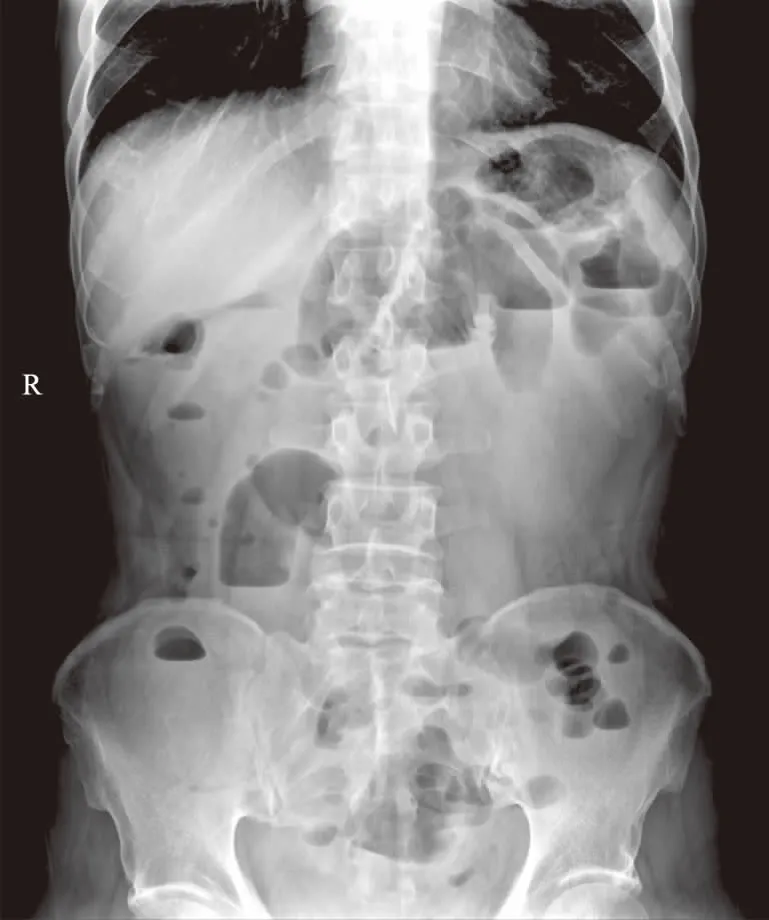
图2 腹部X线:可见气液平Fig 2 Abdominal X-ray: visible gas-liquid level
讨论MVT形成是一种临床较少见的潜在致命的肠系膜缺血性疾病,通常合并门静脉和(或)脾静脉血栓形成。 MVT 形成占肠系膜缺血性疾病的5%~15%[1],主要累及肠系膜上静脉。MVT初期缺乏特征性的临床表现,易误诊,延误治疗,病情危重,死亡率较高。尽早做出正确诊断和及时抗凝溶栓及选择合适的手术时机与手术方式,是该病治疗的关键。根据其形成原因,可分为原发性和继发性两类,临床上以继发性 MVT 多见,原发性MVT占20%~25%[2]。原发性 MVT 与先天性凝血功能障碍有关,包括真性红细胞增多症、抗凝血酶Ⅲ缺乏、纤溶酶原激活因子缺乏、蛋白C和蛋白S缺乏、凝血因子 G20212 基因和Ⅴ因子 Leiden基因突变等,另外有许多患者未发现上述异常。继发性MVT 则与获得性凝血功能障碍有关,其常见因素包括腹腔炎症(如急性胰腺炎、阑尾炎、炎症性肠病等)、肝硬化及门静脉高压、肿瘤、腹部创伤、脾切除术、长期口服避孕药、骨髓异常增生综合征、血吸虫病、腹腔镜减肥手术等[3]。该患者虽未行骨髓穿刺检查,但给予积极治疗后未再反复血栓形成,未发现存在明显的诱因,因此可诊断为原发性 MVT。
MVT 形成发病较为隐匿,常表现为一些非特异性胃肠道前驱症状,如恶心、呕吐、腹痛、腹胀、便血等。腹痛可为较早的症状,多为局限性, 少数为全腹弥漫性。腹痛呈间歇性, 但不剧烈。腹部无明显阳性体征。病情进展迅速,突然出现剧烈腹痛,呈持续性,但定位不明确,具有临床症状与体征不符的特点。当出现腹膜炎刺激征和/或便血时,既往考虑出现肠坏死,立即外科手术探查,但很多急性MVT患者肠管可能此时并未发生透壁性梗死,肠管缺血状态是可逆的[4],对于这部分患者,过早手术可能导致短肠综合征等不必要的创伤。值得注意的是,对于急性 MVT 患者,便血的原因多为缺血坏死的肠黏膜层脱落导致,可表现为粪隐血试验阳性、鲜血便或暗红色血便,此时可能仍未发生肠管透壁性梗死[5]。但在临床上,尚应高度警惕出现肠坏死的可能,综合判断患者病情,给予合适的治疗方式。
实验室检查对于MVT的诊断无特殊临床意义,血浆D-二聚体的检测对提示血栓存在虽然不具有特异性,但D-二聚体迅速升高,同时结合患者腹部症状与体征,可高度怀疑MVT 的存在,D-二聚体在正常范围常能排除MVT 形成,其准确率为98%[6]。诊断该疾病主要依靠影像学检查,腹部CT是诊断MVT的重要检查手段,特别是增强CT,其确诊率为90%以上[7],CT 上可表现为肠系膜上静脉内充盈缺损或无血流强化的低密度影填充。超声检查操作简便,经济无创,重复性好,可评价肠系膜静脉及门静脉内血流变化情况及判断血栓累及的范围,可作为该病的首选筛查方法[8],对 MVT 诊断的阳性率为 50%~80%,但易受到肠腔内气体干扰及超声医师的个人操作经验的影响[3]。尽管如此,超声在监控MVT治疗后门静脉高压的长期并发症的复发和随访中发挥着重要作用。血管造影虽然是诊断血管病变的“金标准”,但由于其检查过程中有创,且造影途径受限,技术设备要求较高,操作繁杂,一般不作为诊断MVT的首选检查,且一经应用,一般同时行置管抗凝溶栓,故在临床上一般不作为首选检查手段[9]。
当MVT形成确诊之后,立即给予抗凝治疗是一线治疗方案,应用抗凝药物可在短期内避免血栓蔓延,促进血栓再通,使部分或全部病变肠管血运恢复正常,防止血栓复发,临床安全性高。在MVT形成的早期阶段应用抗凝药物,其再通率为80%以上,而非抗凝治疗再通比例低于 10%[10]。对于有高凝状态的患者需长期进行抗凝治疗,同时警惕出血风险。介入治疗是 MVT 重要的治疗方法之一,包括经肠系膜上动脉置管间接溶栓术、经皮经肝穿刺门静脉途径置管溶栓术、经颈静脉肝内门体分流(TIPS)途径溶栓术[11]。介入溶栓治疗不仅可促进血管再通,恢复肠道血供,而且能够促进侧支循环建立,最大限度地挽救剩余肠管,减少短肠综合征及吻合口相关并发症的发生[12]。
小结与体会:(1)本病例特点:病史冗长,患病突然,无明显诱发因素,发生MVT广泛,同时合并门静脉与脾静脉血栓,病情凶险,死亡发生率高。临床过程复杂,但符合突然出现剧烈腹痛,呈持续性,定位不明确,具有临床症状重与体征不符的特点。(2)经历治疗过程复杂:根据临床病情进展不同阶段,分别采用了内科溶栓治疗;介入科行肠系膜上动脉置管间接溶栓治疗;腹部外科行腹腔镜下剖腹探查,肠粘连松解+小肠部分切除术等治疗。(3)伴发小肠梗阻:门脉血栓病情缓解后间隔一段时间逐步形成,临床表现呈慢性进行性加重并周期性发生,这与急性期血栓形成造成的小肠缺血炎性渗出粘连及术后证实小肠黏膜急、慢性炎伴肠壁全层充血、出血及坏死,小肠不完全梗阻后病理改变相关。

