IL-12/IL-23拮抗剂治疗炎症性肠病有效性及安全性的Meta分析
闫欢欢,党小红
1.山西医科大学第一临床医学院,山西 太原 030001;2.山西医科大学第一医院消化科
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),是一种影响胃肠道的慢性复发-缓解型炎症性疾病。由于这种慢性疾病的进行性,往往需要终身治疗。肿瘤坏死因子(tumor necrosis factor,TNF)拮抗剂一直是治疗中-重度IBD的主要药物。然而,多达1/3的患者不会对最初的TNF拮抗剂产生反应(原发性无反应者),而那些有反应的患者中,高达40%的患者最终会失去反应(继发性无反应者)[1]。此外,TNF拮抗剂的治疗与罕见但严重的不良反应有关,包括脱髓鞘综合征、自相矛盾的自身免疫反应、严重感染、恶性肿瘤等[2-6]。因此,对IBD患者既安全又有效的替代医学疗法的需求越来越大。近年来,随着对IBD病理生理学认识的加深,新的治疗靶点不断涌现,包括IL-12和IL-23。适应性免疫在IBD的发病机制中起着重要作用,辅助性T淋巴细胞是产生细胞因子的淋巴细胞,通过与巨噬细胞、CD8+T细胞、嗜酸性粒细胞和嗜碱性粒细胞等免疫细胞相互作用调节免疫反应。不同的细胞因子环境可诱导TH1、TH2、TH17或调节性T细胞亚群。异二聚体促炎细胞因子IL-12和IL-23分别诱导TH1和TH17细胞应答,从而导致炎症因子上调,造成胃肠道黏膜炎症。IL-12由p40和p35亚基组成,刺激JAK2和TYK2活性,IL-23由p40和p19亚基组成,激活JAK/STAT通路[7]。因此,在全基因组关联研究中,IL-12/IL-23靶点被认为是IBD发病机制中的一个重要参与者。同时,IL-12/23拮抗剂在减少感染和降低恶性肿瘤的风险方面优于TNF拮抗剂。而且,由于免疫原性低,使用该类药物时可能不需要同时进行免疫抑制,故安全性可能更大[8]。现如今,IL-12/IL-23拮抗剂治疗IBD的二期及三期临床试验开展得如火如荼,本文根据循证医学的方法,对IL-12/IL-23拮抗剂治疗中-重度活动性IBD的临床疗效及不良反应进行Meta分析。
1 资料与方法
1.1 文献检索以“IBD及自由词和IL-12/IL-23拮抗剂及自由词”为检索策略,通过PubMed、EmBase、Cochrane Library、中国知网、万方、维普等数据库检索自建库至2019年6月的相关文献,查阅灰色文献。并对Gastroenterology and Hepatology、United European Gastroenterology Week和AGA Abstracts(2016-2018年)的会议记录进行回顾,以获取相关摘要。
1.2 纳入及排除标准研究类型:IL-12/IL-23拮抗剂治疗IBD的随机双盲安慰剂对照试验。研究对象:患者均经IBD诊断治疗规范第5次共识意见确诊,为种族、性别不限的成年人。干预措施:试验组采用共识推荐药物治疗的同时加用IL-12/IL-23拮抗剂治疗,安慰剂组使用安慰剂(安慰剂的使用必须在知情同意的前提下并符合药物使用临床规范)。结局指标:临床缓解率为主要结局指标,临床反应率和治疗中不良反应发生率为次要结局指标。对于CD,使用克罗恩病活动指数(CDAI)评估临床结果[9-13]。临床反应:CDAI与基线相比下降100分。临床缓解:CDAI<150分。对于UC,使用改良的Mayo评分(MCS)评估临床结果[14-15],该评分是由排便次数、直肠出血(RBS)、医师整体评估(physician global assessment)和内镜(MCSe)4个亚评分组成的综合指标。临床反应:MCS与基线相比下降≥3分和30%,且RBS减少≥1分或RBS=0或1分。临床缓解:MCS≤2分且无亚评分>1分。
排除无安慰剂组、结局指标不同或纳入儿童、孕妇的研究,IBD合并其他严重不良疾病、试验设计不合理、提供数据资料不完整的研究及相关动物实验。
1.3 文献筛选由两位研究者交叉核对纳入研究的结果,对产生分歧的研究进行讨论或求助第3位研究者决定是否纳入。若缺乏研究相关资料尽可能联系原作者获取。
1.4 质量评价根据Cochrane协作网推荐的“偏倚风险评估”工具RevMan 5.3对纳入的文献进行质量评价,内容包括:Seqence generation(序列产生)、Allocation concealment(分配隐藏)、Blinding(盲法)、Incomplete outcome data(不完全结局资料)、Selective outcome reporting(选择性结局报告)、Other sources of bias(其他偏倚来源)。
1.5 资料提取提取数据主要包括:(1)一般资料:研究题目、作者姓名、发表年份、临床试验编号;(2)试验特点:疾病种类、试验类型及持续时间、干预药物和剂量;(3)患者特征:性别、年龄、病程、合并使用糖皮质激素、合并使用免疫抑制剂、基线CDAI分值基线、调整Mayo分值基线;(4)结局指标:临床反应率、临床缓解率、治疗过程中的不良反应率。
1.6 统计学处理采用Cochrane协作网提供的RevMan 5.3统计学软件进行Meta分析。采用相对危险度(relative risk,RR)为效应分析统计量,计数资料计算95%CI。进行异质性检验(I2值),若I2>50%即表示研究间存在异质性,采用随机效应模型及D-L法,反之则采用固定效应模型及Mantel-Haenszel法。对异质性大的结局指标进行敏感性分析,并采用Stata 14.0软件进行Egger’s检验对潜在的发表偏倚进行分析,若P>0.05提示不存在发表偏倚,反之,则存在发表偏倚。
2 结果
2.1 文献检索结果及纳入研究特征通过上述检索策略共检索到研究232篇,剔除重复研究179篇,初筛后剔除摘要不符合纳入标准的研究36篇,对剩余的17篇文献进行精筛,最终纳入符合的文献共7篇[9-15],文献筛选流程图见图1。共包括11项(9项CD,2项UC)随机双盲安慰剂对照试验,试验药物有:可同时阻断IL-12和IL-23共同的P40亚基的Ustekinumab(乌司奴单抗)、只阻断IL-23的P19亚基而不影响P40亚基的Briakinumab(贝伐珠单抗、MEDI-2070)、Risankizumab和Mirikizumab。共计活动性IBD 4 181例,包括试验组2 837例,安慰剂组1 344例。纳入研究的基本特征见表1。
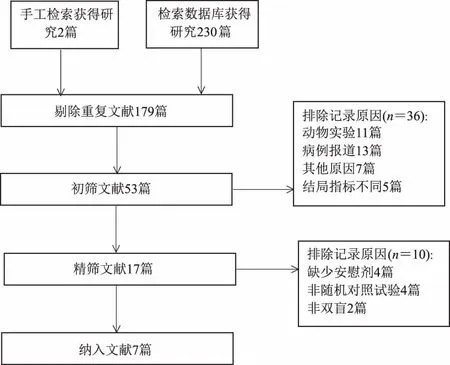
图1 文献筛选流程图Fig 1 Literature screening flow chart
2.2 纳入研究的方法学质量评价纳入的11项研究[9-15]均为随机双盲安慰剂对照试验,每项研究均提到了随机,6项研究[9-11]对随机序列的产生方式进行了详细描述,6项研究[9-11]进行了分配隐藏,所有研究均列出了本次Meta分析的主要研究指标,均无选择性报告研究结果。纳入研究的质量评价如图2所示。
2.3 临床缓解率的Meta分析结果所有纳入研究的结局指标结果如表2所示。纳入的11项研究[9-15]均提供临床缓解率,经过Revman软件进行统计学分析处理后得到各项研究间异质性较低(P=0.09,I2=38%),采用固定效应模型进行Meta分析,结果显示,试验组患者临床缓解率高于安慰剂组,差异有统计学意义(RR=1.79,95%CI:1.56~2.07,P<0.00001)(见图3)。CD试验组(RR=1.65,95%CI:1.42~1.91,P<0.00001)、UC试验组(RR=3.02,95%CI:1.94~4.76,P<0.00001)患者临床缓解率也均高于安慰剂组(见图4~5)。
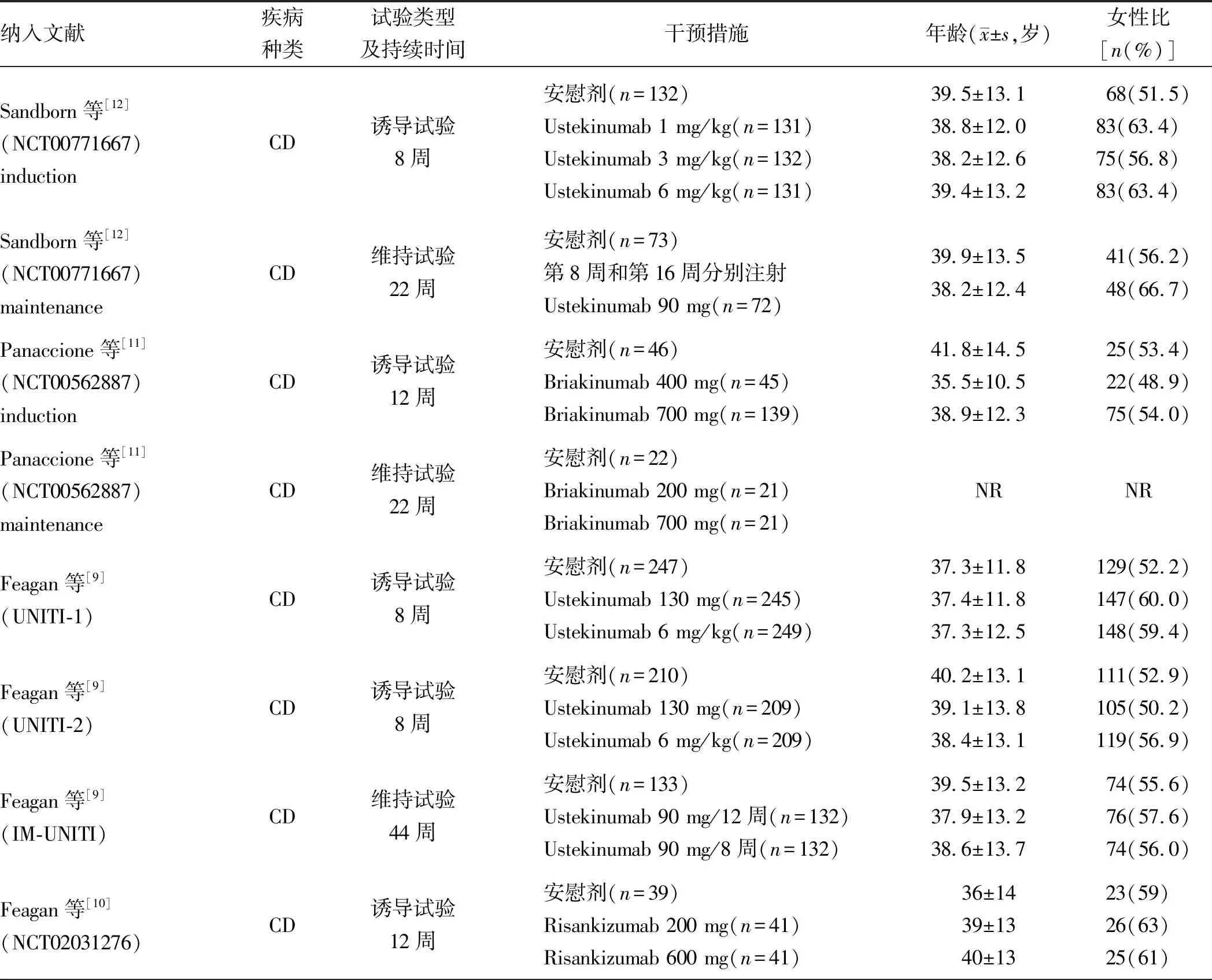
表1 纳入研究的基本特征Tab 1 The basic characteristics of the included studies
续表1
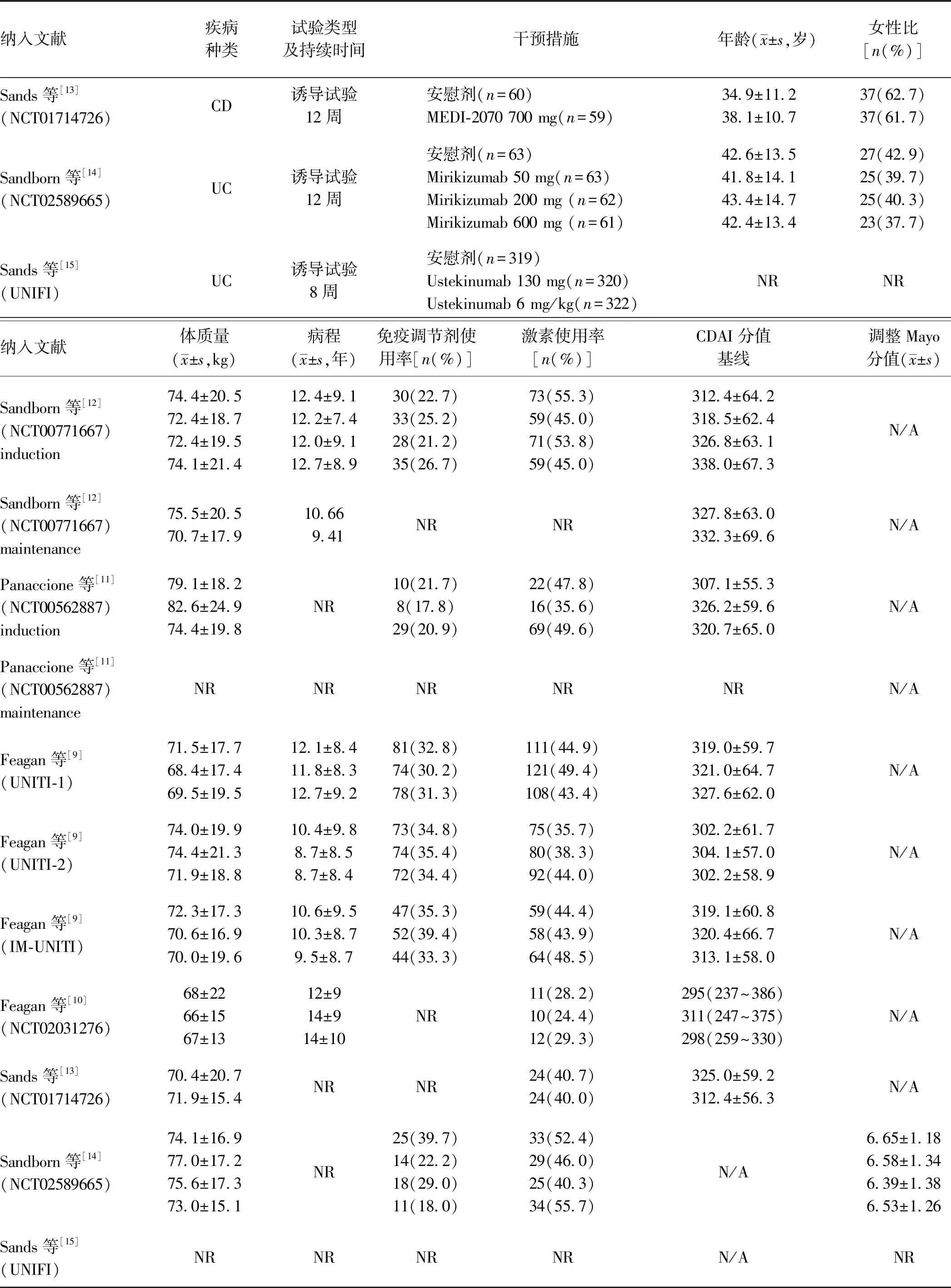
纳入文献疾病种类试验类型及持续时间干预措施年龄(x±s,岁)女性比[n(%)]Sands等[13](NCT01714726) CD诱导试验12周安慰剂(n=60)MEDI-2070 700 mg(n=59)34.9±11.2 38.1±10.7 37(62.7)37(61.7)Sandborn等[14](NCT02589665)UC诱导试验12周安慰剂(n=63)Mirikizumab 50 mg(n=63)Mirikizumab 200 mg (n=62)Mirikizumab 600 mg (n=61)42.6±13.541.8±14.143.4±14.742.4±13.427(42.9)25(39.7)25(40.3)23(37.7)Sands等[15](UNIFI)UC诱导试验8周安慰剂(n=319)Ustekinumab 130 mg(n=320)Ustekinumab 6 mg/kg(n=322)NRNR纳入文献体质量(x±s,kg)病程(x±s,年)免疫调节剂使用率[n(%)]激素使用率[n(%)]CDAI分值基线调整Mayo分值(x±s)Sandborn等[12](NCT00771667)induction74.4±20.572.4±18.772.4±19.574.1±21.412.4±9.112.2±7.412.0±9.112.7±8.930(22.7)33(25.2)28(21.2)35(26.7)73(55.3)59(45.0)71(53.8)59(45.0)312.4±64.2318.5±62.4326.8±63.1338.0±67.3N/ASandborn等[12](NCT00771667)maintenance 75.5±20.570.7±17.910.669.41NRNR327.8±63.0332.3±69.6N/APanaccione等[11](NCT00562887)induction79.1±18.282.6±24.974.4±19.8NR10(21.7)8(17.8)29(20.9)22(47.8)16(35.6)69(49.6)307.1±55.3326.2±59.6320.7±65.0N/APanaccione等[11](NCT00562887)maintenanceNRNRNRNRNRN/AFeagan等[9](UNITI-1)71.5±17.768.4±17.469.5±19.512.1±8.411.8±8.312.7±9.281(32.8)74(30.2)78(31.3)111(44.9)121(49.4)108(43.4)319.0±59.7321.0±64.7327.6±62.0N/AFeagan等[9](UNITI-2)74.0±19.974.4±21.371.9±18.810.4±9.88.7±8.58.7±8.473(34.8)74(35.4)72(34.4)75(35.7)80(38.3)92(44.0)302.2±61.7304.1±57.0302.2±58.9N/AFeagan等[9](IM-UNITI)72.3±17.370.6±16.970.0±19.610.6±9.510.3±8.79.5±8.747(35.3)52(39.4)44(33.3)59(44.4)58(43.9)64(48.5)319.1±60.8320.4±66.7313.1±58.0N/AFeagan等[10](NCT02031276)68±2266±1567±1312±914±914±10NR11(28.2)10(24.4)12(29.3)295(237~386)311(247~375)298(259~330)N/ASands等[13](NCT01714726) 70.4±20.771.9±15.4NRNR24(40.7)24(40.0)325.0±59.2312.4±56.3N/ASandborn等[14](NCT02589665)74.1±16.977.0±17.275.6±17.373.0±15.1NR25(39.7)14(22.2)18(29.0)11(18.0)33(52.4)29(46.0)25(40.3)34(55.7)N/A6.65±1.186.58±1.346.39±1.386.53±1.26Sands等[15](UNIFI)NRNRNRNRN/ANR
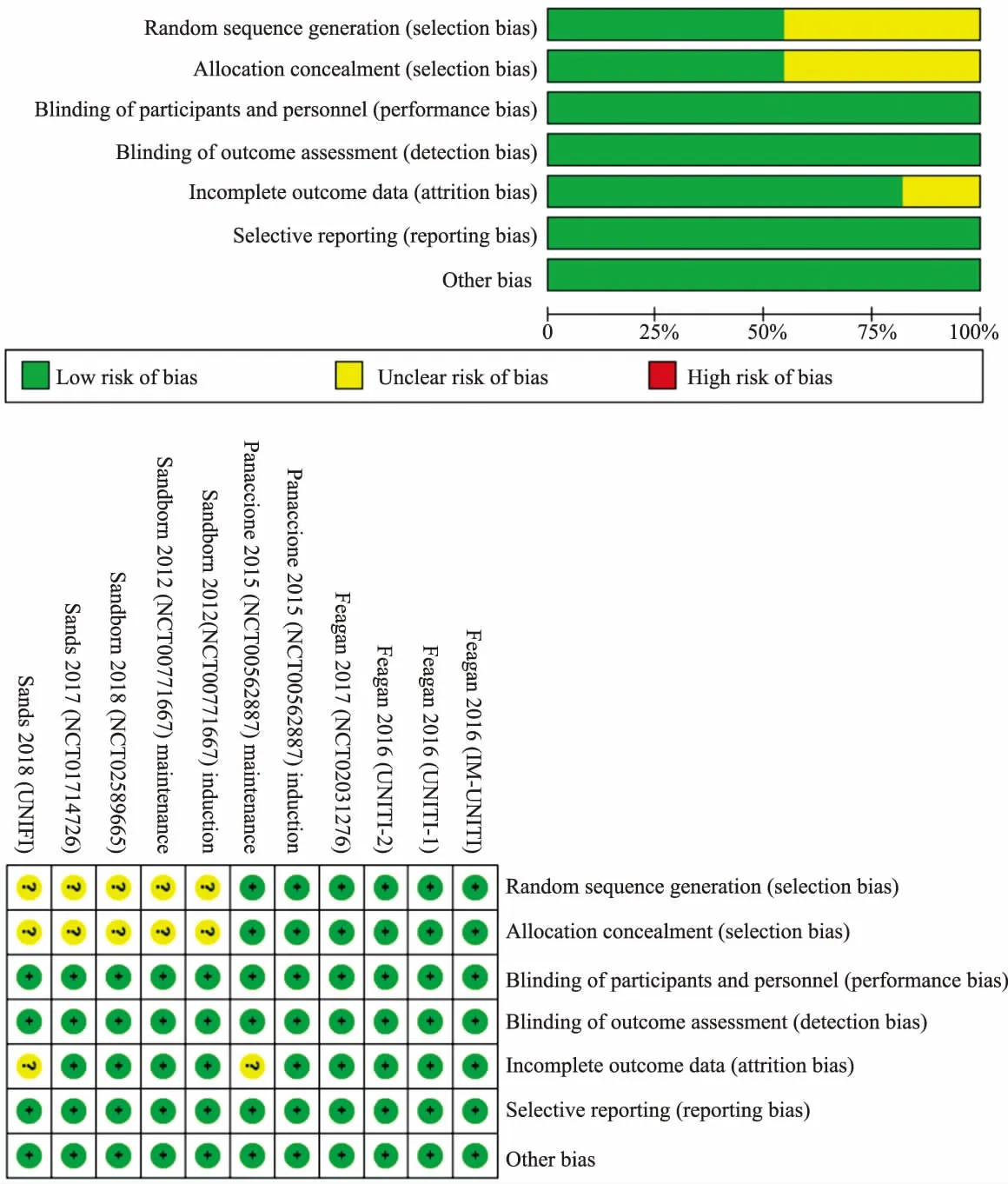
图2 纳入研究的质量评价Fig 2 Quality evaluation of included studies

表2 纳入研究的结局指标结果[n(%)]Tab 2 The outcome indicators results of the included studies [n(%)]
续表2
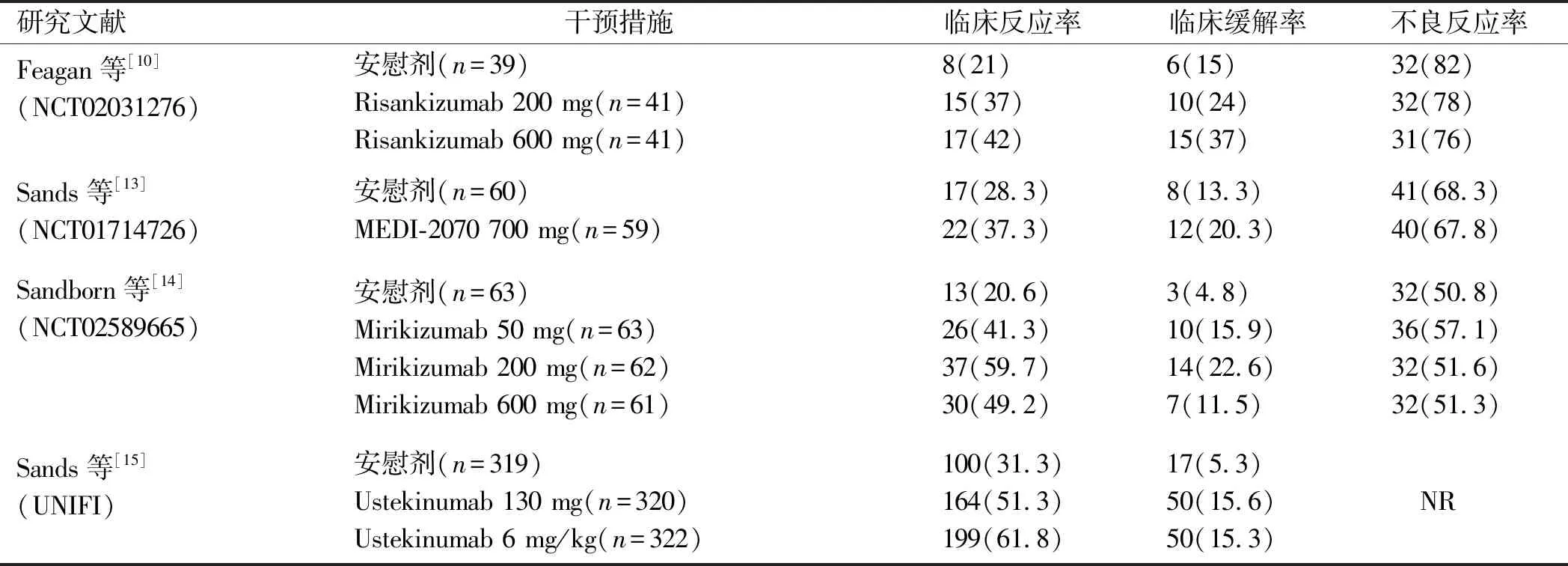
研究文献干预措施临床反应率临床缓解率不良反应率Feagan等[10](NCT02031276)安慰剂(n=39)Risankizumab 200 mg(n=41)Risankizumab 600 mg(n=41)8(21)15(37)17(42)6(15)10(24)15(37)32(82)32(78)31(76)Sands等[13](NCT01714726)安慰剂(n=60)MEDI-2070 700 mg(n=59)17(28.3)22(37.3)8(13.3)12(20.3)41(68.3)40(67.8)Sandborn等[14](NCT02589665)安慰剂(n=63)Mirikizumab 50 mg(n=63)Mirikizumab 200 mg(n=62)Mirikizumab 600 mg(n=61)13(20.6)26(41.3)37(59.7)30(49.2)3(4.8)10(15.9)14(22.6)7(11.5)32(50.8)36(57.1)32(51.6)32(51.3)Sands等[15](UNIFI)安慰剂(n=319)Ustekinumab 130 mg(n=320)Ustekinumab 6 mg/kg(n=322)100(31.3)164(51.3)199(61.8)17(5.3)50(15.6)50(15.3) NR

注:在Feagan 2016(IM-UNITI)试验中,Ustekinumab 90 mg/12周组中有3例患者中途退出试验,Ustekinumab 90 mg/8周组中有4例患者中途退出试验,安慰剂组中有2例患者中途退出试验;在Feagan 2016(UNITI-2)试验中,安慰剂组 中有1例患者中途退出试验,导致森林图中试验组患者总例数少7例,安慰剂组患者总例数少3例。
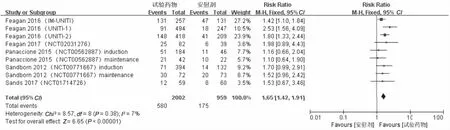
图4 CD临床缓解率森林图Fig 4 Forest plot of CD clinical remission rates

图5 UC临床缓解率森林图Fig 5 Forest plot of UC clinical remission rates
2.4 临床反应率的Meta分析结果纳入的11项研究[9-15]均提供临床反应率,经过RevMan软件进行统计学分析处理后得到各项研究间异质性较高(P=0.02,I2=53%),采用随机效应模型进行Meta分析,结果显示,试验组患者临床反应率高于安慰剂组,差异有统计学意义(RR=1.57,95%CI:1.37~1.81,P<0.00001)(见图6)。CD试验组(RR=1.55,95%CI:1.39~1.72,P<0.00001)、UC试验组(RR=1.88,95%CI:1.59~2.22,P<0.00001)患者临床反应率也高于安慰剂组(见图7~8)。
2.5 不良反应发生情况在Feagan等[9]的UNITI-1试验中报道了1例在随访20周后诊断为多发性骨髓瘤的试验组患者,而在UNITI-2试验中报道了1例接受安慰剂治疗的患者发生了基底细胞癌。在Panaccione等[11]的诱导试验(induction)中,试验组出现了4例严重的不良反应,分别为:基底细胞癌1例、左乳腺浸润性导管癌1例、右侧原位导管癌1例、卵巢囊肿破裂1例。共有的不良反应如恶心、病情恶化、腹痛、关节痛、头痛、恶心等在4项研究中均有报道[10-13]。同时,3项研究[10-12]指出,鼻咽炎和上呼吸道感染也是常见的不良反应。统计学分析结果显示,各项研究间不存在异质性(P=0.90,I2=0),且试验组和安慰剂组在治疗中不良反应发生率的差异无统计学意义(RR=0.96,95%CI:0.91~1.02,P=0.16)(见图9)。
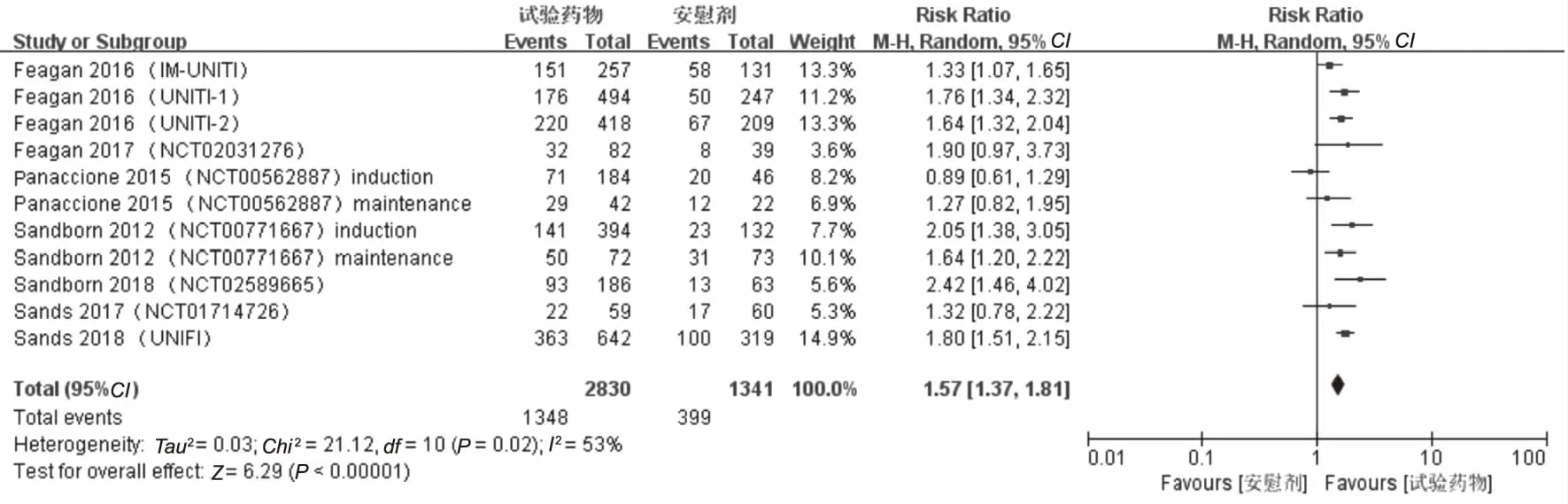
图6 临床总反应率森林图Fig 6 Forest plot of total clinical reaction rates
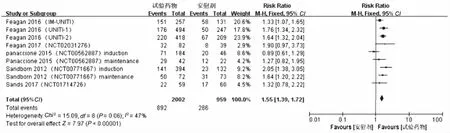
图7 CD临床反应率森林图Fig 7 Forest plot of CD clinical reaction rates
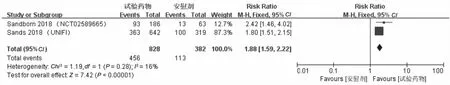
图8 UC临床反应率森林图Fig 8 Forest plot of UC clinical reaction rates
2.6 敏感性分析和发表偏倚在对临床总反应率进行Meta分析时,发现其异质性较高(P=0.02,I2=53%),对纳入的11项研究[9-15]进行敏感性分析,逐一剔除1项研究后观察异质性改变,结果显示,剔除Panaccione等[11]的诱导试验(induction)后各研究间异质性明显下降(见图10)。分析原因可能与试验药物的种类、剂量等有关。对纳入研究的临床总缓解率进行Egger’s检验法检测发表偏倚,结果显示不存在发表偏倚(t=0.83,P=0.429)(见图11)。
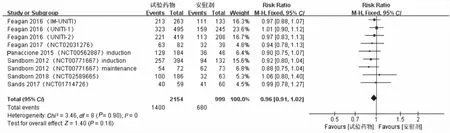
图9 不良反应率森林图Fig 9 Forest plot of adverse reaction rate
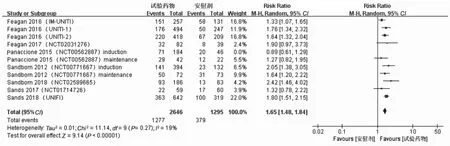
图10 敏感性分析森林图Fig 10 Forest plot of sensitivity analysis

图11 临床总缓解率漏斗图Fig 11 Funnel plot of total clinical reaction rates
3 讨论
在过去20年里,靶向TNF的生物制剂已成为治疗中-重度CD和UC的主要手段[16]。尽管生物制剂已大大改善了IBD的管理,并降低了其手术率、致残率和死亡率,但仍有相当一部分患者对生物制剂无反应、失去反应或不耐受或出现不良反应[17]。而且,生物制剂的成本仍是支付方面面临的一个重要挑战[18]。最后,使用TNF拮抗剂治疗与严重感染风险增加相关[19]。因此,寻找新型、安全、有效的药物迫在眉睫。学者们在对IBD致病因素不断探索的过程中发现了IL-12及IL-23靶点与适应性免疫反应和胃肠道炎症反应有关。这个重要发现为IBD的治疗打开了新思路。IL-12和IL-23阻断剂可阻断其共有的P40亚基或IL-23特有的P19亚基,使上调的炎症因子下降,减轻胃肠道炎症反应。Moschen等[7]指出,IL-12/IL-23拮抗剂对既往用药复杂的患者疗效较好,同时与TNF拮抗剂相比,感染率和发生恶性肿瘤更低,且免疫原性低,安全性更高,应考虑作为一线或二线治疗方案。
本研究通过对11项针对IL-12/IL-23拮抗剂治疗中-重度活动性IBD成人患者的随机双盲安慰剂对照试验的Meta分析中,得出这类药物可提高活动性IBD患者的临床缓解率及临床反应率,差异有统计学意义。我们还证明,与安慰剂相比,使用这些药物治疗与不良反应的总体风险增加无相关性。此结论与Wong等[8]的观点一致。而且,有研究表明,IL-23的P19亚基有选择性,能阻止感染和恶性肿瘤中涉及的IL-12依赖T细胞通路的激活[20-21]。因此,只阻断IL-23可能会更安全。然而,这只是理论,还需要进一步的临床试验数据来证明。
本研究有以下缺陷:(1)虽制定严格的检索策略,但仍可能有部分文献未能被检出,且本研究纳入文献均为已发表文献。(2)关于IL-12/IL-23拮抗剂治疗UC的随机试验较少,样本量较小。(3)试验药物的种类、剂量等方式未能统一,患者同时使用免疫调节剂、激素等药物的种类、剂量未能完全统一。
本研究结果提示,IL-12/IL-23拮抗剂可提高中-重度活动性IBD临床缓解率及临床反应率,同时其安全性高,严重不良反应发生情况少。不过,未来我们的瞄准点应该是有选择性的P19亚基,现有这些试验样本量较小,随访时间较短。所以关于这类新药的临床耐受、内镜治疗、确切疗效和长期的安全数据将是未来几年的研究热点。

