原发性胆汁性肝硬化患者外周血单核巨噬细胞中Notch受体表达情况
杨 森,慕永平,张 珏
上海中医药大学附属曙光医院1.检验科; 2.肝病研究所,上海 201203
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是特异性的自身免疫性疾病,其病变为小叶间胆管上皮细胞发生变性、坏死及炎症细胞浸润引起的肝内小胆管进行性破坏伴门脉炎症性改变,导致胆汁淤积,肝损伤后,星状细胞活化,肝细胞外基质(ECM)增生,瘢痕组织(scar tissue)取代正常肝细胞,进而肝脏发生纤维化,肝纤维化晚期即为肝硬化,甚至肝癌[1]。
Notch基因是在果蝇体内由Morgan于1916年发现,其与细胞增殖、活化、凋亡和组织形成密切相关[2]。Notch基因是哺乳动物体内一段高度保守调控细胞的基因[3]。研究发现,Notch信号通路的异常活化与肝癌、肺癌等恶性肿瘤密切相关[4-5]。Notch信号通路通过激活NF-κB、Wnt和TGF-β的方式促进肝癌细胞的生长和抑制其凋亡[6]。本文探讨PBC患者外周血中巨噬细胞膜Notch受体表达情况及其与巨噬细胞极化的关系,现报道如下。
1 材料与方法
1.1 实验仪器与试剂抗凝管;15 ml离心管;1.5 ml EP管;流式管;恒温水浴箱;高速离心机;医用冰箱;酶标仪;移液枪;流式细胞仪。红细胞裂解液;PBS缓冲液;人Notch1-PE流式抗体(Biolegend公司)、人Notch2-FITC流式抗体(Biolegend公司)、人Notch3-PE流式抗体(Biolegend公司);人CD68-FITC流式抗体(BBI公司);人CCR2-PE流式抗体(BBI公司);人CD163-PE流式抗体(BBI公司);人CX3CR1-FITC流式抗体(BBI公司)。
1.2 方法
1.2.1 样本:本研究所需外周血采集自我院收治的PBC确诊患者30例,男12例,女18例,年龄(39.46±5.76)岁,分为早期PBC组和晚期PBC组,每组15例。患者诊断标准根据美国肝脏协会(AASLD)制定的诊断标准:(1)临床体征表现为胆汁淤积;(2)抗线粒体抗体(AMA)阳性;(3)腹部影像学检查无其他胆道疾病,病理学上表现为小叶间胆管损伤和非化脓性胆管炎。另采集我院体检中心健康体检者外周血15名作为对照组,男6名,女9名,年龄(40.12±5.61)岁。入选的健康体检者与PBC组患者在年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会同意,且患者签订知情同意书。
1.2.2 血清收集:采集PBC组和健康对照组清晨空腹静脉血2 ml于EDTA抗凝管中,然后立即对采集的外周静脉血行流式细胞术检测患者巨噬细胞膜表面Notch受体表达情况及巨噬细胞分型情况。
1.2.3 流式细胞术检测:以CD68/CCR2双阳性代表M1型巨噬细胞,以CD163/CX3CR1双阳性代表M2型巨噬细胞,M2/M1比值表示巨噬细胞极化情况。采用流式细胞术检测巨噬细胞膜上的Notch受体,具体如下:
将抗凝管中的血样本用移液枪分别移至10个标记的流式管中(对照管、CD68、CCR2、CD163、CX3CR1、Notch 1~3各1个;CD68/CCR2、CD163/CX3CR1各2个),每管各100 ml;然后在管Notch 1~3中分别加入5 μl的Notch1-PE、Notch2-FITC、Notch3-PE流式抗体,在管CD68、CD68/CCR2管中加入5 μl的CD68-FITC流式抗体,在CCR2、CD68/CCR2管中加入5 μl的CCR2-PE流式抗体,在CD163、CD163/CX3CR1管加入5 μl的CD163-PE流式抗体,在CX3CR1、CD163/CX3CR1管中加入5 μl的CX3CR1-FITC流式抗体。对照管中加入5 μl的PBS液。震荡混匀,置于室温避光下孵育45 min;然后每管注入200 μl的红细胞裂解液,震荡30 s后,离心10 min,3 000 r/min。弃上清,加入500 μl PBS液充分悬浮沉淀,再离心10 min,3 000 r/min,重复3次;然后每管加入100 μl PBS液,充分混匀,过滤后,在流式细胞仪上检测。
1.3 统计学分析采用SPSS 20.0和GraphPad 6.0统计分析软件,经相关性分析Notch受体表达与M1/M2型巨噬细胞比例的关系。检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 巨噬细胞膜Notch受体表达情况早期PBC患者巨噬细胞膜表面Notch1受体表达水平较健康对照组高,差异有统计学意义(P<0.05);而早期PBC患者巨噬细胞膜表面Notch2受体和Notch3受体表达水平与健康对照组比较,差异无统计学意义(P>0.05)。晚期PBC患者巨噬细胞膜表面Notch1受体和Notch3受体表达升高,与健康对照组比较,差异有统计学意义(P<0.05);而Notch2受体表达与健康对照组比较,差异无统计学意义(P>0.05)。晚期PBC患者Notch1受体和Notch3受体表达水平较早期PBC患者高,差异有统计学意义(P<0.05)(见图1)。
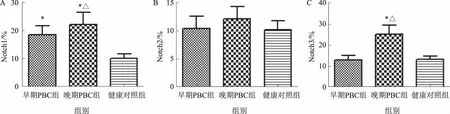
注:与健康对照组比较,*P<0.05;与早期PBC组比较,△P<0.05。
2.2 巨噬细胞M2/M1比值与Notch受体表达水平的相关性分析以M2/M1比值表示巨噬细胞极化的程度。将流式细胞法检测的M2/M1比值与巨噬细胞膜表面的Notch受体作线性相关分析(见图2)。结果显示,Notch1受体与M2/M1比值呈直线线性相关,Notch2和Notch3与M2/M1比值无直线线性相关。
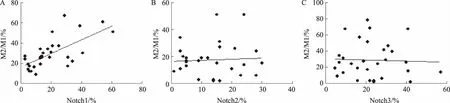
图2 PBC患者外周血清M2/M1与膜Notch1~3线性关系 A: M2/M1与膜Notch1的关系; B:M2/M1与膜Notch2的关系;C:M2/M1与膜Notch3的关系Fig 2 Linear relationship between peripheral serum M2/M1 and membrane Notch1-3 in patients with PBC A: relationship between M2/M1 and membrane Notch1; B: relationship between M2/M1 and membrane Notch2; C: relationship between M2/M1 and membrane Notch3
3 讨论
PBC是自身免疫性肝脏疾病,是由于肝脏淋巴细胞浸润,肝胆管上皮细胞损伤胆管渐进性破坏及高滴度AMA出现,导致胆道狭窄,甚至堵塞,胆汁淤积于肝胆管中。该病多发于女性[7]。PBC发展到失代偿期,肝脏无法自身修复,病情不可逆,逐渐发展为肝衰竭,增加了临床病亡率[8-9]。
Notch受体为Ⅰ型单次跨膜蛋白,包括胞内两个亚基和胞外一个亚基,分子力量30 000,Notch受体家族有4种受体即Notch1~4[10-11]。在哺乳动物中,Notch信号通路有5种配体,称为DSL(Delta-1 配体、Delta-3配体、Delta-4配体及Jagged1配体、Jagged2配体)[12]。胞外亚基中的表皮因子重复序列(EGFR)是Notch受体和配体间的桥梁,在受体配体结合中起重要作用[13-14]。调控蛋白的脯氨酸/谷氨酸/丝氨酸/苏氨酸(PEST)、锚蛋白和转录跨膜区构成了胞内亚基[15]。研究发现,Notch信号通路无级联放大反应,这是由于Notch信号通路激活的过程中无第二信使的参与[3]。研究发现,巨噬细胞的活化与Notch信号通路有关[16],促炎性巨噬细胞(LSP)和巨噬细胞(LSP+IFN-γ)中Notch1~3受体可被检测表达[17]。在小肠中,CD11c+CX3CR1+巨噬细胞亚群分化必须依靠Notch1和Notch2受体[18]。并且Notch配体在促炎性巨噬细胞中也可被检测。Jagged1配体在促炎性巨噬细胞中能显著放大[19]。在敲除Notch基因病症中,发现肝细胞无法聚集,肝胆道细胞无反应进而影响肝胆道的自我修复能力,临床上称Alagille综合征,表现为胆汁淤积和胆管发育不良[20]。胆管发育中的胆管板重塑和小管形成必须依靠Notch信号通路的活化[21]。
本研究发现,早期PBC患者巨噬细胞膜表面Notch1受体表达异常,较健康者表达升高,而Notch2受体和Notch3受体表达水平无明显变化。晚期PBC患者巨噬细胞膜表面Notch1受体和Notch3受体较健康者表达升高,而Notch2受体表达无明显改变。晚期PBC患者Notch1受体和Notch3受体表达水平较早期高。巨噬细胞极化M2/M1比值与Notch受体表达水平呈直线线性相关,即随着Notch受体表达水平的升高,巨噬细胞极化M2/M1比值升高。综上,表明PBC患者外周血巨噬细胞中Notch受体表达异常,且巨噬细胞极化与Notch受体表达水平呈直线相关。

