Notch1 和Hes1 相关蛋白在膝关节骨性关节炎软骨组织中的表达
张 晨, 宋国瑞, 刘子歌, 陈德胜
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院骨科,银川 750004)
膝关节骨性关节炎(knee osteoarthritis,KOA)是一种以关节软骨破坏及骨质增生为主的伴有关节疼痛、肿胀、畸形及活动障碍的慢性关节疾病[1]。据估计,2020 年骨性关节炎在全世界范围内将成为第四大致残疾病[2]。KOA 的病因和发病机制目前尚未完全明确,随着研究的深入,以信号通路为靶点进行研究KOA 的发病机制成为热点。Notch 信号通路通过与靶基因Notch 1、Hes 1的结合,可以参与多种物质从细胞膜向细胞核的传递,介导如细胞生长、增殖及程序性死亡等过程[3]。本研究通过对比KOA 软骨及正常软骨组织中Notch1、Hes1 相关蛋白的表达,探讨其在骨性关节炎发生发展中的作用及其意义,拟为KOA的诊断、治疗及其预后提供新的临床思路。
1 材料与方法
1.1 一般资料
标本收集自2018 年3 月1 日—2019 年2 月28 日宁夏医科大学总医院骨科,由同组手术医疗组骨科医师主刀,32 例骨性关节炎标本均经术前体征、病史、X 线影像确诊,作为病例组。其中女性20 例,男性12 例,年龄(53.32±9.22)岁;HE 染色结果通过采用改良的Mankin 评分标准[4]对关节软骨行病理分期:KOA 中期软骨组9 例;KOA 晚期软骨组23 例。全部病例术前均未接受骨性关节炎针对性治疗。对照组为16 例膝关节内骨折切开内固定术中去除的部分软骨组织,其中女性6 例,男性10 例,年龄(45.32±11.22)岁,无骨性关节炎病史。术前均经患者或家属知情,并签署知情同意书。
1.2 主要试剂及仪器
苏木素、番红O、多聚甲醛;兔抗人Notch1 单克隆抗体、兔抗人Hes1 单克隆抗体(购自美国Abcam 公司),山羊抗兔IgG(购自北京中山金桥有限公司);DAB 显色试剂盒、PBS 缓冲液、柠檬酸盐缓冲液(购自博士德生物工程有限公司);Image Pro Plus 6.0 图像分析软件(购自美国Media Cybernetics 公司);H6023i 显微镜及图像采集系统(购自德国Leica 公司),CFX Connect 定量PCR 仪(购自美国BIO-RAI 公司)。
1.3 实验方法
1.3.1 组织处理 所有标本均截成0.5 cm ×0.3 cm×0.3 cm 的骨片,取材后经4%多聚甲醛固定、0.2 mol·L-1磷酸缓冲液中充分漂洗后置于EDTA 脱钙液中脱钙,每周更替一次脱钙液,待针刺组织而无明显阻力感时取出,冲洗24 h,将组织沿矢状面切为4 mm 组织块,脱水、包埋、切片。
1.3.2 番红染色 组织切片于70 ℃烤箱中过夜,后分别经过二甲苯脱蜡20 min 2 次,梯度乙醇脱水后,铁苏木精染色5 min,蒸馏水冲洗,1%盐酸乙醇分化30 s,蒸馏水冲洗2 min,固绿染色5min,蒸馏水漂洗30 s,番红染色5 min,蒸馏水漂洗1 min,乙酸漂洗1 min,蒸馏漂洗1 min,风干,二甲苯透明60 s,中性树脂封固,显微镜下观察。
1.3.3 HE 染色 将切片置于37 ℃恒温箱中过夜,后分别经过二甲苯玉、二甲苯Ⅱ各20 min,70%、80%、90%、95%乙醇各5 min,超纯水5 min脱蜡入水。随后在苏木素中染色2.5 min,超纯水冲洗干净,然后在1%盐酸乙醇中分化3 s 后自来水冲洗干净,ddH2O 中反蓝20 min,伊红染色3~5 s,风干后用中性树脂封固,显微镜下观察。
1.3.4 免疫组化 组织切片于70 ℃烤箱中过夜,二甲苯脱蜡20 min,脱蜡两次,梯度乙醇脱水后蒸馏水、PBS 漂洗各3 min。组织片于柠檬酸钠缓冲液中微波炉煮沸13 min,自然冷却后体积分数3%H2O2去离子水浸泡10 min,PBS 冲洗3次,分别滴加Notch 1 一抗、Hes 1 一抗,4℃冰箱孵育,8 h 后取出,PBS 冲洗3 次,滴加山羊抗兔IgG 聚合物孵育15 min,PBS 冲洗3 次,DAB 显色液显色15 s,PBS 冲洗3 次,苏木精复染5 min,蒸馏水冲洗2 次,1%盐酸乙醇分化若干秒,蒸馏水冲洗2 min 梯度乙醇复水,二甲苯透明后用中性树脂封固,显微镜下观察。
1.3.5 切片结果判定 所有切片采用双盲法由两位实验员独立阅片,进行结果评定。HE 染色结果通过Mankin 评分标准,0~3 分为正常软骨,4~11 分为中期软骨,12~14 分为晚期软骨。免疫组化结果在40 倍光镜下随机选取每张切片的5 个视野,应用Image Pro Plus 6.0 图像分析软件,测评正常组、中期软骨组及晚期软骨组软骨细胞中Notch 1、Hes 1 的阳性表达率,并进行对比。
1.4 统计学方法
采用SPSS 20.0 软件进行统计学分析,以均数±标准差(±s)表示,多组样本均数间比较选用单因素方差分析,两两比较采用LSD-t法。P≤0.05 为差异有统计学意义。
2 结果
2.1 KOA 软骨组织番红染色结果
对照组(16 例):软骨基质番红染色均匀、标本表面较完整,光滑度较好,软骨细胞形态规则,胞膜完整,胞质丰富,软骨细胞数量多,潮线完整清晰(图1A);病例组(32 例):软骨表面不光滑,基质番红染色减退较重,软骨细胞数量重度减少、成簇分布,潮线不完整(图1B)。
2.2 KOA 软骨组织HE 染色结果
对照组(16 例):软骨表面完整,软骨细胞较多,排列较规整,潮线规整,偶见失染现象(图2A);病例组(32 例):软骨面不整,细胞凋亡较多,细胞排列紊乱,软骨细胞减少,潮线中断且部分消失,染色不均且有失染现象(图2B)。按Mankin 评分标准,从软骨结构、软骨细胞数量、软骨基质染色以及潮线完整性进行评分,根据评分结果将病例组分为中期软骨组9 例、晚期软骨组23 例(表1)。
表1 KOA 软骨组织Mankin 评分(±s,分)
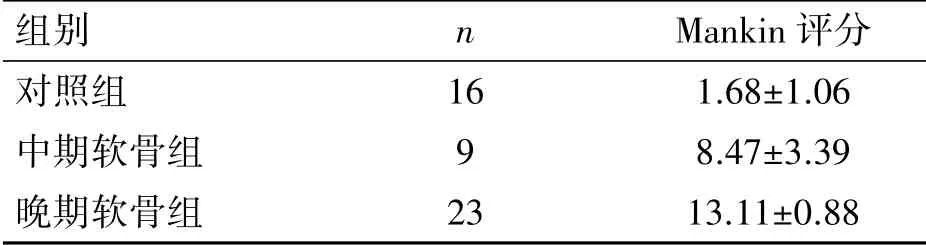
表1 KOA 软骨组织Mankin 评分(±s,分)
组别 n Mankin 评分对照组 16 1.68±1.06中期软骨组 9 8.47±3.39晚期软骨组 23 13.11±0.88
2.3 免疫组化检测KOA 软骨组织Notch1、Hes1表达结果
Notch1 蛋白着色区域在正常细胞内广泛分布于细胞核,细胞质内少量表达(图3A);在病例组软骨中,可见胞质内有游离Notch1 蛋白(图3B)。Hes1 蛋白着色区域主要集中在细胞质中,呈黄色或棕色颗粒(图4A)。Hes1 主要作用于细胞外基质中的胶原纤维,在软骨细胞外基质中也存在游离的Hes1 蛋白,在病例组软骨细胞外基质中可看到颜色变化(图4B)。
Notch1 和Hes1 在对照组与病例组软骨细胞中阳性表达率见表2、表3。中期软骨组与晚期软骨组、对照组间差异均有统计学意义(P均<0.001);两两比较发现中期、晚期软骨组Notch1、Hes 1 阳性表达率均高于对照组(P均<0.05),晚期组阳性表达率高于中期组(P均<0.05)。
表2 免疫组化检测KOA 中期、晚期病例软骨Notch1 阳性细胞率比较(±s)

表2 免疫组化检测KOA 中期、晚期病例软骨Notch1 阳性细胞率比较(±s)
与对照组比较*P<0.05,与中期软骨组比较#P<0.05
组别 n Notch1 阳性细胞率/% F 值 P 值对照组 16 21.16±7.86中期软骨组 9 33.62±5.87* 39.660 <0.001晚期软骨组 23 47.12±4.33*#
表3 免疫组化检测KOA 中期、晚期病例软骨Hes1 阳性细胞率比较(±s)

表3 免疫组化检测KOA 中期、晚期病例软骨Hes1 阳性细胞率比较(±s)
与对照组比较*P<0.05,与中期软骨组比较#P<0.05
组别 n Hes1 阳性细胞率/% F 值 P 值对照组 16 11.56±5.92中期软骨组 9 27.42±6.27* 18.632 <0.001晚期软骨组 23 33.47±4.63*#
3 讨论
Sassi 等[5]提出了Notch 信号通路在KOA 中的作用,针对骨性关节炎软骨组织的研究也越来越多。Notch 信号通路是在Notch 配体与受体结合后开始激活的,即生成胞内区(Notch intracellular domain,NICD)与细胞核中DNA 结合蛋白结合后激活下游靶基因如Notch1、Hes1 相关蛋白[6]。据研究统计[7],Notch1 蛋白的活化出现在56%~63%的骨性关节炎中,是常见的导致骨性关节炎的信号通路效应蛋白。本研究证实,Notch1 在病例组软骨组织中有阳性表达,且高于对照组。由于被异常激活后的Notch1 蛋白可以刺激巨噬细胞、炎性因子持续存在,导致骨代谢平衡能力下降,增加骨赘的形成,所以在关节畸形中发挥关键作用[8]。
Hes1 蛋白是Notch 途径的重要组成部分,是一种强碱性螺旋环螺旋转录抑制因子(bHLH),Hes1 蛋白的激活可以降解软骨基质的蛋白聚糖酶5(ADAMTS5)的血小板凝血酶敏感蛋白样序列1 区(TSP-1)及基质金属蛋白酶(MMP13)[9]。蛋白聚糖酶5 含有一个结合Hes1 的典型序列,其中包含IL-6、IL-1、IL-33 受体编码的靶基因。而IL-1 及IL-6 是诱发关节炎症和软骨退化的炎症细胞关键因子[10]。在本实验中,Hes1 蛋白在对照组及病例组软骨组织中均存在阳性表达,且晚期软骨组织中的阳性表达率要高于中期软骨组织,说明Hes1 蛋白参与了膝关节软骨磨损、退变的过程。研究表明[11],在KOA 中,Hes1 通过抑制间充质前体细胞 (mesenchymal progen itor cells,MPCs)向软骨细胞分化,促进破骨细胞的分化成熟,增强其骨吸收活性并阻止其凋亡,骨再生能力受损,软骨组织出现不可逆性退化,甚至凋亡,出现骨性关节炎。
所以,本实验通过对Notch1 和Hes1 相关蛋白的形态学及免疫学检测,证实了其在KOA 组织中存在,且Notch1 和Hes1 蛋白的阳性表达率随着关节软骨磨损程度的加重而升高,证实其参与甚至主导了骨性关节炎中异常细胞激活和分化过程,导致骨代谢失衡、骨质破坏,正常软骨细胞炎性改变,形成KOA。在异常活化的Notch-1及Hes1 相关蛋白持续作用下,病变的骨细胞及软骨细胞无法自行修复,在后期软骨病变及骨赘的形成过程中起到关键作用[12]。综上所述,Notch1和Hes1 相关蛋白参与了KOA 的发生发展,可作为诊断膝关节骨性关节炎的参考指标之一。

