茶多酚对过氧化氢诱导鹅小肠上皮细胞氧化损伤的保护作用
付 晶,林 桐,陈艾玲,邓 珊,刘春朋
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.仲恺农业工程学院动物科技学院,广州 510225)
内环境稳态为畜禽健康必要条件。随着畜牧业集约化、高密度饲养模式的推广,在养殖过程中,如饲养管理不当可造成动物应激。机体产生过量自由基、体内氧化还原平衡遭到破坏,发生氧化应激损伤,严重影响机体健康和生产性能[1]。肠道为机体养分消化吸收、物质新陈代谢的主要器官,因其特有的血管解剖结构特点及对流氧交换机制决定其应激状态下更易发生氧化损伤,诱发肠道疾病[2]。在畜牧业转型升级、畜禽标准化规模化养殖模式持续推进的大趋势下,畜禽肠道问题日益突出,为减轻氧化应激对畜禽肠道健康的影响,研究肠道氧化应激机理并寻找预防和修复肠道氧化损伤的方法成为亟待解决的问题之一。
肉鹅是我国华南地区主要水禽饲养种类。在生产周期中,肠道易受外界刺激,高饲料转化率、养殖环境污染和频繁的免疫程序等不利因素,均可导致肉鹅机体代谢过程中产生大量自由基,引发肠道疾病[3]。抗氧化剂可清除自由基、减缓氧化应激危害。随着饲用抗生素的全面禁用,开发绿色功能性饲料添加剂在畜牧生产中尤为必要。
茶多酚(Tea polyphenols, TP)为一类从茶叶中提取的多酚类化合物总称,作为天然药物具有广泛的药理作用和生物学功能,如抗氧化、抗炎症、抑菌、清除机体自由基等[4]。TP为迄今为止唯一被列入我国食品添加剂使用标准的天然抗氧化剂[5]。TP 作为饲料添加剂在家禽生产中已有应用,但其发挥生物学特性的内在机制有待进一步研究。目前,相关研究主要集中于鸡、鸭等生长性能、繁殖性能、肉品质及菌群调节等方面[6],关于TP 在养鹅生产中的应用尤其是对鹅肠道抗氧化功能研究未见报道。本研究体外分离培养鹅小肠上皮细胞,使用过氧化氢(H2O2)处理,建立氧化应激损伤细胞模型;采用TP对细胞作预处理,探讨TP对H2O2引发细胞氧化应激损伤的保护作用机制,为TP 作为功能性饲料添加剂在养鹅生产中的应用提供理论依据。
1 材料与方法
1.1 试验材料
25~26胚龄发育良好的马岗鹅鹅胚,购自广州文健明种鹅养殖有限公司。茶多酚(纯度≥98%),购自北京索莱宝科技有限公司。
1.2 主要试剂
DMEM/F12 培养基(11320033)、0.05% Trypsin-EDTA(2530062),购于Gibco 公司;表皮生长因子EGF(E4127)、青链霉素(V900929)、胶原酶Ⅺ(C7657)、中性蛋白酶Ⅰ(D4818)、L-谷氨酰胺(G8540)、3% H2O2,购自Sigma 公司;鼠尾胶原蛋白(C8062)、MTT 试剂盒(M1020)、一抗稀释液(A1810),购自北京索莱宝科技有限公司;优级胎牛血清(11011),购自杭州四季青公司;细胞角蛋白18 单克隆抗体(M01357)、SABC 免疫组化试剂盒(SA1021)、DAB显色试剂盒(AR1022),购自武汉博士德公司;乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)试剂盒均购自南京建成生物工程研究所。
1.3 主要仪器
超净工作台(VS-1300U),二氧化碳培养箱(Thermo fisher scientific),低温高速离心机(Thermo fisher scientific),倒置显微镜(Olympus CX41),电热恒温水槽(上海一恒CU-600),酶标仪(Thermo fisher scientific 51119300),紫外分光光度计(Eppendorf)。
1.4 样品采集及处理
1.4.1 鹅小肠上皮细胞分离、纯化及鉴定
1.4.1.1 鹅小肠上皮细胞分离
取25~26胚龄发育良好鹅胚,75%酒精棉擦拭外壳,晾干后用灭菌解剖器械在超净台内取出小肠组织,暂置于DMEM/F12培养基。随后在含有双抗DMEM/F12培养液(不含血清)中,小心剥离肠系膜,使用PBS反复冲洗肠腔内容物,直至上清液澄清。将小肠组织剪成<1 mm3碎块,使用比例为9∶1胶原酶Ⅺ和中性蛋白酶混合酶,37 ℃消化25 min后,4 ℃离心10 min弃上清,即获得鹅小肠上皮细胞沉淀。
1.4.1.2 鹅小肠上皮细胞纯化
根据上皮细胞较成纤维细胞贴壁慢的特点,选用“相差贴壁法”使两类细胞分离以达到纯化目的。即:先将1.4.1.1中分离得到的细胞沉淀用含有双抗和10%血清的DMEM/F12 培养基吹匀,随后将悬液接种至第1个培养瓶中,置于37 ℃、5%CO2培养箱培养90 min;然后轻轻吸取全部培养液(含未贴壁上皮细胞),接种到第2 个培养瓶中,置于37 ℃、5%CO2培养箱继续培养24 h后,更换新鲜细胞培养液,即获得纯化的鹅小肠上皮细胞。
1.4.1.3 鹅小肠上皮细胞鉴定
取纯化后传至第二代的小肠上皮细胞,将其以每孔1×104密度接种到24 孔板上,培养3~4 d。吸去培养液,使用PBS洗涤细胞2~3次。然后按照博士德SABC免疫组化染色试剂盒说明书操作,细胞固定、灭活、封闭、一抗孵育、二抗孵育、SABC 染色和DAB 显色。显微镜下观察显色情况,待10~15 min显色完成后,蒸馏水充分洗涤以终止显色反应。
1.4.2 茶多酚干预鹅小肠上皮细胞氧化应激损伤模型建立
1.4.2.1 H2O2诱导鹅小肠上皮细胞氧化应激损伤模型建立
按照每孔0.5~1×104个细胞将对数生长期鹅小肠上皮细胞接种于96 孔培养板,置于培养箱中培养,待细胞生长至80%时,弃去细胞培养上清液,加入配制的含有终浓度分别为0(对照组)、100、200、400、800 和1 600 μmol·L-1的H2O2培养液,每组6个平行。置于37 ℃、5%CO2培养箱中分别培养2 和4 h后,测定细胞存活率。
1.4.2.2 TP对鹅小肠上皮细胞增殖的影响
按照每孔0.5~1×104个细胞取对数生长期细胞,待细胞生长至80%时,弃去细胞培养上清液,加入配制的含有终浓度分别为0(对照组)、12.5、25、50、100 和200 μg·mL-1TP 培养液,每组6个平行。置于37 ℃、5%CO2培养箱中培养12 h后,测定细胞存活率。
1.4.2.3 TP预处理鹅小肠上皮细胞损伤模型建立
试验分为4 组:对照组、TP 处理组、H2O2处理组、TP和H2O2联合组(TP预处理组)。其中:①对照组:用DMEM/F12 培养基培养小肠上皮细胞12 h;②TP 处理组:用含有100 μg·mL-1TP 的DMEM/F12培养基培养小肠上皮细胞12 h;③H2O2处理组:先用DMEM/F12培养基培养小肠上皮细胞10 h,再用含有400 μmol·L-1H2O2的DMEM/F12 培养基培养小肠上皮细胞2 h;④TP+H2O2联合组:先用含有100 μg·mL-1TP的DMEM/F12培养基培养小肠上皮细胞10 h,再加入终浓度为400 μmol·L-1H2O2,共培养2 h,测定相关指标。
1.4.3 鹅小肠上皮细胞活力检测
按1.4.2 分组及药物处理后,小心吸去原培养基,每孔加入90 μL新鲜DMEM/F12培养基和10 μL MTT 溶液,继续培养4 h;然后吸去培养基,再向每孔加入110 μL Formazan溶解液后,置于摇床上低速震荡10 min,使结晶充分溶解。在酶标仪490 nm波长处测量各孔吸光值。设定对照组细胞存活率为100%,根据下列公式计算各组细胞存活率。
细胞存活率(%)=(处理组OD 平均值/对照组OD平均值)×100%
1.4.4 与氧化应激相关指标MDA、LDH、SOD 和GSH-Px测定
将鹅小肠上皮细胞以每孔2×105个细胞接种于6孔板中,按1.4.2.3分组及药物处理后,收集细胞培养液,12 000 r·min-1离心10 min,取上清液用于测定LDH 活性。取细胞,用0.05%胰蛋白酶-EDTA 消化细胞,收集细胞悬浮液,1 000 r·min-1离心10 min,弃上清后加入PBS配制细胞悬液,细胞破碎仪破碎细胞,测定MDA 含量及SOD 和GSH-Px 活性。MDA、LDH、SOD 和GSH-Px 测定依据南京建成生物工程研究所提供试剂盒说明书操作。采用微板法测定LDH 活性、TBA 法测定MDA 含量、黄嘌呤氧化酶法测定SOD 活性、比色法测定GSH-Px活性。
1.5 统计与分析
使用GraphPad Prism 5.0软件统计学分析试验数据并作图。通过单向ANOVA评估比较平均值,采用Tukey检验组间多重比较。数据均用“mean±SD”表示。不同字母代表组间差异显著(P<0.05)。
2 结果与分析
2.1 鹅小肠上皮细胞分离、纯化及鉴定
成功建立鹅小肠上皮细胞体外培养方法,用混合酶(0.01 mg·mL-1胶原酶XI+0.1 mg·mL-1中性蛋白酶)消化法分离得到鹅小肠上皮细胞(见图1a 和1b)。用相差贴壁法分离纯化肠上皮细胞(见图1c和1d),并以每孔0.5~2×104个细胞作为后续试验中细胞接种浓度。细胞形态学观察结果显示(见图1e和1f),分离得到细胞呈卵圆形或多角形,单层贴壁生长,边缘清晰紧密相连;且获得较多具有增殖活性的肠隐窝集团。此外,试验选用上皮组织中特异性抗原(细胞角蛋白18 单克隆抗体)对传至第二代细胞免疫组化染色,发现90%以上细胞染色结果呈阳性(见图1h),说明获得的细胞为肠上皮细胞,可用于后续试验。
2.2 茶多酚干预鹅小肠上皮细胞氧化应激损伤模型建立
2.2.1 H2O2对鹅小肠上皮细胞存活率的影响
由表1可见,与对照组相比,H2O2处理组细胞存活率随着H2O2浓度增加而显著降低(P<0.05)。100 μmol·L-1组存活率均在80%左右,细胞损伤较小;400 μmol·L-1组处理细胞4 h 后,细胞存活率低于50%,而2 h组细胞存活率相对于对照组显著降低至71.46%(P<0.05),符合建立氧化应激模型条件;800 和1 600 μmol·L-1组存活率进一步降至40%以下,细胞存活率较低。
2.2.2 H2O2作用2 h对鹅小肠上皮细胞形态的影响
由图2可见,不同浓度H2O2处理鹅小肠上皮细胞2 h 后,对照组细胞形态正常,贴壁情况良好,细胞连接紧密无明显间隙;100 μmol·L-1组细胞形态无明显变化;200 μmol·L-1组仅少量细胞脱落;400 μmol·L-1组细胞体积缩小、脱落,局部出现细胞间隙变大,少量细胞变圆死亡;800 和1 600 μmol·L-1组细胞体积缩小变圆,细胞脱落严重且出现大面积空隙,细胞核突出,产生DNA损伤。
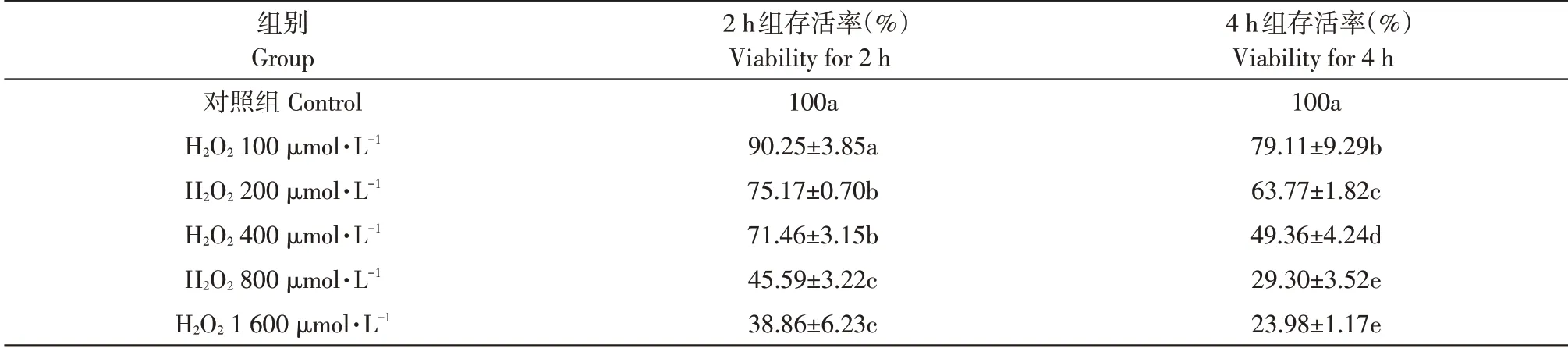
表1 H2O2对鹅小肠上皮细胞存活率的影响(n=6)Table 1 Effect of H2O2on the survival rate of small intestinal epithelial cells in goose embryo(n=6)
2.2.3 TP对鹅小肠上皮细胞存活率的影响
为确定TP 作用于肠上皮细胞安全剂量范围,将不同浓度TP加入肠上皮细胞培养基中,检测TP对肠上皮细胞存活率的影响。结果如图3a 所示,与空白对照组相比,12.5~200 μg·mL-1TP处理上皮细胞后,在12 h 内,随TP 浓度增大,细胞存活率上升且差异显著(P<0.05)。研究表明,TP可提高正常肠上皮细胞存活率,且具有一定剂量效应。但100 和200 μg·mL-1浓度TP 对细胞存活率的影响差异不显著(P>0.05),因此本研究选取100 μg·mL-1浓度TP 用于后续试验。图3b 显示,与对照组相比,肠上皮细胞经H2O2处理后存活率(74.8%)显著下降(P<0.05),而经TP 预处理10 h 后肠上皮细胞经H2O2处理后存活率为117.94%。研究表明,TP对H2O2诱导的细胞损伤具有保护作用,可逆转H2O2诱导的细胞氧化应激损伤。
2.3 TP 对H2O2 诱导鹅肠上皮细胞脂质过氧化(MDA)和乳酸脱氢酶(LDH)的影响
MDA 为脂质过氧化物重要降解产物之一,由图4a可知,与对照组相比,H2O2组细胞MDA 含量显著增加(P<0.05)。与H2O2组相比,TP 与H2O2联合处理(即用TP 预处理细胞10 h)可显著降低H2O2导致的鹅小肠上皮细胞MDA 产生。当脂质过氧化物大量增加时可导致细胞膜损伤,而LDH 漏出率可反映细胞膜完整程度。图4b 可知,与对照组相比,H2O2组细胞LDH 含量显著增加(P<0.05),而TP 组细胞LDH 含量明显下降(P<0.05)。与H2O2组相比,TP 与H2O2联合处理可显著降低H2O2导致的鹅小肠上皮细胞中LDH 产生。研究结果表明,在鹅肠上皮细胞中,TP 可抑制H2O2引起的细胞脂质过氧化发生和细胞膜通透性提高。
2.4 TP 对H2O2 诱导的鹅肠上皮细胞抗氧化酶SOD和GSH-Px的影响
由图5可知,在鹅小肠上皮细胞中,与对照组相比,H2O2可显著降低细胞SOD 和GSH-Px 活性(P<0.05),TP组可显著增加细胞SOD和GSH-Px活性(P<0.05)。与H2O2模型组细胞相比,TP 预处理组也可显著增加细胞SOD 和GSH-Px 活性(P<0.05)。以上结果提示TP通过提高抗氧化酶系活性减轻H2O2所致的氧化应激损伤。
3 讨论与结论
小肠上皮细胞为机体更新速度最快的一类细胞,其结构和功能完整性对动物健康具有重要作用。因此,体外培养小肠上皮细胞可进一步了解和模拟肠道生物学功能。本研究成功分离得到原代鹅小肠上皮细胞,为进一步研究肠道功能提供有效的细胞模型。
鹅是以草食为主的水禽,可充分利用纤维含量较高的青绿饲料和粗饲料,其小肠液微碱性环境及小肠内纤维素酶有助于对粗纤维的消化。因此,维持小肠正常生理功能对鹅的健康尤为必要[7]。本研究通过体外建立鹅小肠氧化应激损伤模型,研究鹅肠道发生氧化损伤机制。H2O2为一种重要的活性氧物质,可穿透细胞膜与细胞内铁离子反应,生成具有高活性自由基,因其理化性质稳定容易获得,现已成为建立细胞氧化损伤模型的重要工具[8]。孔令联等采用200 μmol·L-1浓度H2O2作用奶牛小肠上皮细胞2 h,成功建立奶牛小肠上皮细胞氧化损伤模型[9]。本试验研究结果表明,选用浓度为400 μmol·L-1H2O2作用鹅小肠上皮细胞2 h,细胞存活率显著降至71.4%,且此时细胞形态发生改变,说明细胞产生一定程度的氧化损伤,但不会直接造成细胞死亡,适宜的抗氧化剂干预,可能恢复损伤。因此,此浓度和作用时间可作为建立鹅小肠上皮细胞氧化应激损伤模型的适宜浓度,与孔令联等研究不同,可能为细胞结构和耐受性不同所致[9]。
MDA 为脂质过氧化的标志性产物,可间接反映细胞氧化损伤程度[10]。LDH正常情况下存在于机体组织细胞胞质内,当细胞发生氧化损伤时,细胞膜受损,LDH 由胞质内泄漏。LDH 在细胞培养液中含量反映细胞膜受损程度[11]。SOD被称为自由基清除剂,为生物体内重要的抗氧化酶,可将超氧自由基转化为H2O2,使细胞免受氧化应激损伤[12]。SOD 活力可间接反映机体清除自由基能力。GSH-Px可使机体内有毒的过氧化物还原为无毒的羟基化合物,同时促进H2O2分解成氧气和水,保持细胞膜结构和功能完整性[13]。王振云研究结果显示,奶牛乳腺上皮细胞在H2O2诱导的氧化损伤下,MDA 和LDH 含量显著增高,SOD 活性下降[14]。吴建民研究结果表明,鸡小肠上皮细胞发生急性氧化应激损伤时,细胞培养液中LDH 酶活性显著升高,细胞抗氧化酶SOD和GSH-Px活力显著降低[15]。以上研究结果表明,H2O2可诱导不同动物上皮细胞发生氧化应激损伤。本试验发现,当H2O2诱导鹅小肠上皮细胞时,细胞培养液中LDH和MDA 含量升高,SOD 和GSH-Px 活性下降。表明鹅小肠上皮细胞在H2O2作用下发生氧化应激损伤,不仅产生大量脂质过氧化物,且细胞膜通透性发生改变,即膜质内LDH 透过细胞膜释,细胞培养液中LDH 水平显著升高。而抗氧化酶活性下降,表明鹅小肠上皮细胞抗氧化能力降低。
近年研究表明,天然植物及其主效成分对畜禽具有抗氧化、增强免疫力、促生长等作用,已作为功能性饲料添加剂在畜牧业中广泛应用[16]。TP为茶叶中多羟基酚类化合物总称,结构中的酚羟基可与机体自由基结合,使自由基活性下降,减轻自由基对机体损伤[17]。大量体内、体外试验表明TP 不仅可提高正常组织细胞的抗氧化能力,对氧化应激损伤细胞也具有保护作用,但对不同物种及其所处生物时期作用效果不同,发挥抗氧化能力有效剂量也不同。孙丹凤研究表明,茶多酚可显著降低肉鸭小肠黏膜中MDA 含量,显著提高小肠黏膜中SOD、GSH-Px、二胺氧化酶(DAO)活性[18]。何梦晓等研究发现,TP 可提高感染鸡球虫肉仔鸡生长性能和抗氧化能力,改善盲肠微生物组成[19]。Ma 等研究表明,TP 可通过激活NFE2L2/HMOX1 信号通路减缓奶牛乳腺上皮细胞发生的氧化应激损伤[20];Zhao 等研究表明,TP 可通过提高小鼠肝细胞抗氧化能力缓解酒精诱导的急性肝损伤[21]。Cai 等研究表明,TP 通过提高小鼠肠上皮细胞增殖率和降低脂质过氧化程度保护小鼠肠道免受高脂饮食导致的氧化应激损伤[22]。本试验结果发现,TP 不仅可提高正常肠上皮细胞增殖率和抗氧化能力,还可通过提高肠上皮细胞对氧自由基的清除能力,降低脂质过氧化反应,减轻氧自由基对细胞膜结构与功能损伤,实现对肠上皮细胞氧化应激状态的保护作用。

