RNAi技术介导大豆蚜hsp70基因对其内源物质及激素表达的影响
韩岚岚,陈 娟,赵奎军*,邴玉成,朱 琳,张雯林,高丽瞳,肖建飞,金明国
(1.东北农业大学农学院,哈尔滨 150030,2.朝鲜桂应祥沙里院农业大学蚕学研究室,朝鲜 沙里院 999903)
大豆蚜(Aphis glycines)属半翅目(Hemiptera)、蚜科(Aphididae)、蚜属(Aphis),是栽培大豆常发性害虫之一。大豆蚜在我国分布于各大豆主产区[1],2000 年入侵美洲和大洋洲[2-3],为全球性害虫[4-5]。大豆蚜集中在植株生长点、叶背,以刺吸方式产生危害,引起植株矮化、叶片老化等[6]。严重可使大豆减产达50%以上,影响大豆品质[7]。目前,大豆蚜防治仍以有机磷类、菊酯类和新烟碱类杀虫剂[8]等为主,但长期使用化学药剂可使大豆蚜产生抗药性。
热休克蛋白70(Heat shock protein 70,HSP70)是在应激条件下产生的自我保护应激蛋白,具有应激诱导表达特性。韩岚岚等研究表明,大豆蚜受吡虫啉胁迫时,hsp70 基因表达量上升[9]。郝春凤等研究发现,花绒寄甲(Dastarcus helophoroides)受高温胁迫时,hsp70 基因表达量呈先升后降动态变化[10],当果蝇(Drosophila melanogaster)发生滞育时诱导hsp70 基因表达[11],而敲低hsp70 和hsc70 基因导致昆虫对长期饥饿的抵抗力降低[12],研究结果表明,hsp70 表达量和昆虫生长发育及应对非生物胁迫的能力密切相关。
RNA 干扰是由双链RNA 介导,具有特异性强、沉默效果显著等特点。主要通过浸泡、注射、饲喂等方法将dsRNA 或siRNA 导入昆虫体内。其中浸泡法不适合大多数昆虫;显微注射法对于体型微小昆虫易产生机械损伤,对操作技术精准度要求极高;饲喂法易于操作,省时省力,适合大田推广,不会造成机械损伤,适用小型昆虫RNA 干扰,但缺点为干扰不同昆虫时siRNA 使用量需先开展大量重复试验验证。研究者通过饲喂法对小型刺吸类害虫苹果黄蚜(Aphis citricola)[13]、麦二叉蚜(Schizaphis graminum)[14]细胞色素P450 基因作RNA干扰,均显著抑制目的基因表达。
本文旨在分析siRNA hsp70 干扰后大豆蚜体内内源物质和激素等物质表达动态情况,寻找大豆蚜对siRNA hsp70 干扰后代谢表现最剧烈时间点,为大豆蚜防治提供理论依据,以期减少农药使用量。
1 材料与方法
1.1 供试虫源
供试大豆蚜为未接触过农药,经单克隆繁殖、定期复壮实验室稳定种群,置于温度(25±1)℃、光照(L∶D)=14∶10、相对湿度70%恒温培养箱,培养至2龄。
1.2 siRNA hsp70获得
根据大豆蚜hsp70 mRNA(GenBank 登录号KF 771049)序列设计双链小干扰RNA,即siRNA hsp70(见表1),由上海吉玛制药技术有限公司合成。
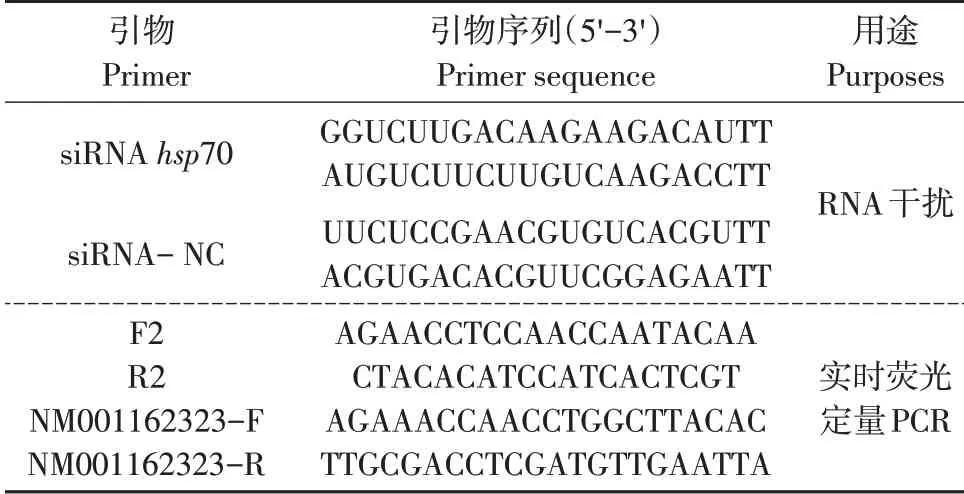
表1 引物信息Table 1 Primers information
1.3 siRNA hsp70干扰大豆蚜方法
siRNA hsp70 干扰浓度:根据预试验结果,当siRNA hsp70 浓度为0.33 μg·μL-1时,对hsp70 基因表达抑制效果良好,因此,选择该浓度为试验浓度。为更准确分析siRNA hsp70 干扰效果,本试验采用阴性和清水双对照,阴性对照为siRNA-NC,为无意义双链(由上海吉玛制药技术有限公司提供)(见表1),清水为空白对照。
采用饲喂法,将siRNA及阴性对照分别稀释至0.33 μg·μL-1,取5 μL 稀释液,加入含1%琼脂培养基培养皿中,将2.5 cm2大豆三出复叶迅速、平整贴在滴有处理液的琼脂培养基上,每皿放置10头2 龄大豆蚜。以清水作对照,设置1、2、3、12、24、48、72 h等7个取食时长处理,从观察到大豆蚜取食后开始计时,每个处理10 次重复,选取叶片保湿,大豆蚜活跃度一致2 龄大豆蚜为试验试虫。取食处理结束后将大豆蚜转移至1.5 mL EP 管中,饥饿处理1 h(每个时间处理各取30 头,用于RNA 提取;再各取30 头,每10 头放入一支EP管中,用于测定内源物质),-80 ℃保存。
1.4 siRNA hsp70干扰大豆蚜后转录表达量测定
为检测siRNA hsp70干扰后大豆蚜hsp70基因表达量,提取1.3处理后大豆蚜总RNA,反转成cDNA,根据大豆蚜hsp70基因设计实时荧光定量PCR引物F2 和R2(见表1),内参基因查询蚜虫模式昆虫所得,分别为NM001162323-F 和NM001162323-R(见表1)。荧光定量PCR 反应条件:95 ℃60 s;95 ℃15 s,59 ℃退火30 s,72 ℃延伸30 s,40个循环。采用2-△△Ct法作PCR相对定量分析。
1.5 siRNA hsp70干扰大豆蚜后内源物质及激素的测定方法
将经1.3处理的大豆蚜置于冰上,加入300 μL PBS 缓冲液,组织研磨器充分研磨,8 500 r·min-1离心10 min,取上清用于测定内源物质及激素含量。
总蛋白质检测参见TaKaRa Bradford Protein Assay Kit说明书。
总糖检测参照硫酸蒽酮法,参见北京索莱宝科技有限公司试剂盒说明书。
HSP70 蛋白、羧酸酯酶、谷胱甘肽S-转移酶、蜕皮激素、保幼激素检测参考双抗体夹心法,参见江苏酶标生物科技有限公司试剂盒使用说明书。
1.6 数据处理
数据采用Excel 2007 数据处理软件分析、作图,使用DPS 2006 软件作单因素方差分析,通过Ducan"s新复极差法作显著性检验。
2 结果与分析
2.1 siRNA对2龄大豆蚜hsp70基因表达的影响
由图1 可知,经siRNA hsp70 干扰的2 龄大豆蚜hsp70 表达量在1 h 时低于阴性对照,差异不显著,显著低于清水对照(P<0.05);2、3 h时显著低于阴性对照(P<0.05),极显著低于清水对照(P<0.01);12 h 时高于阴性对照,差异不显著,显著高于清水对照(P<0.05);24、48 h时极显著高于阴性和清水对照(P<0.01);72 h时显著高于阴性和清水对照(P<0.05)。
2.2 siRNA hsp70对2龄大豆蚜体内热休克蛋白70(HSP70)表达的影响
由图2 可知,HSP70 蛋白表达量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是阴性对照的1.0143、1.0750、0.6575、0.8984、0.7550、0.8749、0.8884 倍,与阴性对照相比,HSP70 蛋白表达量在1 h 时差异不显著,2、3、48 h 时差异极显著(P<0.01),12、24、72 h 时差异显著(P<0.05);HSP70 蛋白表达量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 时分别是清水对照的1.0290、 1.0729、0.7191、0.8339、0.7590、0.8405、0.9091倍,和清水对照相比,HSP70 蛋白表达量在1、72 h 时差异不显著,2、3、12、48 h 时差异极显著(P<0.01),24 h时差异显著(P<0.05)。
siRNA hsp70 处理组2 龄大豆蚜HSP70 蛋白表达量在1~2、3~12、24~72 h 呈上升趋势,2~3、12~24 h 呈下降趋势,72 h 时HSP70 蛋白表达量最高,为0.26084 pg·per-1,1 h 时HSP70 蛋白表达量最低,为0.08336 pg·per-1;阴性对照组2龄大豆蚜HSP70 蛋白表达量在1~3、24~72 h 呈上升趋势,3~24 h呈下降趋势,72 h时2龄大豆蚜HSP70蛋白表达量最高,为0.29361 pg·per-1,1 h时2龄大豆蚜HSP70 蛋白表达量最低,为0.08219 pg·per-1;清水对照组2 龄大豆蚜HSP70 蛋白表达量在1~12、24~72 h 呈上升趋势,12~24 h 呈下降趋势,72 h时2 龄大豆蚜HSP70 蛋白表达量最高,为0.28692 pg·per-1,1 h 时2 龄大豆蚜HSP70 蛋白表达量最低,为0.08102 pg·per-1。
2.3 siRNA hsp70对2龄大豆蚜体内内源物质的影响
由图3 可知,总蛋白质含量在siRNA hsp70 干扰2 龄大豆蚜1、2、3、12、24、48、72 h 后分别是阴性对照的0.9752、1.0707、0.8933、1.0267、0.9622、0.8937、0.9816 倍,与阴性对照相比,总蛋白质含量7个时间处理差异均不显著;总蛋白质含量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分 别 是 清 水 对 照 的1.0541、1.1510、0.9007、0.9783、0.9464、0.8993、0.8593倍,与清水对照相比,总蛋白质含量在7个时间处理差异均不显著。
siRNA hsp70 处理组和阴性对照组2 龄大豆蚜总蛋白质含量在1~2、3~72 h 呈上升趋势,2~3 h呈下降趋势,两处理均在72 h时2龄大豆蚜总蛋白质含量最高,分别为0.00431、0.00439 μg·per-1,3 h时2龄大豆蚜总蛋白质含量最低,分别为0.00198、0.00222 μg·per-1;清水对照组2龄大豆蚜总蛋白质含量在1~72 h呈上升趋势,72 h时2龄大豆蚜总蛋白质含量最高,为0.00501 μg·per-1,1 h时2龄大豆蚜总蛋白质含量最低,为0.00208 μg·per-1。
由图4可知,总糖含量在siRNA hsp70干扰2龄大豆蚜后1、2、3、12、24、48、72 h 分别是阴性对照的0.9690、0.9775、0.9759、0.9907、1.0042、1.0124、1.0439倍,与阴性对照相比,总糖含量在1、2 h 时差异显著(P<0.05),3、72 h 时差异极显著(P<0.01),12、24、48 h时差异不显著;总糖含量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是清水对照的0.9553、0.9629、0.9743、0.9851、1.0021、1.0369、1.0740倍,与清水对照相比,总糖含量在1 h时差异显著(P<0.05),2、3、48、72 h 时差异极显著(P<0.01),12、24 h时差异不显著。
siRNA hsp70 处理组和阴性对照组2 龄大豆蚜总糖含量在1~3、24~72 h 呈上升趋势,3~24 h 呈下降趋势,两处理皆在3 h 时2 龄大豆蚜总糖含量最高,分别为0.00867 和0.00889 μg·per-1,24 h时2 龄大豆蚜总糖含量最低,分别为0.00807 和0.00804 μg·per-1;清水对照组2 龄大豆蚜总糖含量在1~3 h呈上升趋势,3~72 h呈下降趋势,在3 h时2 龄大豆蚜总糖含量最高,为0.00890 μg·per-1,72 h 时2 龄大豆蚜总糖含量最低,为0.00801 μg·per-1。
由图5 可知,羧酸酯酶活性在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是阴性对照的0.6262、0.8642、1.2532、0.9447、0.9724、1.0357、1.0984 倍,与阴性对照相比,羧酸酯酶活性在1、2、3 h 时差异极显著(P<0.01),12、24、48、72 h时差异不显著;羧酸酯酶活性在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是清水对照的0.5766、0.8431、1.3595、1.0450、0.9790、1.0414、1.1050倍,与清水对照相比,羧酸酯酶活性在1、2、3 h差异极显著(P<0.01),12、24、48、72 h时差异不显著。
siRNA hsp70 处理组2 龄大豆蚜羧酸酯酶活性在1~3、24~72 h 呈上升趋势,3~24 h 呈下降趋势,3 h 时羧酸酯酶活性最高,为0.00070 U·per-1,1 h时羧酸酯酶活性最低,为0.00035 U·per-1;阴性和清水对照组2 龄大豆蚜羧酸酯酶活性在1~2 h 呈上升趋势,2~72 h 呈下降趋势,两种处理皆在2 h 时2 龄大豆蚜羧酸酯酶活性最高,分别为0.00065 和0.00067 U·per-1,在72 h 时2 龄大豆蚜羧酸酯酶活性最低,均为0.00039 U·per-1。
由图6可知,谷胱甘肽S-转移酶活性在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是阴性对照的1.0127、0.9550、1.0553、1.0292、1.0183、0.9766、0.9747 倍,与阴性对照相比,谷胱甘肽S-转移酶活性在1、12 h时差异不显著,2、3、48 h 时差异极显著(P<0.01),24、72 h时差异显著(P<0.05);谷胱甘肽S-转移酶活性在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是清水对照的1.0079、0.9608、1.0737、1.0679、1.0388、0.9754、0.9518倍,与清水对照相比,谷胱甘肽S-转移酶活性在1 h差异不显著,2、3、12、24、48、72 h 时差异极显著(P<0.01)。
siRNA hsp70 处理组2 龄大豆蚜谷胱甘肽S-转移酶活性在1~2、3~72 h 呈下降趋势,2~3 h 呈上升趋势,3 h 时2 龄大豆蚜谷胱甘肽S-转移酶活性最高,为0.00016 IU·per-1,72 h 时谷胱甘肽S-转移酶活性最低,为0.00014 IU·per-1;阴性对照组2龄大豆蚜谷胱甘肽S-转移酶活性在1~2 h呈上升趋势,2~72 h 呈下降趋势,2 h 时2 龄大豆蚜谷胱甘肽S-转移酶活性最高,为0.00016 IU·per-1,72 h时2 龄大豆蚜谷胱甘肽S-转移酶活性最低,为0.00014 IU·per-1;清水对照组2龄大豆蚜谷胱甘肽S-转移酶活性在1~2、24~72 h呈上升趋势,2~24 h呈下降趋势,2 h 时2 龄大豆蚜谷胱甘肽S-转移酶活性最高,为0.00016 IU·per-1,24 h时2龄大豆蚜谷胱甘肽S-转移酶活性最低,为0.00014 IU·per-1。
2.4 siRNA hsp70对2龄大豆蚜体内激素表达的影响
由图7 可知,蜕皮激素含量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是阴性对照的0.8023、0.8844、1.5699、1.1127、1.0423、0.8887、0.8151 倍,与阴性对照相比,蜕皮激素含量在1、3、12、48、72 h 差异极显著(P<0.01),2、24 h 差异显著(P<0.05);蜕皮激素含量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分 别 是 清 水 对 照 的0.8133、0.8590、1.6458、1.3603、1.0237、0.8482、0.8083倍,与清水对照相比,蜕皮激素含量在1、2、3、12、48、72 h差异极显著(P<0.01),24 h差异不显著。
siRNA hsp70 处理组2 龄大豆蚜蜕皮激素含量在1~2、3~12 h呈上升趋势,2~3、12~72 h呈下降趋势,2 h 时2 龄大豆蚜蜕皮激素含量最高,为0.00025 ng·per-1,1 h时2龄大豆蚜蜕皮激素含量最低,为0.00010 ng·per-1;阴性对照组2龄大豆蚜蜕皮激素含量在1~2、3~12、24~72 h 呈上升趋势,2~3、12~24 h 呈下降趋势,2 h 时2 龄大豆蚜蜕皮激素含量最高,为0.00029 ng·per-1,1 h 时2 龄大豆蚜蜕皮激素含量最低,为0.00013 ng·per-1;清水对照组2 龄大豆蚜蜕皮激素含量在1~2、3~72 h 呈上升趋势,2~3 h呈下降趋势,2 h时2龄大豆蚜蜕皮激素含量最高,为0.00030 ng·per-1,1 h 时2 龄大豆蚜蜕皮激素含量最低,为0.00012 ng·per-1。
由图8 可知,保幼激素含量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是阴性对照的0.8393、1.1783、0.8753、1.4054、0.9731、1.0117、0.9318 倍,与阴性对照相比,1、3、12 h时差异极显著(P<0.01),2、72 h差异显著(P<0.05),24、48 h差异不显著;保幼激素含量在siRNA hsp70 干扰2 龄大豆蚜后1、2、3、12、24、48、72 h 分别是清水对照的0.9104、1.1656、0.8798、1.7140、0.9948、0.9840、0.9486倍,与清水对照相比,保幼激素含量在1、2、72 h 差异显著(P<0.05),3、12 h 差异极显著(P<0.01),24、48 h差异不显著。
siRNA hsp70 处理组2 龄大豆蚜保幼激素含量1~2、3~24 h 呈上升趋势,2~3、24~72 h 呈下降趋势,24 h 时2 龄大豆蚜保幼激素含量最高,为0.00150 ng·per-1,1 h时2龄大豆蚜保幼激素含量最低,为0.00039 ng·per-1;阴性和清水对照组2龄大豆蚜保幼激素含量1~3、12~24 h 呈上升趋势,3~12、24~72 h呈下降趋势,两种处理皆在24 h时保幼激素含量最高,分别为0.00154和0.00151 ng·per-1,其含量皆在1 h 时最低,分别为0.00047 和0.00043 ng·per-1。
3 讨论与结论
本研究发现,经siRNA hsp70(0.33 μg·μL-1)干扰2龄大豆蚜并未死亡,与大豆蚜取食量有关,大豆蚜通过刺吸含siRNA hsp70 大豆汁液对其产生影响,虽不致大豆蚜死亡,但对大豆蚜hsp70 表达量、HSP70 蛋白表达量、总蛋白质含量、总糖含量、羧酸酯酶活性、谷胱甘肽S-转移酶活性、蜕皮激素含量、保幼激素含量在7个时长处理组产生不同程度影响。
本研究发现,siRNA hsp70 干扰2 龄大豆蚜1~3 h时,hsp70基因表达量被抑制,干扰3~72 h表现为促进hsp70 基因表达,表达高蜂出现在24 h,表明大豆蚜为减弱干扰而发生补偿性表达,与Jarosch等[15]、王锦达[16]研究结果一致。张伟研究认为,RNA干扰产生基因沉默并非固定不变[17]。
干扰后补偿表达在大豆蚜HSP70 蛋白表达量、总糖含量、羧酸酯酶活性、谷胱甘肽S-转移酶活性、蜕皮激素含量、保幼激素含量中表现,与大豆蚜在干扰压力下启动自我应激保护作用有关。
经siRNA hsp70 干扰后,2 龄大豆蚜HSP70 蛋白表达量在2 h 时极显著高于阴性和清水对照(P<0.01),可能是大豆蚜受siRNA hsp70干扰时,启动应激保护致HSP70 蛋白表达量上升;在3~72 h 时呈波动变化,但始终低于阴性和清水对照组,siRNA hsp70 干扰对HSP70 蛋白表达有抑制作用,但两者无线性关系,因HSP70蛋白由hsp70 家族基因共同调控。HSP70蛋白作为应激蛋白可稳定细胞结构,使细胞维持正常生理功能[18],此时HSP70蛋白含量下降是修复其他被破坏功能蛋白结构所致。
siRNA hsp70干扰后,7个时间处理的2龄大豆蚜总蛋白质含量与阴性和清水对照组差异均不显著,表明siRNA hsp70 干扰虽使HSP70 蛋白表达相对对照差异显著,对总蛋白未产生显著影响。但对总糖含量产生影响,干扰压力可激发体内一些糖代谢反应。
研究发现,作为解毒酶的羧酸酯酶活性在siRNA hsp70干扰2龄大豆蚜1、2 h时均极显著低于对照组,3 h 时极显著高于对照组,呈先抑制后补偿效应,之后12~72 h羧酸酯酶活性差异不显著,干扰对羧酸酯酶活性变化影响不明显,这一结果与王龙江等球孢白僵菌对羧酸酯酶活性影响随时间延长无显著抑制作用一致[19];而作为解毒酶的谷胱甘肽S-转移酶活性在经siRNA hsp70干扰后,呈较大波动,2 h时谷胱甘肽S-转移酶活性表现为极显著低于对照组,3 h 时表现为极显著高于对照组,至48 h 处理组呈极显著低于对照组,从两种酶经siRNA hsp70 干扰后活性变化看,干扰对谷胱甘肽S-转移酶活性影响更大。
siRNA hsp70 干扰2 龄大豆蚜对其体内蜕皮激素、保幼激素含量变化产生明显影响,干扰后蜕皮激素是3、12 h处理组出现补偿性极显著高于对照组,1、2、48、72 h 处理组均显著低于对照组,而保幼激素含量在2、12 h 处理组显著高于对照组,1、3、72 h处理组均显著低于对照组,蜕皮激素、保幼激素在经siRNA hsp70 干扰后含量变化说明这种干扰对大豆蚜繁殖产生影响。这与Kosano和Prapapanich等研究结果一致[20-21],但具体调节机制有待进一步研究。
本研究结果表明,大豆蚜受siRNA hsp70 干扰后其体内内源物质及激素发生变化,表明干扰引起大豆蚜体内相应代谢变化,为干扰技术应用于害虫防治提供技术支持,可在干扰后大豆蚜处于自我保护最薄弱时施药(本研究为干扰3 h 时最薄弱),在不增加施药量情况下,提高防治效果。

