CD22 CAR-T挽救治疗CD19 CAR-T治疗后短期复发的TP53突变阳性难治急性B淋巴细胞白血病一例
穆娟,吕海容,李静怡,江嫣雨,张蕊,孟娟霞,袁婷,邓琦
成人急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是最常见的成人急性白血病之一,占成人急性白血病的20%~30%[1]。携带TP53基因突变的B细胞ALL患者缓解率低、易复发、生存差,异基因造血干细胞移植是其公认的有望得到治愈的治疗手段[2-3]。采用抗CD19嵌合抗原受体修饰(chimeric antigen receptor,CAR)的T细胞治疗复发/难治性(relapsed or refractory,R/R)B细胞ALL可达70%~90%的应答率[4-5]。CD22在B淋巴细胞中也有表达,对于CD19 CAR-T治疗失败的患者,可采用CD22 CAR-T细胞治疗。我院收治1例携带TP53基因突变的难治性Ph-ALL患者,经自体CD19 CAR-T细胞治疗缓解后14 d复发,其外周血CD19 CAR-T细胞消失的同时检测到CD19 CAR的DNA拷贝数异常增高;后予以自体CD22 CAR-T细胞治疗达到完全缓解(complete response,CR),桥接单倍体异基因造血干细胞移植治疗,病情稳定,现报告如下。
1 病例报告
1.1 病例资料 患者 女,31岁。主因乏力、皮肤出血点伴低热10 d,于2018年6月7日入本院。患者10 d前无诱因出现乏力、皮肤出血点,伴有发热,体温最高37.4℃,就诊于当地医院,查血常规:白细胞计数3.4×109/L,血红蛋白132 g/L,血小板计数33×109/L。骨髓穿刺:急性淋巴细胞白血病,原幼淋巴细胞93%,为进一步治疗于我院就诊。既往体健。入院血常规:白细胞计数8.71×109/L,血红蛋白100 g/L,血小板计数35×109/L。骨髓细胞学:急性淋巴细胞白血病,增生活跃,原淋89%;白血病免疫分型(图1):93.9%细胞为恶性原始B淋巴细胞,表达CD19+CD10+CD20+CD38+CD22+,部分表达CD33+;TP53基因突变:89%;急性白血病43种融合基因阴性;染色体:正常。查体:双侧颈部、腋下腹股沟均可触及肿大淋巴结。颈部及胸腹CT:颈部、双侧腋窝及纵隔内、腹腔、腹膜后及双侧腹股沟多发增大淋巴结。确诊为携带TP53基因突变的Ph-急性B淋巴细胞白血病。明确诊断后给予VDCP方案诱导化疗:环磷酰胺1.2 g第1天,柔红霉素40 mg/m2第1~3天,长春地辛4 mg第1、8、15、22天,泼尼松60 mg/d第1~14天、第15~28天逐渐减量。化疗结束复查骨髓细胞学:原始淋巴细胞12.5%,白血病免疫分型:13.31%为恶性原始淋巴细胞,提示为部分缓解(partial remission,PR)。再次予以原方案诱导28 d,复查骨髓细胞学:原始淋巴细胞55.5%、白血病免疫分型(图1):74.09%为恶性原始淋巴细胞,疗效评诂为未缓解(non-remission,NR)。TP53基因突变为74.5%。
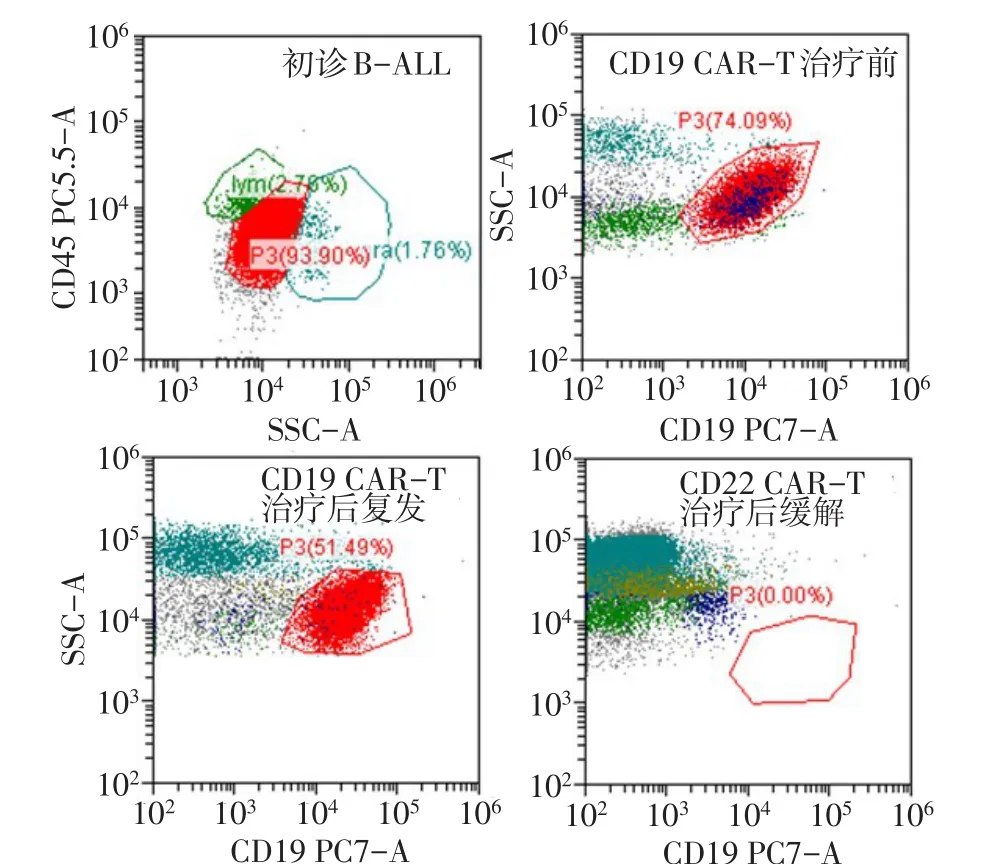
Fig.1 Flow diagram of the patient图1 患者流式细胞图
1.2 检测方法 急性淋巴细胞白血病的免疫分型诊断、骨髓及外周血CD19 CAR-T、CD22 CAR-T细胞的检测,采用流式细胞术检测。CD19 CAR-T、CD22 CAR-T细胞DNA水平的检测采用实时定量PCR方法。
1.3 CD19 CAR-T细胞治疗 患者以难治B细胞ALL入组“CD19 CAR-T治疗复发难治B细胞淋巴瘤及急性B淋巴细胞白血病(ChiCTR-ONN-16009862)”临床试验。单采自体外周血单个核细胞行CD3磁珠分选作为培养CD19 CAR-T细胞的T细胞来源。经FA方案预处理:氟达拉滨30 mg/m2第1~5天,阿糖胞苷1 g/m2第1~5天;分次回输二代CD19 CART细胞:第1次回输1×106/kg,第2次回输1×106/kg。回输第1天开始出现持续高热,回输第13天体温恢复正常,回输日至回输第14天体温(38.20±1.27)℃,伴有畏寒、寒战、咽痛;监测生命体征和临床症状稳定(表1)。C反应蛋白、细胞因子升高(表2)。于回输第0、4、7、14、21、28天监测外周血CD19 CAR-T细胞(图2);并进行CAR19的DNA检测(图3)。于回输第12天体温恢复正常,评估细胞因子释放综合征(cytokine-release syndrome,CRS)2级[6],予以非甾体抗炎药对症处理及支持治疗。于回输第14天复查骨髓涂片:增生活跃(-),未见原始幼稚淋巴细胞;白血病免疫分型:未见原始B淋巴细胞,疗效评估达完全缓解,TP53基因突变38.44%。
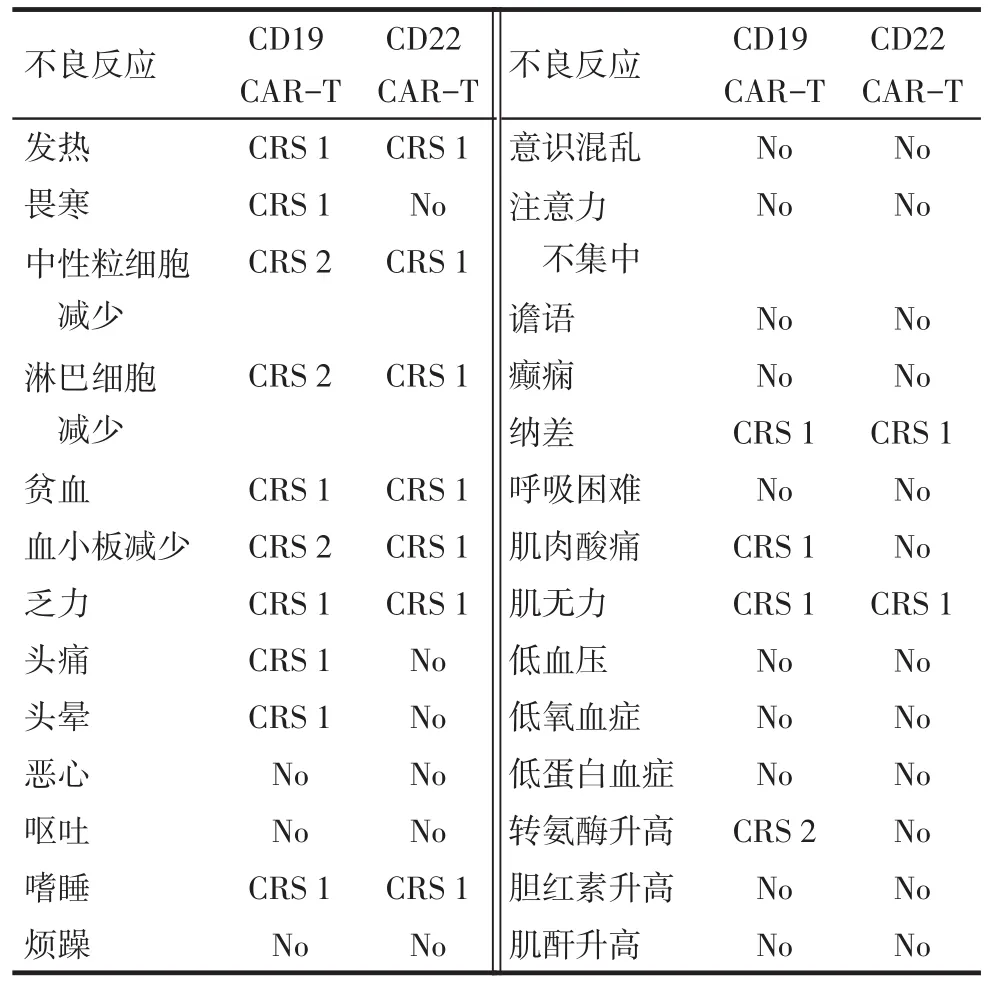
Tab.1 The side effects of CD19 CAR-T and CD22 CAR-T cell treatment表1CD19 CAR-T和CD22 CAR-T细胞治疗的不良反应观察
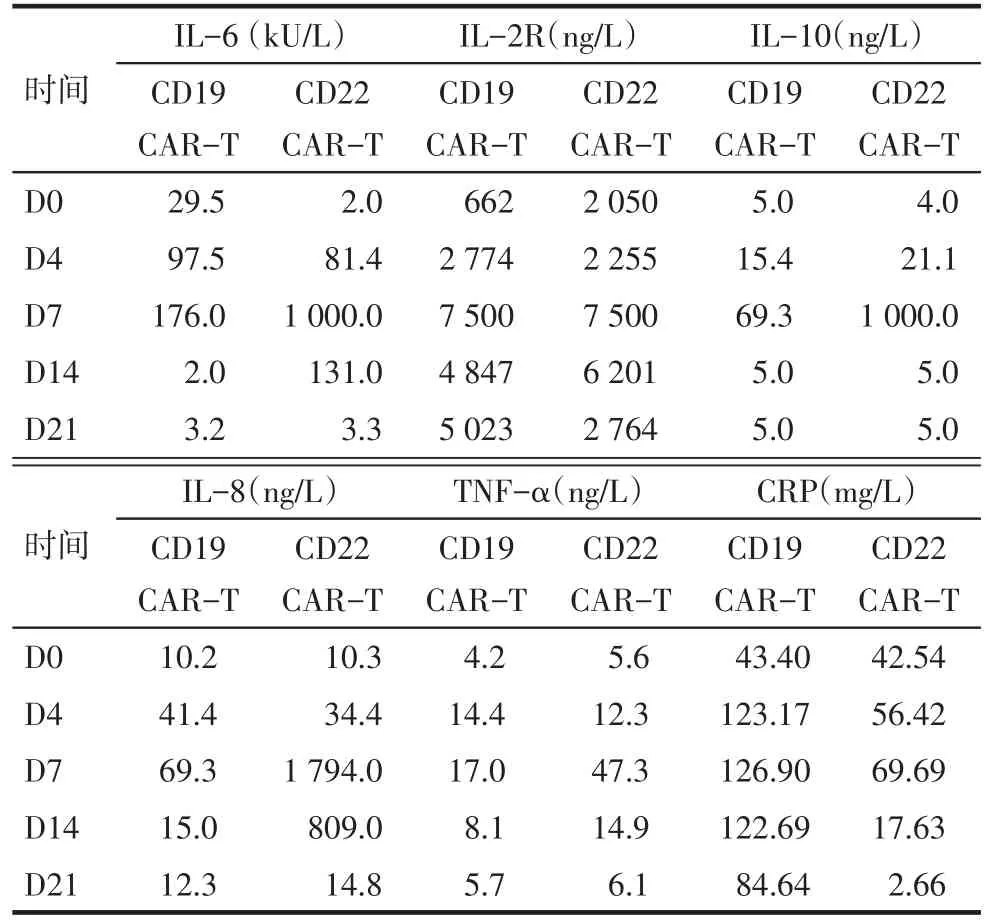
Tab.2 Changes in cytokine levels in CD19 CAR-T and CD22 CAR-T cell treatment表2CD19 CAR-T和CD22 CAR-T细胞治疗的细胞因子水平变化
1.4 CD19 CAR-T细胞治疗缓解后的短期复发 患者达CR 2周后返院预行同胞全合异基因造血干细胞移植,复查骨髓涂片提示骨髓复发;白血病免疫分型(图1)提示51.49%为原始B淋巴细胞,表达CD19+CD10+CD20+CD38+CD22+。患者外周血CD19 CAR-T比例为0,CD19 CAR的DNA水平为424 000.3 Copies/ng gDNA,TP53基因突变52.25%。将患者第1次CAR-T治疗冻存的外周血单个核细胞复苏,重新进行CD3磁珠分选CD3+T细胞体外培养,于体外培养第4天(CD19病毒转染日)进行流式检测,可见培养体系存在1.41%的CD19+CD10+ALL细胞残留(图4)。
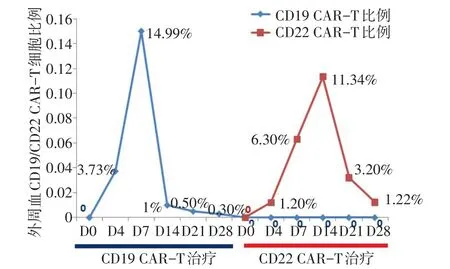
Fig.2 Changes in the proportion of peripheral blood CAR-T cells图2 两次CAR-T细胞治疗外周血CAR-T细胞比例变化
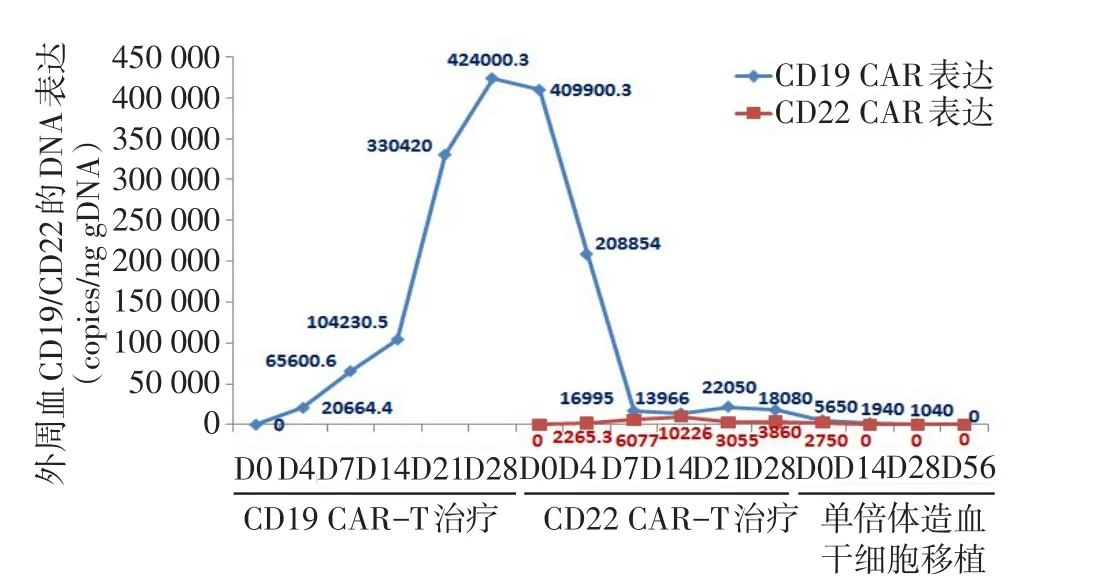
Fig.3 Changes of expression of CAR gene图3 两次CAR-T细胞治疗外周血CAR基因表达变化
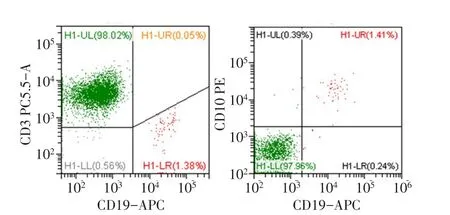
Fig.4 ALL cells remaining in the system during the preparation of CAR-T图4 CD19 CAR-T细胞制备过程中体系残留的ALL细胞
1.5 CD22 CAR-T细胞治疗 患者CD19 CAR-T细胞治疗短暂缓解后复发,以复发难治B细胞ALL病例入组“CD22 CAR-T治疗复发难治B细胞淋巴瘤/急性B淋巴细胞白血病(ChiCTR1800019298)”临床试验。经地西他滨+FLAG[地西他滨20 mg/m2第1~5天,粒细胞集落刺激因子(G-CSF)75µg第2天-中性粒细胞恢复,氟达拉滨30 mg/m2第3~7天;阿糖胞苷1 g/m2第3~7天]预处理,回输二代CD22 CAR-T细胞:回输日2.61×106/kg。回输第1天出现发热,体温最高38.3℃,很快下降,无其他不适(表1)。C反应蛋白、细胞因子升高(表2)。于回输第0、4、7、14、21、28天检测到外周血CD22 CAR-T细胞,未检测到CD19 CAR-T细胞;并进行外周血CD19 CAR和CD22 CAR的DNA检测(图2、3)。评估CRS为1级。于第14天复查骨髓涂片:增生活跃-,未见原始幼稚淋巴细胞;白血病免疫分型(图1):未见原始B淋巴细胞,疗效评估达完全缓解,TP53基因突变阴性。全身弥散磁共振:颈部及纵隔内、腹腔、腹膜后及双侧腹股沟未见增大淋巴结,双侧腋窝多发小淋巴结,考虑良性。
1.6 单倍体异基因造血干细胞移植治疗 患者病情稳定,移植前外周血CD22 CAR-T细胞比例1.3%,CD19 CAR-T细胞0。外周血CD19 CAR的DNA水平22 050 Copies/ng gDNA;CD22 CAR的DNA水平3 055 Copies/ng gDNA。放弃同胞全和供者,选择父供女单倍体异基因造血干细胞移植(含地西他滨:20 mg/m2移植前14 d至移植前10 d桥接的预处理方案),过程顺利。移植后14 d复查骨髓涂片及白血病免疫分型:未见原始B淋巴细胞;供者嵌合98.53%;TP53基因突变阴性。外周血CD22 CAR-T细胞0,CD19 CAR-T细胞0。外周血CD19 CAR的DNA检测1 940 Copies/ng gDNA;CD22 CAR的DNA检测阴性。于移植后28 d给予供者淋巴细胞输注(CD3+细胞1.7×107/kg),CD19 CAR的DNA水平进一步下降。患者于移植后58 d高热、皮疹、口腔溃疡,考虑急性移植物抗宿主病Ⅰ级,给予糖皮质激素缓解。目前移植后10个月,供者嵌合99.63%、TP53基因突变阴性,CD19 CAR和CD22 CAR的DNA水平仍保持阴性,拟继续给予移植后维持治疗,并密切观察疾病转归情况。
2 讨论
CAR-T治疗是近20年来极具发展前景的肿瘤过继免疫细胞治疗方法[7],其中针对难治复发急性B淋巴细胞白血病的抗CD19 CAR-T细胞表现出令人满意的疗效[8]。尽管CD19 CAR-T在急性B淋巴细胞白血病中有显著的临床效果,但多数患者很快复发,B淋巴细胞表面CD19表达丢失或减少是CD19 CAR-T治疗失败或缓解后复发的重要因素[9-10],但其机制尚不明确,可能是多因素作用的结果[9,11]。
本例患者在CD19 CAR-T治疗缓解后2周复发,为CD19+复发。笔者发现,其外周血CD19 CAR-T细胞消失的同时,检测到异常高表达的CD19 CAR基因,且TP53表达再度升高。遗憾的是患者复发时未能留取骨髓标本,不能进行流式分选以检测CD19 CAR基因是否存在于白血病细胞中。有文献报道1例复发B-ALL患者在接受CD19 CAR-T治疗缓解并进行造血干细胞移植治疗后9个月复发。其复发的白血病细胞为CD19-表达,但该白血病异常表达抗CD19 CAR基因,证实CD19 CAR基因被引入了单个白血病细胞中,导致最终的CD19-复发。其机制在于CD19 CAR基因的转入,与自体白血病细胞表面的CD19表位结合,使其CD19不表达,从而不能被CD19 CAR-T细胞所识别导致复发[12]。本例患者CD19 CAR-T治疗缓解后2周复发,与其CD19 CAR-T细胞制备过程中CD3磁珠分选的CD3+T细胞存在1.41%的白血病细胞残留有关,还是与TP53基因突变有关需进一步研究验证。
该患者复发后马上接受CD22 CAR-T细胞治疗获得第2次完全缓解,而且其TP53基因突变亦转阴,继而桥接单倍体造血干细胞移植治疗。随着供者干细胞的植入,患者体内异常高表达的CD19 CAR基因水平明显降低,但CD19 CAR基因水平的降低,是移植物还是移植过程中糖皮质激素的作用,笔者将继续深入研究并追踪此病例,监测其CD19 CAR基因表达水平变化,以及是否与其移植后复发具有相关性。
本例另外一个特点是其TP53基因突变为89%,为预后不良、成为难治ALL病例的重要因素之一[13]。本例治疗过程中,在CD22 CAR-T细胞治疗的预处理和异基因造血干细胞移植的预处理中,均采用了地西他滨的联合治疗,以提高疗效[14-15]。但TP53基因突变是否与CD19 CAR-T治疗缓解后2周复发具有相关性,也需进一步探讨,也是笔者继续追踪该患者移植后情况的一个重要观察指标。
CD22同样在B淋巴细胞上表达,成为难治复发急性B淋巴细胞白血病的另外一个CAR-T细胞治疗靶点[16]。CD22在大多数急性B淋巴细胞白血病病例中也表达,而且通常在免疫治疗后复发的患者中,白血病细胞CD19缺失后仍有CD22的表达,理论上可以作为CD19-复发的难治复发急性B淋巴细胞白血病患者的挽救治疗。有报道采用CD22CAR-T细胞治疗21例难治复发急性B淋巴细胞白血病,17例患者既往接受过CD19单抗免疫治疗,其中15例患者接受过CD19 CAR-T细胞治疗,其CD19均为阴性或者弱阳性,治疗结果CR率可达73%,且安全性良好[17]。此研究进而设计了一个针对CD19和CD22的双特异性CAR-T细胞小鼠动物实验,对于CD19+CD22+、CD19-CD22+的急性B淋巴细胞白血病细胞均具有良好的杀瘤效果,提示在难治复发急性B淋巴细胞白血病的诱导缓解方面可能更有效。对于本例患者,复发时大量CD19+CD22+白血病细胞,同时高表达的CD19 CAR基因,笔者给予患者CD22 CAR-T细胞治疗,期间CRS为1级,不良反应较CD19 CAR-T治疗轻,并获得完全缓解,直至接受异基因造血干细胞移植治疗,与上述文献报道结果相似。
总之,在CAR-T细胞的制备过程中应注意进一步提高磁珠分选CD3+细胞的纯度、避免混入白血病细胞;另外一个方面CD22 CAR-T治疗可以作为CD19 CAR-T治疗复发的一个挽救治疗措施、或与CD19 CAR-T联合使用以提高疗效。

