高迁移率族蛋白1在醛固酮诱导肾小管上皮细胞自噬中的作用
毛楠,林定彪,马欣,陈鸿禧,周琬秋,王少清△
慢性肾脏病(chronic kidney disease,CKD)是威胁人类健康的重大疾病之一,已经成为全球性公共健康问题,其发病率、致残率和病死率高,给个人、家庭及社会造成极大的经济负担。醛固酮(aldosterone,ALDO)是CKD进展的一个关键递质,直接参与肾小管损伤及肾脏纤维化的发生和发展。笔者既往研究发现,ALDO可促进大鼠肾小管上皮细胞(NRK-52E)内活性氧(reactive oxygen species,ROS)的释放,通过AMPK/mTOR信号通路诱导NRK-52E细胞发生自噬[1]。大量研究证实,高迁移率族蛋白1(high mobility group box 1,HMGB1)与细胞自噬存在密切的关系[2]。HMGB1作为一种新型的炎性细胞因子,广泛分布于淋巴组织、心、肝、肺、脾、肾、脑等组织中,其本身很少或者无促炎症活性,但当它与炎症介质结合时,可激活和趋化炎症细胞,诱导大量炎症因子的分泌和释放,进而激发一系列炎症反应[3]。笔者推测HMGB1可能是ALDO诱导NRK-52E细胞自噬的重要中介因素。本研究拟采用ALDO致肾小管上皮细胞损伤模型,探讨HMGB1在ALDO诱导NRK-52E细胞自噬中的作用,为慢性肾脏病的防治提供新靶点和新思路。
1 材料与方法
1.1 材料
1.1.1 细胞 大鼠肾小管上皮细胞(NRK-52E)购自中科院干细胞库/干细胞技术平台,课题组既往研究已验证该细胞的生物学特性[1]。
1.1.2 药物与试剂 醛固酮、N-乙酰半胱氨酸(美国Sigma公司);DMEM培养基、10%胎牛血清(FBS)、胰蛋白酶(美国Hyclone公司);兔抗大鼠白细胞介素(IL)-1β多克隆抗体、兔抗大鼠LC3B多克隆抗体、兔抗大鼠Beclin-1多克隆抗体、辣根过氧化物酶标记羊抗兔IgG(美国CST公司);兔抗HMGB1多克隆抗体,兔抗p62多克隆抗体(英国Abcam公司);兔抗大鼠β-actin单克隆抗体(北京博奥森生物技术有限公司);2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA)活性氧荧光探针试剂盒(上海碧云天生物有限公司)。
1.1.3 主要仪器 细胞培养箱(美国Thermo公司);无菌操作台(德国Heraeus公司);流式细胞仪(FACSAria,美国BD Bioscience公司);冷冻离心机(德国SORVALL-fresco公司);高速低温台式离心机(德国Heraeus公司);垂直/水平电泳槽(上海天能);水平电泳仪、Trans-blot电转移槽、图像采集与分析仪(美国Bio-rad公司)。
1.2 方法
1.2.1 细胞培养及分组 将正常大鼠肾小管上皮细胞(NRK-52E)培养于含10%胎牛血清的DMEM培养基中,细胞于37℃、5%CO2培养箱中培养,每2~3 d传代1次,待细胞融合至80%时,改为无血清DMEM培养基饥饿24 h,使其生长同步化后进行以下实验。
1.2.2 ROS检测 将密度为1.0×105个/孔的NRK-52E细胞接种在6孔板中过夜,分为Control组、ALDO组(加入ALDO 10 nmol/L)、HMGB1抗体组(加入1 mg/L HMGB1)、IgG组(加入1 mg/L IgG)、ALDO+HMGB1抗体组(1 mg/L HMGB1抗体预处理1 h,再加入10 nmol/L ALDO)和阳性对照组(加入活性氧供氢体Rosup100µmol/L),以上各组均干预24 h,每组3个复孔。取10µL DCFH-DA探针,用20 mL无血清培养液稀释DCFH-DA探针,使其终浓度为5µmol/L。收集上述各组干预24 h后的细胞,悬浮于1 mL稀释好的DCFH-DA中,37℃细胞培养箱内孵育30 min(每隔3~5 min颠倒混匀一下,使探针和细胞充分接触);用无血清DMEM细胞培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA;应用流式细胞仪488 nm激发波长,525 nm发射波长检测NRK-52E细胞的ROS水平。细胞内的ROS可以氧化无荧光的DCFH生成有荧光的2',7'-二氯荧光素(2',7'-Dichlorofluorescein,DCF),绿色荧光强度与细胞内ROS水平成正比,即细胞内ROS水平=DCF荧光强度。
1.2.3 Western blot检测IL-1β蛋白的表达 此部分实验设Control组、ALDO组(加入10 nmol/L ALDO)、NAC组(加入50µmol/L NAC)、NAC+ALDO组(50µmol/L NAC预处理NRK-52E细胞1 h后,再加入10 nmol/L ALDO),各组均干预24 h,每组3个复孔。收集各实验组细胞后提取蛋白,BCA法测蛋白浓度。将40µg总蛋白提取液与4×SDS缓冲液混匀,100℃加热变性8 min,聚丙烯酰胺凝胶电泳分离,电转至PVDF膜;5%脱脂牛奶室温封闭2 h,加入兔抗大鼠IL-1β多克隆抗体(1∶1 000),4℃过夜;TBST缓冲液漂洗8 min×3次;加入辣根过氧化物酶标记羊抗兔IgG(1∶6 000),37℃孵育2 h,TBST缓冲液清洗5 min×3次,避光加入ECL发光剂,X线常规显影、定影并进行灰度分析。
1.2.4 ALDO对NRK-52E细胞HMGB1蛋白表达的影响 取对数生长期的NRK-52E细胞,分为Control组和ALDO组(10 nmol/L),干预24 h后提取蛋白,BCA法测蛋白浓度。将40µg总蛋白提取液与4×SDS缓冲液混匀,100℃加热变性8 min,聚丙烯酰胺凝胶电泳分离,电转至PVDF膜;5%脱脂牛奶室温封闭2 h,加入兔抗HMGB1多克隆抗体(1∶1 000),4℃过夜;TBST缓冲液漂洗8 min×3次;加入辣根过氧化物酶标记羊抗兔IgG(1∶6 000),37℃孵育2 h,TBST缓冲液清洗5 min×3次,避光加入ECL发光剂,X线常规显影、定影并进行灰度分析。
1.2.5 阻断HMGB1对ALDO诱导NRK-52E细胞自噬的影响 此部分实验设为Control组、ALDO组(加入10 nmol/L ALDO)、HMGB1抗体组(加入1 mg/L HMGB1抗体)和ALDO+HMGB1抗体组(1 mg/L HMGB1抗体预处理1 h后,再加入10 nmol/L ALDO),各组均干预24 h,参照1.2.4中的步骤,Western blot法检测LC3-Ⅱ、Beclin-1和p62蛋白的表达。
1.3 统计学方法 实验重复3次,所有结果均采用SPSS 22.0统计软件处理,计量资料用x±s表示,两样本均数比较采用t检验,独立的多样本均数的比较采用单因素方差分析,组间多重比较采用LSD-t检验,两因素水平的样本均数比较采用析因方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 醛固酮可诱导NRK-52E细胞内ROS产生增加 流式细胞仪检测结果显示,与Control组比较,ALDO组、ALDO+HMGB1抗体组和Rosup组ROS水平明显升高(P<0.05);与ALDO组比较,HMGB1抗体组、IgG组和ALDO+HMGB1抗体组ROS水平显著降低(P<0.05),Rosup组ROS水平升高(P<0.05);与HMGB1抗体组比较,ALDO+HMGB1抗体组和Rosup组ROS水平升高(P<0.05);与IgG组比较,ALDO+HMGB1抗体组和Rosup组ROS水平升高(P<0.05);与Rosup组比较,ALDO+HMGB1抗体组ROS水平降低(P<0.05);Control组、HMGB1抗体组和IgG组组间两两比较差异无统计学意义。即ROS水平:Rosup组>ALDO组>ALDO+HMGB1抗体组>HMGB1抗体组/Control组/IgG组,见表1、图1。
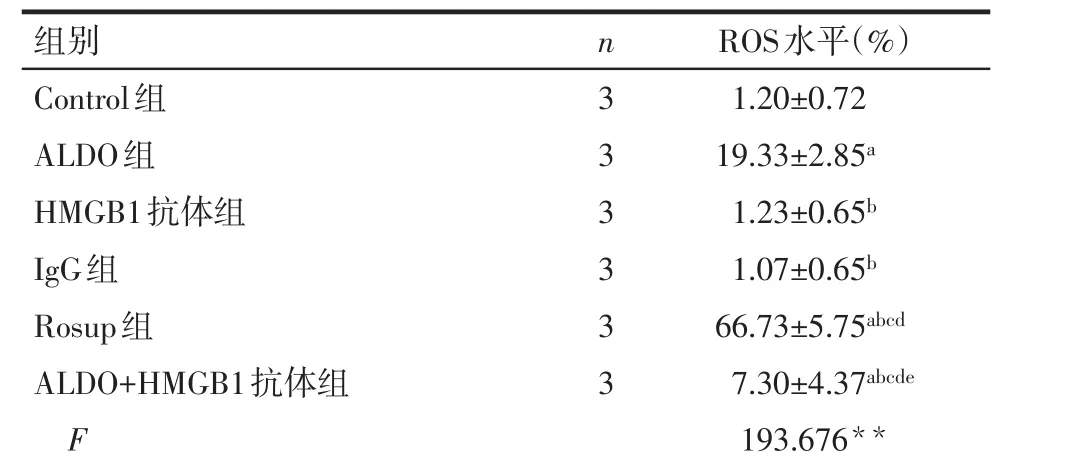
Tab.1 Effects of different intervention conditions on ROS levels in NRK-52E cells表1 各组不同干预条件对NRK-52E细胞内ROS水平的影响 (x±s)
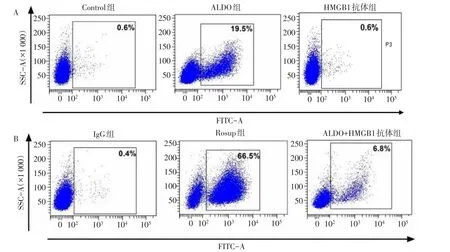
Fig.1 Effects of different intervention conditions on ROS level in NRK-52E cells图1 各组不同干预条件对NRK-52E细胞内ROS水平的影响
2.2 ALDO对NRK-52E细胞IL-1β蛋白表达的影响 由表2析因方差分析结果可得,PALDO<0.05,即ALDO可上调IL-1β蛋白的表达;PNAC>0.05,即NAC对 IL-1β 蛋白的表达无影响;PALDO×NAC<0.05,即ALDO与NAC两因素间存在交互作用,且对IL-1β蛋白表达有抑制作用,见表2、图2。
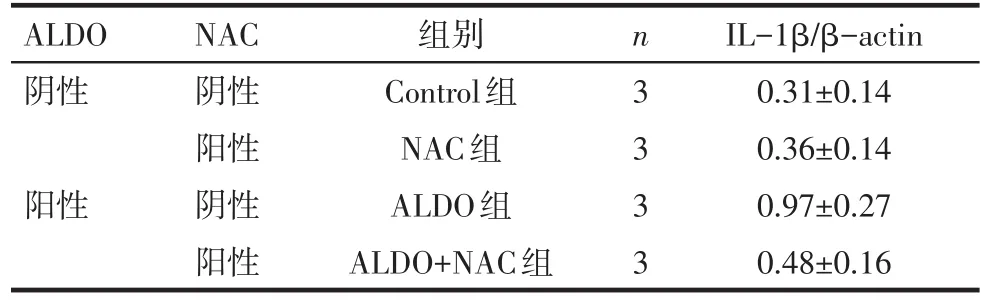
Tab.2 Effects of aldosterone on the expression of IL-1β in NRK-52E cells表2ALDO对NRK-52E细胞IL-1β蛋白表达的影响(n=3,x±s)

Fig.2 Effects of aldosterone on the expression of IL-1β protein in NRK-52E cells图2 ALDO对NRK-52E细胞IL-1β表达的影响
2.3 ALDO对NRK-52E细胞HMGB1蛋白表达的影响 与Control组(0.33±0.13)比较,ALDO组(0.56±0.05)HMGB1蛋白的表达上调(n=3,t=2.841,P<0.05),见图3。
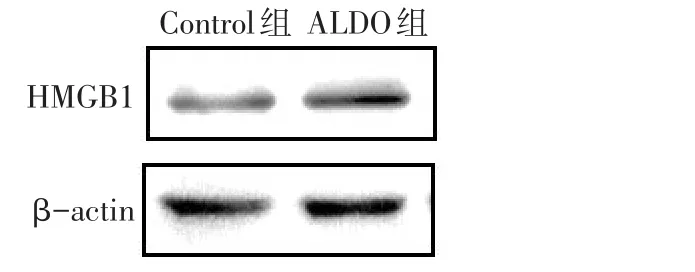
Fig.3 Effects of aldosterone on HMGB1 protein expression in NRK-52E cells图3ALDO对NRK-52E细胞HMGB1表达的影响
2.4 阻断HMGB1改善ALDO诱导的NRK-52E细胞自噬 Western blot结果显示,与Control组比较,ALDO组LC3-Ⅱ、Beclin-1蛋白表达上调,p62蛋白表达下调(P<0.05)。与ALDO组比较,ALDO+HMGB1抗体组LC3-Ⅱ蛋白表达降低、p62蛋白表达增加(P<0.05),Beclin-1蛋白的表达差异无统计学意义。与HMGB1组相比,ALDO+HMGB1抗体组Beclin-1蛋白的表达增加(P<0.05)。在Control组、HMGB1抗体组、ALDO+HMGB1抗体组间LC3-Ⅱ、p62蛋白表达差异无统计学意义;Control组、HMGB1抗体组间Beclin-1蛋白表达差异无统计学意义,见表3、图4。
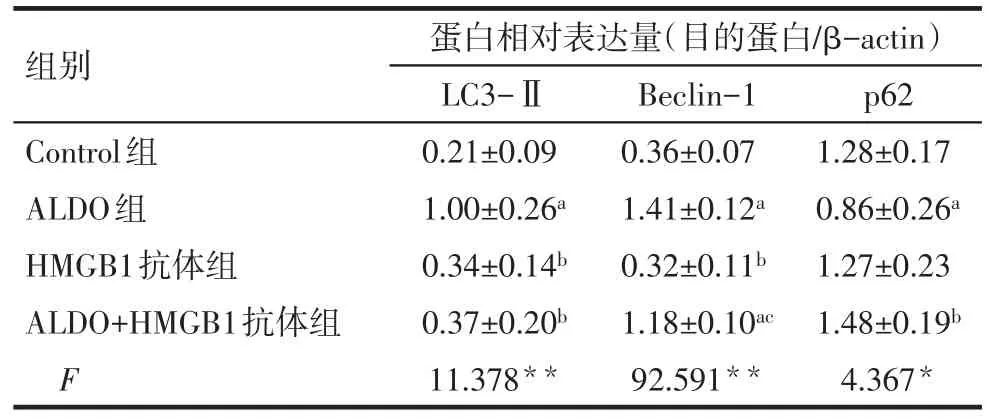
Tab.3 Effects of HMGB1 blocking on ALDO-induced autophagy of NRK-52E cells表3 阻断HMGB1对ALDO诱导NRK-52E细胞自噬的影响 (n=3,x±s)
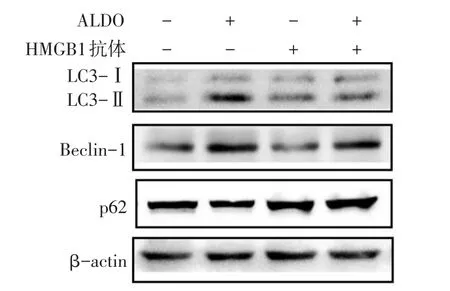
Fig.4 Effects of HMGB1 blocking on ALDO-induced autophagy of NRK-52E cells图4 阻断HMGB1对ALDO诱导NRK-52E细胞自噬的影响
3 讨论
慢性肾脏病是当代全球危害人类健康的重大疾病,其发病机制十分复杂。近年来研究发现,ALDO是CKD进展的一个关键递质,可独立于肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)直接参与肾小管损伤和肾间质纤维化的过程[4]。ALDO促发的炎症反应与线粒体功能障碍所致的细胞内ROS产生过量有关,但其确切机制尚未阐明[5-7]。在骨骼肌缺血/再灌注损伤研究中发现,ALDO可诱导HMGB1分泌增加,激活TLR4/MyD88/NF-κB信号通路,致使远隔心肌组织损伤[8]。Abdulmahdi等[9]在脓毒症致人肾近端小管(HK-2)细胞损伤模型中发现氧化应激参与了HMGB1的释放。对于HMGB1在ALDO诱导肾小管上皮细胞自噬中的作用尚鲜见报道。本研究发现,10 nmol/L ALDO处理NRK-52E细胞24 h后,细胞内ROS的水平较Control组明显升高;ALDO+HMGB1抗体组细胞内ROS的水平较ALDO组明显降低,上述结果提示HMGB1参与了ALDO促发的炎症反应过程。
HMGB1是一种高度保守的核蛋白,可以通过主动分泌和被动释放两种方式进入胞外,除了在免疫和炎性过程中发挥作用外,还可作为调节因子影响细胞自噬[10]。胞浆内的HMGB1与自噬相关蛋白Beclin-1结合,激活自噬。自噬发生时,胞浆中的LC3-Ⅰ发生断裂,与磷脂酰乙醇胺结合形成LC3-Ⅱ并定位在自噬小体膜上;而泛素结合蛋白p62则可直接偶联在LC3上,参与自噬体的构成[11]。有研究报道,HMGB1可诱导心肌细胞自噬相关蛋白Beclin-1和LC3-Ⅱ蛋白的表达上调,而抑制HMGB1后上述蛋白表达明显降低[12]。而本研究中,10 nmol/L ALDO刺激NRK-52E细胞后,HMGB1和IL-1β蛋白的表达均较Control组增加,同时细胞自噬也增加(Beclin-1和LC3-Ⅱ的表达上调,p62的表达下调)。经50µmol/L NAC预处理NRK-52E细胞后,IL-1β蛋白的表达较ALDO组明显下调;而给予1 mg/L HMGB1抗体预处理后,LC3-Ⅱ蛋白的表达较ALDO组明显降低、p62蛋白的表达较ALDO组明显增加。上述研究结果表明,HMGB1可能是通过刺激IL-1β的释放,加重氧化应激和炎症反应,进而诱导肾小管上皮细胞自噬,以维持细胞的稳态和完整性。
综上所述,ALDO可能通过促进肾小管上皮细胞内ROS的产生,增加HMGB1分泌,刺激炎症因子IL-1β的释放,进而诱导自噬的发生;抑制HMGB1的释放可逆转这一现象。HMGB1可能作为ALDO诱导肾小管上皮细胞损伤的新靶点,在慢性肾脏病的治疗中发挥重要作用,后期将深入研究其具体的分子机制。

