维持性血液透析患者血清磷水平与健康相关生活质量的关系
王爽,陈海燕,李博,王博,贾岚,魏芳,姜埃利
高磷血症在慢性肾病(chronic kidney disease,CKD)患者中普遍存在,尤其多发于维持性血液透析(maintenance hemodialysis,MHD)治疗的终末期肾病(end-stage renal disease,ESRD)患者中。高磷血症可导致骨代谢异常,增加心血管疾病发生风险,影响患者生活质量。研究表明,血液透析患者由于心理负担重,疾病和透析本身的并发症多,生活质量通常较同年龄段的健康人群差[1]。健康相关生活质量(health-related quality of life,HRQOL)评价分析已广泛用于临床,以评估慢性疾病治疗的有效性,预测疾病的结局、患者的生存状态和住院率[2],该评分包括身体、社会、情感和心理几个部分。肾脏疾病生活质量-36(KDQOL-36)量表是1994年提出的一项专门针对肾脏病的HRQOL调查,广泛应用于血液透析患者,旨在评估血透患者的生活质量[3-4]。本研究旨在探讨维持性血液透析患者血磷水平与HRQOL的关系,为高磷血症患者的临床诊疗提供新思路。
1 对象与方法
1.1 研究对象 选择2018年5月—2019年5月于本院血液净化中心接受维持性血液透析治疗的终末期肾病(ESRD)患者190例,男102例,女88例,平均年龄(57.34±11.80)岁。纳入标准:年龄>18岁;诊断为ESRD,并行血液透析治疗至少3个月。排除标准:因认知障碍、痴呆等原因不能完成KDQOL-36量表的患者;不愿意或不能完成问卷的患者;3个月内存在住院史、恶性肿瘤史以及预期寿命<6个月者。
1.2 方法
1.2.1 KDQOL-36量表评价患者生活质量 采用KDQOL工作组网站上KDQOL-36的中文翻译版本。KDQOL-36量表Cronbach's α 系 数 是 0.69~0.78,重 测 信 度 均 高 于 0.7[5]。KDQOL-36包含5个亚量表:症状与问题(symptoms and problem of kidney disease,SPKD)亚量表、肾脏疾病影响(effect of kidney disease,EKD)亚量表、肾脏疾病负担(burden of kidney disease,BKD)亚量表、SF-12生理总评分(physical component summary,PCS)亚量表、SF-12心理总评分(mental component summary,MCS)亚量表。KDQOL-36量表没有总分,单独计算每个亚量表分数,分数范围为0~100分,分数较高表明生活质量较好[6]。采用美国兰德公司网站上的Excel评分模板进行评分(www.rand.org/health/surveys_tools/kdqol)。
1.2.2 调查方法 研究对象在签订知情同意书后填写KDQOL-36量表。有读写能力的研究对象由本人亲自填写量表,无读写能力的研究对象由1名经过培训的专科医生逐一条目向研究对象解释,研究对象做出选择。同时收集患者一般资料,包括:年龄、性别、婚姻状况、吸烟情况(不吸烟指既往从未吸烟和戒烟6个月以上者)、血液透析通路、每周血液透析次数、透析龄、Charlson合并症指数(Charlson comorbidity index,CCI)、体质量指数(BMI)等以及血液净化标准操作规程(standard operation procedure,SOP)2019版规定的检测内容,包括:血常规、血生化、全段甲状旁腺激素(iPTH)、血脂、血磷、血钙等数据。Charlson评分由1987年Charlson等[7]提出,旨在评价除基础疾病以外的其他器官或组织的损伤及异常。CCI[8]对患者合并症情况进行积分评价,总分为0~36分,分数越高说明疾病负担越大,预后越差。
1.2.3 分组 参照肾脏病预后质量倡议(kidney disease outcomes quality initiative,K/DOQI)指南[9],慢性肾病5期患者血磷的靶目标值为1.13~1.78 mmol/L,设血清磷水平>1.78 mmol/L为高磷血症组,血清磷水平≤1.78 mmol/L为非高磷血症组。
1.3 统计学方法 采用SPSS 25.0统计软件进行统计学处理。分类变量以例(%)表示,组间比较采用χ2检验。正态分布连续变量以表示,2组间比较用独立样本t检验,非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。Logistic回归分析以确定高磷血症的可能影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况 高磷血症组较非高磷血症组患者年龄小,透析通路为动静脉瘘的患者比例、血肌酐、白蛋白(ALB)、iPTH、血钙水平均升高(均P<0.05),见表1。
2.2 高磷血症影响因素分析 以高磷血症(是=1,否=0)为因变量,以单因素分析中有差异的指标年龄、Ca2+、iPTH、ALB、Cr、透析通路(1=自体动静脉内瘘,0=半永久颈内静脉导管)为自变量,二分类Logistic回归分析结果示,较高的ALB、iPTH是高磷血症的危险因素(P<0.05),见表2。
2.3 KDQOL-36各亚量表进行高磷血症组与非高磷血症组比较 高磷血症组的各亚量表得分均低于非高磷血症组(均P<0.05),见表3。
3 讨论
肾脏是排泄磷的重要器官,慢性肾病患者因为肾功能障碍,造成磷排泄受阻,容易并发高磷血症[10]。最近一些研究表明,血清磷水平与心脑血管事件的发展之间存在相关性,威胁患者生命[11]。施月仙[12]的一项多中心横断面研究纳入397例MHD患者,分析慢性肾脏病-矿物质和骨异常(CKDMBD)的非疾病相关因素显示,长透析龄、男性及年轻患者与血磷升高有关。本研究显示,高磷血症组患者年龄偏低,考虑可能是年轻患者生活习惯差,喜暴饮暴食,参加聚会次数较多,每日磷摄入量大于1 000 mg,此剂量超过了改善全球肾脏病预后组织(KDIGO)指南建议[13]。但本研究2组患者透析龄及性别不存在差异,可能与本研究自身局限性有关:2组患者纳入人群男女比例不同,未详细记录不同透析龄患者饮食习惯及治疗依从性。
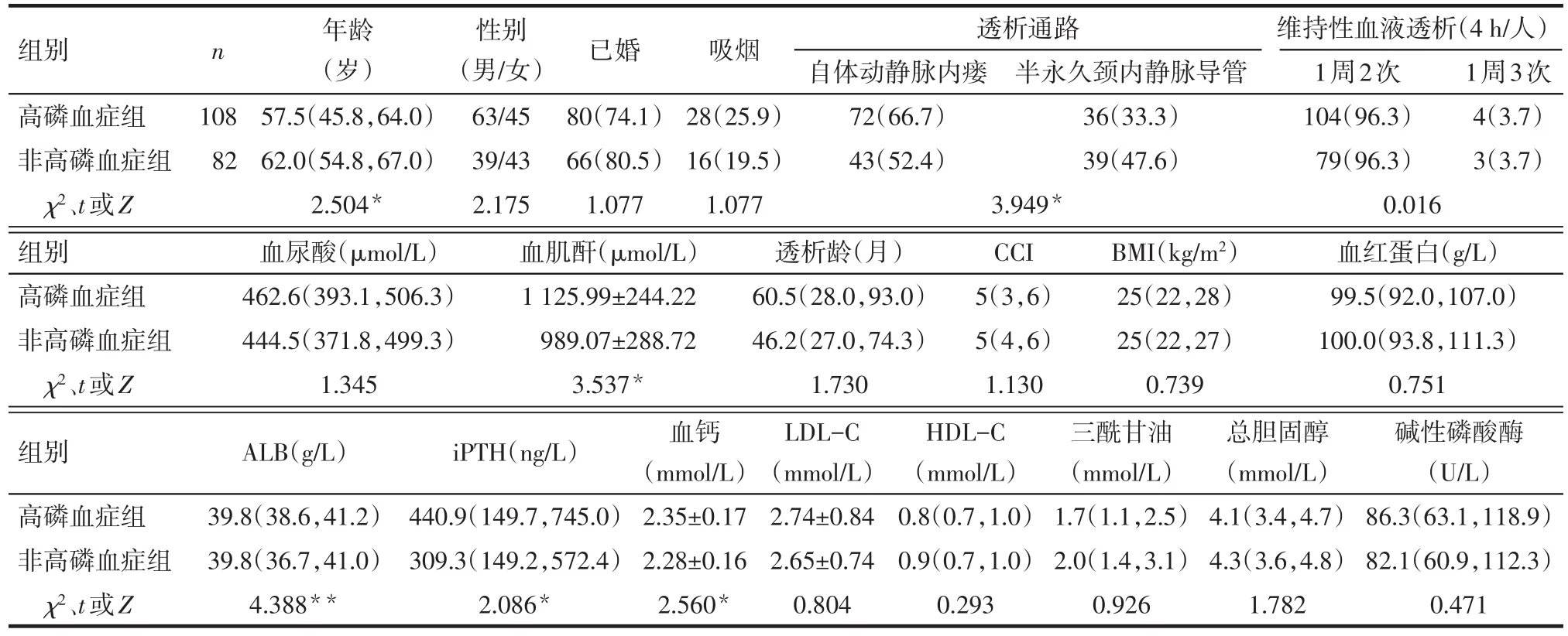
Tab.1 Comparison of the general clinical characteristic between the two groups表1 2组患者临床资料比较
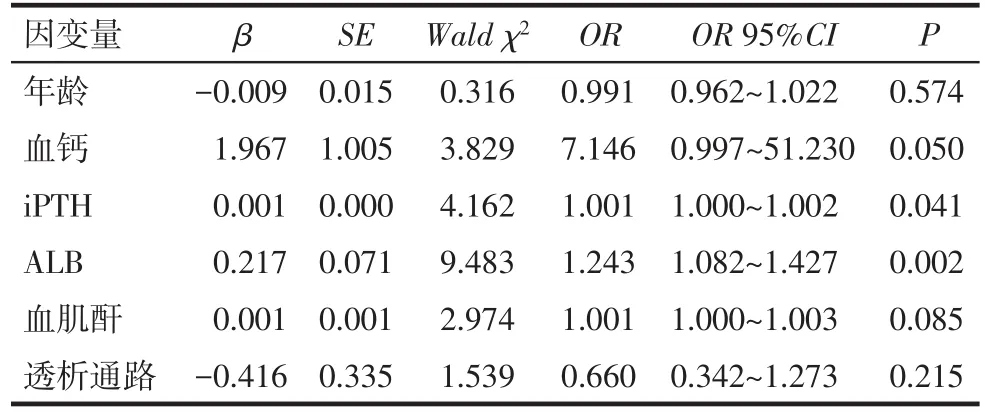
Tab.2 Logistic regression results of factors associated with high blood phosphorus表2 高磷血症相关因素的Logistic回归分析
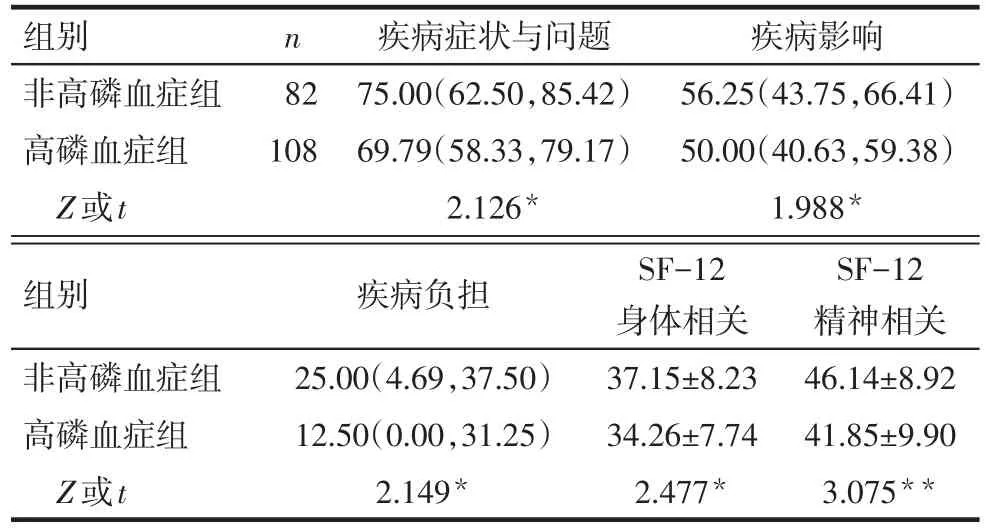
Tab.3 Comparison of KDQOL-36 subscale scores between the two groups表32组间KDQOL-36亚量表评分比较 (分)
已有研究显示,血磷每升高0.32 mmol/L,全因死亡风险上升20%,死亡风险可能与患者同时合并CKD-MBD、异位钙化(冠脉,皮肤及脑血管)等有关[14]。本研究发现,高磷血症组患者iPTH水平较高,与Ketteler等[15]研究结果相同。众多针对降低血磷的临床研究发现,适量控制饮食中每日磷摄入,会改善患者生活质量,降低患者病死率[16-17]。但也有研究显示,限制膳食中磷的摄入会导致患者死亡风险增加,可能与过分限制患者高磷食物摄入导致患者营养不良有关[18]。本研究发现,高磷血症组患者白蛋白水平较高,可能与患者饮食习惯有关,磷主要存在于蛋白含量高的食物中,高磷血症组患者可能因自我约束能力差,进食较多高蛋白食物。因此,有必要合理控制饮食,达到蛋白和磷水平的平衡。进一步通过多因素Logistic回归分析发现,血清高ALB和高iPTH水平是高磷血症发生的危险因素。
伴随医疗技术的提高,MHD患者生存时间得到明显提升。然而,有研究发现,长期病痛折磨加上经济的支出,MHD患者往往存在一系列的心理问题,这会降低患者生活质量,加速疾病的发展[19]。因此,HRQOL对评估患者的生活质量至关重要[20]。所以笔者采用KDQOL-36量表评价高血磷对维持性血液透析患者健康相关生活质量的影响,结果显示,高磷血症组各亚量表分数均显著低于非高磷血症组,其可能是由于血磷升高的患者易发生皮肤瘙痒、钙磷代谢异常,骨痛和血管钙化,影响患者日常活动,增加患者的生理心理负担,造成严重身体和心理危害。
综上所述,血液透析患者高血磷水平与KDQOL-36之间有相关性,即高磷血症对患者生活质量造成不良影响。提示在临床诊疗过程中不仅仅需要详细追踪患者的各项实验室检查指标,还应定期对患者进行生活及心理评分,及时进行医疗及心理干预,提高患者生活质量,促进患者更好回归社会。但本研究是单中心横断面研究,样本量较小,尚需多中心、大样本、前瞻性队列研究进一步证实。

