中和白细胞介素-17对特发性肺纤维化小鼠胶原和凋亡相关因子表达的影响
赵铁军,宋桂芹,张浩婷,崔伟亮,黄勇,王文栋,张效云△
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一组病因不明、慢性进行性肺部疾病,确诊后中位生存期为3~5年。肺上皮细胞过度凋亡、成纤维细胞过度侵袭引起的肺结构重建是IPF的主要标志[1]。目前尚无特效的抗纤维化药物,因此寻找IPF治疗的有效靶点尤为迫切。有研究报道辅助性T细胞17(Th17)是驱动炎症和肺纤维化最重要的T淋巴细胞[2],白细胞介素-17(IL-17)是Th17分泌的主要细胞因子,其活性被阻断后可显著改善肺纤维化,此作用可能与细胞凋亡通路有关[3]。本研究以博来霉素(bleomycin,BLM)诱导的IFP小鼠为研究对象,进一步探讨中和IL-17对肺组织胶原蛋白和细胞凋亡相关因子表达的影响,为肺纤维化的防治提供新的思路。
1 材料与方法
1.1 实验材料和仪器 清洁级健康雄性C57BL/6小鼠32只,体质量(18±2)g,购自中国人民解放军军事医学科学院实验动物中心;大鼠抗小鼠IL-17单克隆抗体和同型对照抗体IgG2a购自美国R&D systems公司;博来霉素购自海正辉瑞制药有限公司;Masson染色试剂盒购自南京建成科技有限公司;抗体Cleaved-caspase-9、Cleaved-caspase-3购自美国Bioworld生物技术公司;RNAprep pure动物组织总RNA提取试剂盒、FastQuant RT kit和SuperReal PreMix Plus均购自北京天根生化科技有限公司;RM2235切片机购自德国徕卡公司;实时荧光定量PCR分析仪购自德国Qiagen公司;显微照相系统OLYMPUS BX51-cellSensEntry购自日本Olympus公司;OmegaLum G化学发光凝胶成像系统购自美国aplegen公司。
1.2 方法
1.2.1 动物分组和模型建立 将32只C57BL/6小鼠按照随机数字表法分为正常对照组、模型组、中和抗体组和抗体对照组,每组8只。按照0.01 mL/g体质量经腹腔注射3.5%水合氯醛麻醉小鼠,随后,正常对照组气管注入0.1 mL生理盐水,其余3组均气管内一次性注入等量含BLM的生理盐水(5 U/kg)。中和抗体组和抗体对照组在制模3 d后每4 d尾静脉注射0.2 mL IL-17单克隆抗体(400µg/kg)或同型对照抗体(400µg/kg),共注射6次,正常对照组和模型组则给予0.2 mL生理盐水,饲养28 d统一处死小鼠。
1.2.2 肺组织Masson染色检测肺纤维化 取每组小鼠右肺上叶经多聚甲醛固定、脱水、石蜡包埋,常规切片5µm进行Masson染色,依据Wilson等[4]方法在显微镜下观察并评价各组肺组织纤维化程度。
1.2.3 Western blot法检测Cleaved-caspase-3和Cleavedcaspase-9蛋白表达 每组随机选取3只小鼠,取左上肺组织准确称质量100~200 mg,剪成碎块,加入组织蛋白裂解液(含2%蛋白酶抑制剂),匀浆,12 000 r/min离心10 min,收集上清液,用BCA法测定蛋白浓度。取50µg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,以5%脱脂牛奶室温封闭90 min,加一抗4℃孵育过夜,弃去一抗,TBST漂洗5次,加二抗室温孵育60 min,弃去二抗,TBST漂洗5次,超敏ECL显色,凝胶成像系统显影,以3-磷酸甘油醛脱氢酶(GAPDH)为内参,用软件Image J计算目的蛋白的相对表达量。
1.2.4 实时荧光定量PCR法检测肺组织胶原Ⅰ型和Ⅲ型mRNA表达 取左下肺组织10~20 mg,加入300µL裂解液,用匀浆器将组织彻底研磨,按照RNAprep pure动物组织总RNA提取试剂盒说明书提取总RNA,实时荧光定量PCR检测胶原Ⅰ型和Ⅲ型mRNA表达,操作步骤按照FastQuant RT kit和SuperReal PreMix Plus试剂盒说明书进行。扩增条件:95℃预变性5 min;95℃变性10 s,60℃退火20 s,72℃延伸27 s,共40个循环。每组8只小鼠,每只设置3个复孔,以GAPDH作为内参基因,用2-ΔΔCt法计算mRNA的相对表达量。引物序列见表1。

Tab.1 The primer sequence of gene amplification by fluorescence quantitative PCR表1 荧光定量PCR扩增基因引物序列
1.3 统计学方法 采用SPSS 20.0软件进行统计分析,计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 中和IL-17对各组肺组织病理学影响 Masson染色结果显示,正常对照组肺组织结构正常,未见明显纤维组织;模型组和抗体对照组肺泡间隔明显增宽,可见肺泡塌陷融合,肺纤维化程度严重;中和抗体组的纤维化程度明显轻于模型组和抗体对照组,差异有统计学意义(P<0.01),见图1、2。
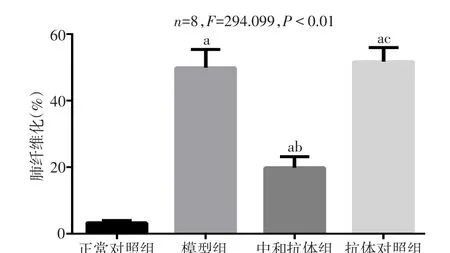
Fig.1 Influence of neutralizing IL-17 activity on pulmonary fibrosis score in four groups of mice图1 中和IL-17对小鼠肺纤维化评分的影响
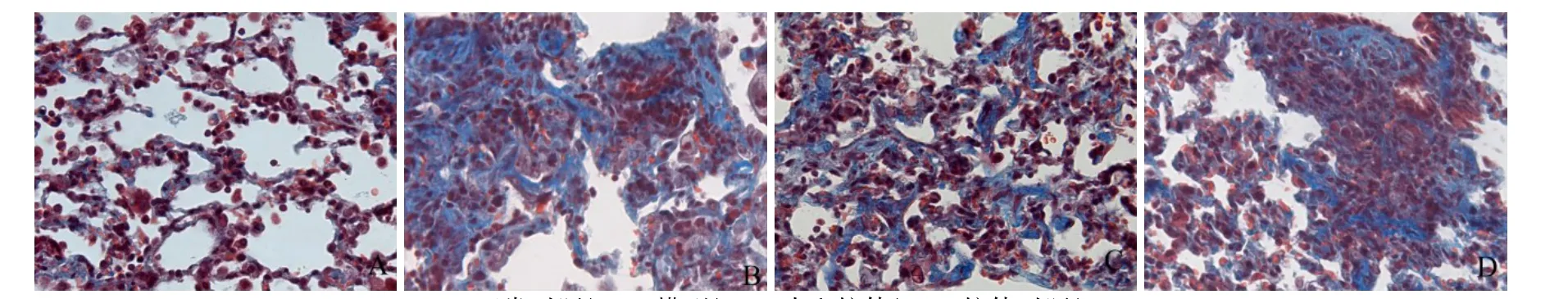
Fig.2 Masson staining of lung tissues in four groups(×400)图2 4组小鼠肺组织Masson染色(×400)
2.2 中和IL-17对各组肺组织Cleaved-caspase-3和Cleaved-caspase-9表达的影响 Western blot检测结果显示,4组间Cleaved-caspase-3和Cleavedcaspase-9表达差异有统计学意义,与正常对照组相比,模型组Cleaved-caspase-3和Cleaved-caspase-9表达明显升高(P<0.01),采用中和抗体阻断内源性IL-17活性后,Cleaved-caspase-3和Cleavedcaspase-9表达下降(P<0.01),抗体对照组蛋白的表达与模型组无差异,见图3、表2。

Fig.3 Western blot results for Cleaved-caspase-3 and Cleavedcaspase-9 of lung tissues in four groups图3 4组小鼠肺组织Cleaved-caspase-3和Cleaved-caspase-9 Western blot结果
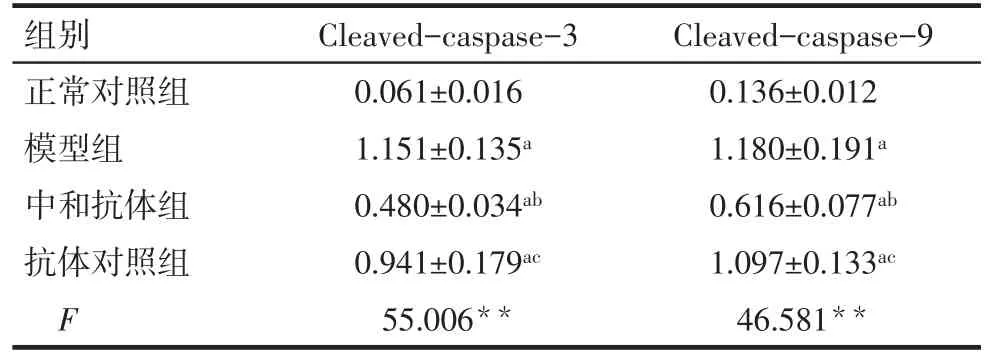
Tab.2 Expressions of Cleaved-caspase-3 and Cleavedcaspase-9 proteins detected by Western blot assay表2 Western blot检测4组Cleaved-caspase-3和Cleaved-caspase-9蛋白表达情况 (n=3,x±s)
2.3 中和IL-17对各组肺组织胶原Ⅰ型和Ⅲ型mRNA表达的影响 Real-time PCR结果显示,模型组、中和抗体组和抗体对照组胶原Ⅰ型和Ⅲ型mRNA表达水平均较正常对照组高,但中和抗体组胶原Ⅰ型和Ⅲ型mRNA表达水平低于模型组,差异有统计学意义(P<0.01),见图4。
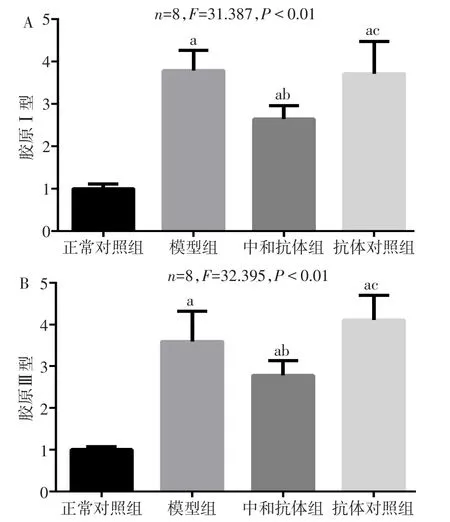
Fig.4 The influence of neutralizing IL-17 activity on collagen typeⅠand typeⅢmRNA in pulmonary tissues in four groups of mice图4 中和IL-17对小鼠胶原Ⅰ型和Ⅲ型mRNA表达的影响
3 讨论
3.1 肺纤维化和IL-17的研究现状 肺纤维化的发病机制目前仍不清楚,被认为与一系列疾病,如放疗和化疗引起的纤维化、囊性肺病、肉芽肿性肺病、感染或自身免疫性疾病、环境和吸烟相关的慢性阻塞性肺病等相关,也可能没有任何潜在的原因。迄今为止,临床治疗措施依然有限,在严重情况下,肺移植是病人的唯一选择[5]。有研究认为肺纤维化的发生发展与肺泡上皮细胞过度凋亡、成纤维细胞异常增殖密切相关[6]。IL-17是由Th17产生的一种炎症因子,在BLM诱导的小鼠肺纤维化模型中,IL-17水平在肺、支气管肺泡灌洗液中显著升高,IL-17基因敲除小鼠经BLM诱导后肺纤维化程度明显低于野生型小鼠[4]。Mi等[7]发现IL-17A以依赖转化生长因子(TGF)-β1的方式促进胶原的合成和分泌,并促进肺泡上皮细胞间质转化。
3.2 中和IL-17对肺组织细胞Cleaved-caspase-3和Cleaved-caspase-9表达的影响 线粒体是细胞生命活动的控制中心,不仅通过氧化磷酸化为机体提供能量,而且还可以介导内源性细胞凋亡信号通路。目前不少研究认为线粒体介导的细胞凋亡在IPF发病机制中发挥重要的作用。当细胞受到凋亡信号刺激时,会引起线粒体外膜的渗透性增加及线粒体跨膜电位的下降,促进细胞色素C的释放和凋亡小体的形成,引发Caspase家族蛋白酶的级联反应过程。其中caspase-9是细胞凋亡的激活剂,激活的caspase-9可以依次激活caspase-3和caspase-7的前体,从而诱导细胞凋亡;caspase-3是凋亡的执行者,激活的caspase-3又可激活caspase-9前体,形成正反馈激活通路,因此检测caspase-9和caspase-3的表达能反映细胞凋亡的状态。本研究免疫印迹结果显示,模型组Cleaved-caspase-3和Cleaved-caspase-9表达明显升高,说明BLM诱导的IPF激活了细胞凋亡信号途径,中和IL-17使肺组织中Cleavedcaspase-3和Cleaved-caspase-9表达均低于模型组,但均高于正常对照组,Cleaved-caspase-3和Cleaved-caspase-9表达的降低提示中和IL-17导致线粒体凋亡通路活化减弱,细胞凋亡数量减少。B淋巴细胞瘤-2(Bcl-2)蛋白家族被认为是线粒体凋亡信号通路中关键的调节因子,以往研究证明,中和IL-17作用后,支气管上皮细胞和肺泡上皮细胞线粒体凋亡通路上游Bcl-2相关X蛋白(Bax)/Bcl-2表达降低[8]。本实验则进一步证实中和IL-17后,线粒体凋亡通路下游Cleaved-caspase-3和Cleavedcaspase-9的表达也降低,推测中和IL-17使肺纤维化程度得以改善与细胞凋亡信号通路有关,中和IL-17可能不仅抑制了肺泡上皮细胞凋亡,促进了其正常再上皮化,也可能与避免成纤维细胞和肌成纤维细胞出现过度增殖和局部持续的炎性状态有关。此外,中和IL-17还能减轻辐射诱导的肺炎和纤维化,提高小鼠辐射后的存活率,提示IL-17具有促纤维化作用[9]。
IL-17在某些器官又具有抗纤维化功能。最近的一项研究表明,IL-17缺乏与单侧输尿管梗阻引发的肾过度纤维化有关[10]。醋酸去氧皮质酮联合血管紧张素所致高血压的进展性肾纤维化模型研究进一步证实了IL-17的抗纤维化作用。在这个系统中,IL-23/IL-17轴的激活可以保护肾脏免受纤维化的影响[11-12]。IL-17在某些器官具有促纤维化作用,在某些器官又具有抗纤维化作用,这取决于纤维化所涉及的器官。因此可以针对这些纤维化相关疾病制定是否阻断IL-17信号的治疗方案。
3.3 中和IL-17对肺组织细胞胶原mRNA表达的影响 胶原Ⅰ型、Ⅲ型为肺内主要的间质型胶原,胶原纤维增生促进了肺纤维化的形成。本研究实时荧光定量PCR结果显示,模型组胶原Ⅰ型、Ⅲ型mRNA表达水平高于正常对照组和中和抗体组,但中和IL-17处理后两者mRNA表达水平明显下降,其机制可能与通过下调TGF-β1表达、抑制肌成纤维细胞的增殖并最终减少胶原的合成有关。
本文仅针对肺纤维化模型,未研究中和IL-17对正常小鼠肺组织胶原和凋亡相关因子的表达是否有影响,参考其他学者的文献也均未在正常小鼠体内做中和IL-17的相关实验[8-9],有待于进一步研究。
综上所述,认为中和IL-17改善肺纤维化,可能与通过调控线粒体介导的细胞凋亡通路、降低胶原纤维的形成有关。肺纤维化是一种复杂且病因不明的渐进性疾病,中和IL-17在肺纤维化疾病中的作用机制有待于进一步探讨,IL-17有可能成为预防和治疗IPF的新的靶点。

