5株发酵食品源乳酸菌的抗药性分析
黄晓棠,姚妞妞,周 璇,郭润芳,于宏伟
(河北农业大学食品科技学院,河北保定 071000)
乳酸菌是发酵食品生产中一类重要的微生物,它们能改善发酵食品的风味和质地,提高发酵食品的营养价值,而且能产生一些特殊物质来抑制食物腐败细菌的生长,对调节免疫、维持肠道平衡和健康具有重要作用[1-3],因此乳酸菌膳食补充剂以及乳酸菌发酵食品越来越得到人们的青睐。乳酸菌是从传统发酵食品或动物肠道中分离而来,是安全性菌株(Generally recognized as safe,GRAS),因此人们更多关注的是乳酸菌的益生功能和健康应用。
随着抗生素的滥用,乳酸菌的抗药性也逐渐成为公众关注的安全问题,并引起了全世界专业学者的研究与重视,尤其是抗药性的增加以及抗性基因对致病菌或非致病菌的潜在转移[4]。近年来,关于发酵食品中乳酸菌抗药性的报道层出不穷,研究也取得了一定的进展。研究发现,大部分乳酸菌对氨基糖苷类、喹诺酮类、多粘菌素B等抗革兰阴性菌的抗生素有抗性[5],Li等[6]报道了19种乳酸菌对喹诺酮类抗生素的抗性,结果表明所有菌株均对诺氟沙星和环丙沙星有抗性,且喹诺酮抗性的遗传基础可能与gyrA基因的突变密切相关。Nawaz等[7]报道了分离自发酵食品中的乳酸菌携带ermB和tetM抗性基因,且可通过过滤器成功转移到粪肠球菌中。抗性基因在菌株之间的相互传递具有一定的危害性[8],例如某些耐药基因可能会以某种方式在肠道内微生物菌群之间相互传递,从而导致某些致病菌也获得了耐药性[9]。
作为益生菌,植物乳杆菌、干酪乳杆菌、鼠李糖乳杆菌和保加利亚乳杆菌因优良发酵特性及多种益生作用被广泛应用于工业生产、食品发酵及医疗保健等领域[10-13],除了益生功能研究外,其耐药性的相关研究也逐年增多[14-16]。本研究前期从自制混合发酵果蔬汁和树莓酵素中分到2株植物乳杆菌,从奶制品中分离到干酪乳杆菌、鼠李糖乳杆菌和保加利亚乳杆菌,并发现这些菌株对果蔬有良好的发酵特性[17]。因此,本文以这5株菌为研究对象,采用平板药敏纸片扩散法、PCR及RT-PCR技术从表型、耐药基因定位及基因表达进行系统的分析,为全面评价5株菌的安全性及其应用价值提供科学依据。
1 材料与方法
1.1 材料与仪器
植物乳杆菌S(LactobacillusplantarumS) 分离自苹果、梨、香蕉混合发酵果蔬,命名为Z1,河北农业大学酶工程实验室;植物乳杆菌WD(L.plantarumWD) 分离自树莓酵素,命名为Z2;保加利亚乳杆菌LB-DR(L.bulgaricusLB-DR)、鼠李糖乳杆菌Lr-05-281(L.rhamnosusLr-05-281)、干酪乳杆菌D-400(L.caseiD-400) 分离自不同奶制品,分别命名为B1、L1、G1,河北农业大学酶工程实验室;MRS肉汤培养基、MRS琼脂培养基 北京索莱宝科技有限公司;27种药敏纸片:氨基糖苷类(阿米卡星、卡那霉素、庆大霉素、链霉素)、喹诺酮类(诺氟沙星、氧氟沙星、左氟沙星、环丙沙星)、糖肽类(万古霉素)、大环内酯类(红霉素)、四环素类(四环素)、β-内酰胺类(头孢呋辛、头孢唑啉、头孢噻吩、头孢噻肟、头孢曲松、头孢他啶、哌拉西啉、氨苄西林、苯唑西林、青霉素G、氨曲南)、磺胺类(复方新诺明)、其他(呋喃妥因、氯霉素、多粘菌素B、克林霉素) 杭州滨和微生物试剂有限公司;6×Loading Buffer、DL2000 DNA Marker 保定宝生物有限公司;Quick-RNA真菌/细菌Microprep试剂盒 ZYMO RESEARCH生物公司;HiFiScript快速去基因组cDNA第一链合成试剂盒 北京康为世纪生物科技有限公司。
CP214型电子天平 上海奥豪斯仪器有限公司;SW-CJ-1FD型洁净工作台 苏州安泰空气技术有限公司;LS-35HD型立式压力蒸汽灭菌器 江阴滨江医疗设备有限公司;ABI-2720型PCR扩增仪 赛默飞世尔科技有限公司;SPX-250S-Ⅱ型生化培养箱 上海新苗医疗器械制造有限公司;JY600C型电泳仪、JY04S-3E型电泳凝胶成像分析系统 北京君意东方电泳设备有限公司。
1.2 实验方法
1.2.1 菌株活化 从-20 ℃冻存管中取2%菌液接种于MRS液体培养基,37 ℃培养12 h,传代2~3次,保证菌种活力。
1.2.2 药敏试验 采用药敏纸片扩散法检测5株乳酸菌对27种抗生素的敏感性,抗性判定参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)最新版手册[18]进行。
1.2.3 菌株基因组DNA的提取 采用传统酚-氯仿的方法[19]提取5株乳酸菌的基因组DNA。
1.2.4 菌株质粒的提取 采用张波等[20]高效提取乳酸菌质粒的方法提取5株乳酸菌的质粒。
1.2.5 抗药基因的PCR检测 根据乳酸菌抗药性表型结果,NCBI数据库(https://www.ncbi.nlm.nih.gov)查找并下载抗性基因全序列,使用DNAMAN 5.0软件(美国Lynnon Biosoft公司)进行比对,选取同源性高的片段进行引物设计,共自行设计9对引物:卡那霉素抗性基因aph、庆大霉素抗性基因aacⅠ和aacⅡ、链霉素抗性基因ant(6)、四环素抗性基因tet、红霉素抗性基因erm、万古霉素耐药基因vanⅠ和vanⅡ、β-内酰胺类抗性基因blaⅠ;而β-内酰胺类抗性基因blaⅡ、磺胺类抗性基因sul、喹诺酮类抗性基因qnr引自参考文献[21-23]。设计的引物由北京华大基因公司合成,序列及退火温度见表1。

表1 抗性基因引物序列及条件
分别以5株菌的基因组DNA和质粒为模板进行PCR扩增。扩增程序为:94 ℃预变性3 min,94 ℃变性45 s,相应退火温度45 s,72 ℃延伸45 s,72 ℃终延伸3 min,30次循环。扩增体系为:DNA模板1 μL,上下引物(10 μmol/L)各1 μL,2×ES taq Master Mix 12.5 μL,ddH2O补足25 μL。反应结束后取5 μL产物点样于琼脂糖凝胶(1.0%)点样孔,120 V电泳40 min,电泳结束后紫外灯下观察并拍照记录。
1.2.6 抗性基因的表达分析 5株菌分别采用MRS和添加抗生素的MRS两种培养基培养,然后用Quick-RNA真菌/细菌Microprep试剂盒提取各菌株的总RNA,HiFiScript试剂盒对提取到的总RNA进行反转录,以反转录产物为模板进行PCR扩增以检测抗性基因是否表达;RT-PCR反应体系和扩增条件同上。
1.3 数据处理
数据以平均值±标准偏差表示,采用SPSS 16.0进行统计分析,每个实验重复3次。
2 结果与分析
2.1 5株乳酸菌的药敏反应
由表2可见,5株菌的抑菌圈均在合理范围之内,试验结果可靠。5株菌均表现为多重抗药性,包括对氨基糖苷类、喹诺酮类、糖肽类抗生素和多粘菌素B的抗性;但对大环内酯类、四环素类、磺胺类抗生素和呋喃妥因敏感,有较为相似的耐药谱,而对β-内酰胺类抗生素表现出不同程度的抗性,可见不同菌株的抗药性是有差异的。

表2 5株菌药敏试验结果
已有研究报道,Zhou等[24]检测了4种益生乳酸菌的抗药性,发现3株鼠李糖乳杆菌均对万古霉素有抗性,对红霉素、四环素敏感,与本研究一致。吕耀龙等[25]研究发现内蒙古达茂旗牧区牛乳中植物乳杆菌均对红霉素敏感,而本研究中2株植物乳杆菌对红霉素有不同的抗药性,Z1对红霉素表现为中介,Z2对红霉素表现为敏感,由此可见,同种菌的不同菌株对同种抗生素的抗药性不同,这可能由于菌株来源不同,所以其抗药性也有差异。药敏纸片扩散法操作简单、省时省力的优点被广泛应用,但影响结果的因素较多,如抗生素纸片的含药量不同、培养基不同、菌体生长情况不同等。菌株对于同类抗生素的抗药表型与携带的抗药基因有一定的关联,因此,乳酸菌抗药性的检测还常常借助于特异性引物PCR方法。
2.2 抗性基因的遗传定位
为了确定抗性基因是存在于基因组上,还是质粒上,亦或者是二者均有,本试验分别以基因组DNA和质粒DNA为模板进行PCR扩增,扩增结果见图1。基因组上共检测到6个抗性基因(erm、aph、vanⅠ、blaⅡ、aacⅠ和aacⅡ),质粒上共检测到4个基因(erm、aph、vanⅠ和aacⅠ),其它供试抗性基因(qnr、sul、ant(6)、tet、vanⅡ、blaⅠ)均未检测到。对这5株菌而言,基因组上都检测到erm、aph、vanⅠ、blaⅡ,B1、G1和L1这3株菌同时检测到aacⅠ,L1还检测到aacⅡ;至于aph基因扩增片段大小不同,原因是不同的菌抗性基因本身大小不同所致。
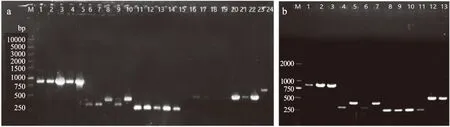
图1 5株菌的抗性基因PCR电泳图谱
抗性基因在质粒上的分布也不一致,其中菌株Z2质粒上只检测到vanⅠ,而L1质粒上4种抗性基因都检测到,另外3株菌质粒上也分别有2~3种抗性基因。已有文献表明,乳酸菌中存在接合质粒和转座子,接合作用被认为是乳酸菌获得抗性基因的主要方式[26]。目前许多研究者都证实乳酸菌上的几种抗性基因会在乳酸菌与同种菌株或其他菌株之间发生转移[27],因此有待进一步研究质粒上的抗性基因是否会转移到其他菌株上。如果仅在基因组DNA上检测到,在质粒上却未检测到,说明这个抗性基因可能是固有耐药基因,不会发生水平转移;但只要有抗性质粒,就存在抗性质粒水平转移的可能性,因此,相较于其它供试菌株,Z2菌株在抗药性方面更具安全性。
2.3 抗性基因与表型的关系
表3总结了抗生素抗性与相关抗性基因之间的关系,菌株携带的抗药基因与抗药表型之间有一定关联。如5株菌对卡那霉素、万古霉素有抗性,且检测到aph、vanⅠ,5株菌对复方新诺明敏感,且未检测到sul,表型与基因型结果一致。

表3 抗生素抗性与相关抗性基因之间的关系
然而,在部分抗药菌株中并没有检测到相应的抗药基因,本研究中5株菌对喹诺酮类抗生素、链霉素有抗性,却未检测到相应的抗性基因,分析产生这种现象的原因可能是5株菌对链霉素或喹诺酮类抗生素的抗性可能是抗性基因检测不够全面,有其他或新的抗性基因导致菌株具有抗药性,还可能是这个抗性基因在某种特定条件下才会表达等其他原因。类似的结果之前也有文献报道,Hummel等[28]研究了45种乳酸菌的抗药性,结果发现植物乳杆菌BFE 7440对氯霉素有抗性,却未检测到氯霉素抗性基因cat;Rojo-Bezares等[29]研究了酒中乳酸菌的耐药性,研究表明植物乳杆菌C709对万古霉素有抗性,也未检测到相关抗性基因。另外,表型敏感的菌株也可能携带抗性基因,本研究中4株菌对红霉素敏感,却都检测到红霉素抗性基因erm。秦宇轩等[30]检测了酸奶中分离出的乳酸菌的抗药性,研究表明干酪乳杆菌对四环素敏感,但在干酪乳杆菌中检测到四环素抗性基因tetK、tetM。这可能是因为其携带的抗性基因沉默所致。
5株菌对不同的β-内酰胺类抗生素有不同的敏感性,对头孢菌素类抗生素、哌拉西林、氨苄西林有较高的敏感性,对苯唑西林、青霉素G、氨曲南有较高的抗性,5株菌均检测到β-内酰胺类抗性基因blaⅡ而未检测到blaⅠ,分析原因可能是抗性基因blaⅡ导致菌株的抗药性。
2.4 抗性基因的表达分析
抗性基因能否表达也是其评价指标之一,针对检测到的6种抗性基因进行了RT-PCR。试验采用了MRS培养和抗生素诱导培养两种方式,从而进一步证明抗性基因的表达条件。氨基糖苷类抗生素选取庆大霉素、卡那霉素,糖肽类抗生素用万古霉素,大环内酯类用红霉素,β-内酰胺类抗生素用青霉素G。除了红霉素诱导不长菌之外,其余抗生素诱导都长菌。
由表4可见,对aph抗性基因来说,植物乳杆菌Z2菌株与其它四种菌表现不同,用MRS培养基上卡那霉素抗性基因aph表达,用添加卡那霉素后其aph基因不表达;对vanⅠ、blaⅡ、aacⅠ和aacⅡ4种抗性基因而言,5株菌在MRS培养基和添加抗生素的MRS培养基中的表达情况一致,表达的仍旧表达,不表达的依然不表达,由此说明沉默的抗性基因在诱导培养的条件下依然沉默,这些沉默的抗性基因可能在特定的条件下才能被激活表达,这个特定的表达条件有待进一步研究。
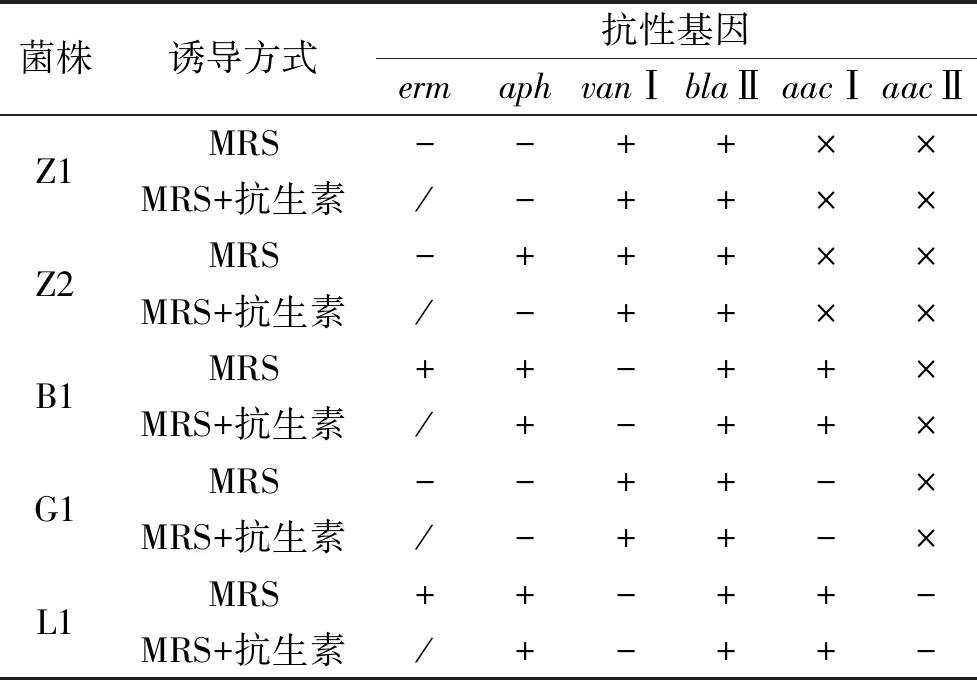
表4 抗性基因表达检测结果
3 结论
5株菌均表现出对氨基糖苷类、喹诺酮类、糖肽类抗生素和多粘菌素B的多重抗药性。其耐药基因型分别为:Z1和Z2为ermr、aphr、vanⅠr、blaⅡr,B1和G1为ermr、aphr、vanⅠr、blaⅡr、aacⅠr,L1为ermr、aphr、vanⅠr、blaⅡr、aacⅠr、aacⅡr。5株菌质粒上所含的抗药基因数量不同,Z2菌株质粒上因只含一种vanⅠ抗性基因,其应用安全性较好。
另外,质粒上的抗性基因可能存在转移到其他菌株的风险。目前关于乳酸菌耐药性的研究多在耐药表型、耐药基因检测及耐药机制等方面,我们也应多研究如何消除耐药基因及消除耐药基因后乳酸菌益生性能有无变化。因此,要加强对乳酸菌抗药性的研究,进一步研究消除耐药基因后乳酸菌的益生性变化,从而保障发酵食品的质量安全,同时为发酵食品企业评估菌株的抗药性提供理论基础。

