应用物种敏感性分布评估微(纳米)塑料对水生生物的生态风险
陈锦灿,方超,郑榕辉,张玉生,王克坚,薄军,*
1. 近海海洋环境科学国家重点实验室,厦门大学海洋与地球学院,厦门 361102 2. 海洋生物与生态实验室,自然资源部第三海洋研究所,厦门 361005
塑料自1907年被发明以来,便因低廉的价格、较好的生物惰性、高比强度以及坚固和耐用等特点,被广泛应用于建筑、农业、军事、工业、医学、化工以及航空航天等各个领域[1]。截至2017年,全球塑料制品总产量约为3.48亿t,我国是全世界生产塑料制品最多的国家,占全球总量的29.4%[2]。此外,全球每年有大约15%~40%的塑料垃圾会通过各种途径从陆地汇入海洋,由于其不易降解特征和人类持续排放等原因,这一数字在未来10年内还可能持续攀升[3]。尽管塑料制品的广泛使用为人们日常生活带来了许多便利,但也对全球范围内生态系统的健康构成了潜在的威胁[2,4]。
直径<5 mm的塑料颗粒、碎片、纤维和薄膜等都被定义为微塑料(microplastics, MPs)[5-6],这一概念最初由英国茅利斯大学Thompson等[7]于2004年在《Science》杂志上提出。但是由于划分标准的不同,微塑料的定义和分类又有所差别。如果以来源作为划分依据,微塑料包括原生微塑料和次生微塑料2种类型。原生微塑料通常是指人为制造的、具有特殊用途的微塑料,如工业磨料和塑料微珠等[8],日常生活中常见的牙膏、洗面奶、洗发水和足浴盐等个人护理品中都含有这类微塑料[9]。而次生微塑料指的是大型塑料垃圾在太阳辐射(如光降解、催化)、物理(海浪或河流冲刷、拍打等外力作用)、化学或生物(分解、降解作用)作用下分解而成的粒径更小的碎片、纤维或颗粒状等小型塑料[8,10-11];此外,化学组成成分[12]、形状[12-13]和尺寸大小[14-17]也可作为分类依据从而将微塑料划分为不同类型。
大多数水生生物判断或摄食主要受食物密度、形状、大小、丰度或颜色等因素的影响[18];而微(纳米)塑料具有尺寸小、不易降解且容易随水流动等特点,很容易被水生生物误食。越来越多的室内实验结果和野外调查数据表明,微(纳米)塑料能够被不同种类水生生物摄取[19-27],并沿着食物链传递到更高营养级的生物体内[15,19,28-32],对不同营养级的生物造成一定程度的物理损伤和生物学效应[33]。其中,微塑料对水生生物的影响主要体现在以下4个方面:(1)微塑料被水生生物误食后,可能对生物造成物理损伤,如堵塞消化道,从而使其产生伪饱腹感,消耗其体内储存的能量等[10,34-36];(2)由于比表面积大、疏水性强等特性,微塑料具有吸附水中有机污染物的能力,并可将其吸附的污染物释放到水生生物体内进而对生物机体产生一系列不良影响[37-39];(3)微塑料表面不仅可以作为微生物群落的栖息场所、促进微生物的繁殖和微塑料表面生物膜的形成[40],还可为某些浮游生物(如海黾)的繁殖提供基质[18,41],而微塑料生物膜上的某些病原体能够随着微塑料在食物链中逐级传递,威胁水生生物健康[18];(4)进入水体环境后,微塑料浸出物会慢慢从聚合物基质中释放出来(如壬基酚、双酚A等微塑料自身携带的化学添加剂)[18],对水生生物带来一定的毒性效应,最终威胁水生生态系统[42]。
面对全球范围内微(纳米)塑料污染加剧所带来的挑战[34,43],开展其对水生生态系统的风险评估显得尤为迫切[44]。生态风险评估是用于评估特定环境压力下正在形成的(或可能形成的)某一不利生态效应的可能性,即用于预测污染物对生态系统的有害影响[37,45-46],它是人们进行环境风险管理和制定相关环境政策时的主要依据[47]。风险评估标准的制定以基准作为基础,而基准的推导需要对污染负荷、生态毒理临界值等环境承载能力对应的几个关键参数进行综合考量[48]。生态风险评估的最终目的是得出浓度阀值或风险临界值,为制定相关标准或基准、采取生态风险控制措施提供相应的技术支撑[47]。
目前,水环境中微(纳米)塑料生态风险的评估主要有2种,即基于微塑料中有害组分的评估技术和基于不同物种对微(纳米)塑料敏感性差异的物种敏感性分布(Species Sensitivity Distributions, SSD)[49-51]。前者主要是依据微(纳米)塑料中各种有害化学成分的特征及其可能造成的生态效应,从而对微(纳米)塑料有害组分的危害等级进行划分,并以此来评估微(纳米)塑料对水生生物的健康风险[50]。然而,由于微(纳米)塑料具有化学组分复杂、危害等级划分工作量大、且有害化学成分的吸附和解析原理不清等缺点[52],导致这种风险评估技术尚未得到广泛应用。20世纪中后期,为了制定对生态系统保护有利的水质基准,美国环保局(US EPA)提出了基于SSD的生态风险评估的方法[46],之后被多个国家和国际组织采用[53-55]。SSD曲线拟合法主要利用文献中收集到的生物毒理数据来分析污染物对生物的危害程度,进而评估其生态风险[44-45,56]。由于SSD具有方法简明、生态意义明确等优点,且这种方法的不确定性与传统方法比相对较小,已成为生态风险评估领域常用的方法之一[57-62]。
作为一种新型的环境污染物,水体中微(纳米)塑料的毒性或潜在的生态风险已成为当前水环境污染的研究热点之一。然而,目前国内外利用SSD方法来评估微(纳米)塑料对水生生物生态风险的研究却鲜有报道[16,51]。本研究基于已报道的水生生物微(纳米)塑料毒理学研究数据,利用SSD方法将数据进行模型拟合,并对全球若干水环境中不同浓度微塑料对水生生物的生态风险进行评估及预测,以期为开展微塑料潜在生态风险评估提供重要的方法依据。
1 材料与方法 (Materials and methods)
1.1 SSD基本步骤
SSD的构建和应用主要包括以下几个步骤[57]:(1)微(纳米)塑料毒理学数据的获取;(2)物种分布及数据处理;(3)SSD曲线拟合;(4) 5%危害浓度(HC5)及潜在影响比例(PAF)计算。其中SSD拟合曲线的构建采用澳大利亚联邦科学和工业研究组织(CSIRO)提供的Burrlioz(2.0版本)计算软件[63]。
1.2 微塑料毒理数据的获取
利用Web of Science数据库,收集并整理了近10多年来(2007—2018年)国内外公开发表的文献资料,共5门10科11种水生生物的急性毒性数据[21,64-69](表1)。
1.3 物种分布及数据处理
首先,将搜集、筛选后的所有水生生物毒理数据(EC50或LC50)统一格式,即按照国际单位制将所有数据的单位统一换算成μg·L-1。其次,统计整理所有物种的中文名、拉丁名、物种所属门科分类以及参考文献等信息,具体信息如表1所示。
1.4 SSD曲线拟合
SSD曲线是通过不同生物对污染物的敏感性差异来建立生物毒性效应曲线,并采用5%作为保护水平(即认为损失5%的物种是可以接受的)来计算HC5[53],即在此生态风险阀值条件下,可以保护环境中95%的生物不受影响[57]。SSD拟合的形式主要包括Log-Normal、Log-Logistic、Reweibull和BurrⅢ等[57]。美国和欧盟推荐使用Log-Normal分布模型拟合SSD曲线,而澳大利亚和新西兰等国家则推荐使用BurrⅢ型分布。本研究采用BurrⅢ型分步(软件根据上传数据自动转化为BurrⅢ型的变化模型-Reweibull分布),因为这种分布函数可灵活应用且对物种敏感性的拟合特性较好[70-71]。SSD曲线拟合的基本步骤如下。
(1)将整理后的数据(表1)上传至Rurrlioz软件(2.0版本),选择最适合的分布模型,对这些点进行参数拟合从而得到SSD曲线[53];(2)导出SSD曲线和其他几个等关键参数,利用Rurrlioz软件计算出HC5及不同浓度暴露下的PAF。
其中,BurrⅢ型函数的参数方程为:
(1)
式中:χ为环境浓度(μg·L-1),b、c和k为函数的3个不同参数(下同)。当k趋于无穷大时,BurrⅢ型分布将变化为Reweibull型分布:
(2)
澳大利亚联邦科学和工业研究组织(CSIRO)提供了SSD曲线拟合方法的说明(版本2.0)[63]。
1.5 HC5和PAF计算
应用Burr Ⅲ型分布计算HC(q)的公式为:
(3)
PAF表示当环境浓度超过生物毒理终点值的物种比例,即在给定污染物浓度条件下,SSD曲线上所对应的累计概率。BurrⅢ型分布计算PAF的公式为:
(4)
在确定的SSD曲线下,HC(q)(在本研究中为HC5)和PAF可以直接由分析软件Rurrlioz(版本2.0)计算出结果。
1.6 急性生态效应阀值急性预测无效应浓度(PNECacute)的计算
上述步骤所求得的HC5一定程度上只能反映微(纳米)塑料对水生生物的急性(短期)影响。因此,为了使SSD曲线拟合得到的结果更好地评估微(纳米)塑料对水生生物的生态风险,且考虑到微(纳米)塑料相关毒理数据不足等因素,需要对求得的HC5作进一步处理,即在毒性数据满足构建SSD曲线数据要求的情况下,使用评价因子法(或称SSD模型外推法)推导其急性生态效应阀值PNECacute[72-74]。评价因子法采用敏感生物的毒性值除以相应的评价因子,其表达形式如下式所示:
PNECacute= HC5,acute/AF
(5)
式中:AF(Assessment Factor)为评价因子,HC5,acute表示应用SSD法构建急性毒理数据(LC50、EC50)敏感性分布曲线,得到的5%危害浓度值。目前国际上对于评价因子的取值仍没有一个明确、统一的标准,但根据欧盟风险评估技术导则规定,当使用急性毒理数据(LC50、EC50)对水体环境PNEC进行推导时,如若收集得到的毒理数据至少包含以下3个不同营养级以上的水生生物时(即鱼类、蚤类和藻类),AF应取值1 000[73]。评价因子主要受毒性数据质量、物种代表性以及模型拟合程度等多个因素共同影响[46],在本研究中,所收集的急性毒理数据包括甲壳类、鱼类、节肢动物蚤科以及绿藻门藻类等5门10科11种水生生物,覆盖范围相对较广,因此AF取值1 000。

表1 微(纳米)塑料对水生生物毒性数据(EC50、LC50)Table 1 Toxicity data of micro(nano)plastic to aquatic species (EC50, LC50)
注:PE为聚乙烯,PS-PEI为聚苯乙烯-聚醚酰亚胺,是一种由羧酸化聚苯乙烯纳米颗粒合成的塑料,PS-NH2为NH2涂层的PS纳米颗粒;在本研究中,单位统一换算为μg·L-1。
Note: PE, polyethylene; PS-PEI, polystyrene-polyetherimide, plastic synthesized from carboxylated polystyrene nanoparticles; PS-NH2, polystyrene MPs coated with NH2; by convention, all the units used to fit the model are uniformly switched to μg·L-1.
1.7 世界典型水域微塑料丰度单位换算及其PAF值计算
利用Web of Science、CNKI等数据库,对国内外公开发表的有关当前全球各个典型淡水水域及海洋表面水体微塑料丰度的相关文献进行收集整理,并将所有微塑料丰度的单位统一换算成μg·L-1,换算后各水域内的微塑料丰度数据如表2所示。单位具体换算方法参考Lusher等[75]的文献,即假定当微塑料形状为圆球状(sphere)、平均粒径大小为25 μm,且平均密度等于0.92 g·cm-3的情况下,900个微塑料颗粒可近似等于7 μg,即1个微塑料颗粒约等于0.0078 μg。最后在水生生物SSD拟合曲线基础之上,利用Rurrlioz软件对全球多个典型水域表层微塑料对水生生物的PAF值进行计算(表2)。
2 结果(Results)
2.1 SSD曲线拟合
图1是利用Reweibull分布模型对被测的全部物种的SSD曲线拟合结果:变形菌门费氏弧菌(Vibrio fischeri)受微(纳米)塑料影响程度最大,绿藻门朱氏四爿藻(Tetraselmis chuii)受微(纳米)塑料的损害程度则最低,且按照大小排列依次为:细菌(费氏弧菌)>甲壳动物端足类(美洲钩虾)>鱼类(虹鳟、小眼长臀鰕虎鱼)>棘皮动物门海胆纲(紫海胆)>甲壳动物桡足类(日本虎斑猛水蚤、模糊网纹蚤以及大型蚤)>藻类(羊角月牙藻和朱氏四爿藻)。当浓度>1 000 μg·L-1后,水生生物受微(纳米)塑料损害的程度迅速增强,但随着浓度不断升高,微(纳米)塑料损害程度增大的趋势变缓慢,最终在浓度为1×105μg·L-1时趋于平稳。
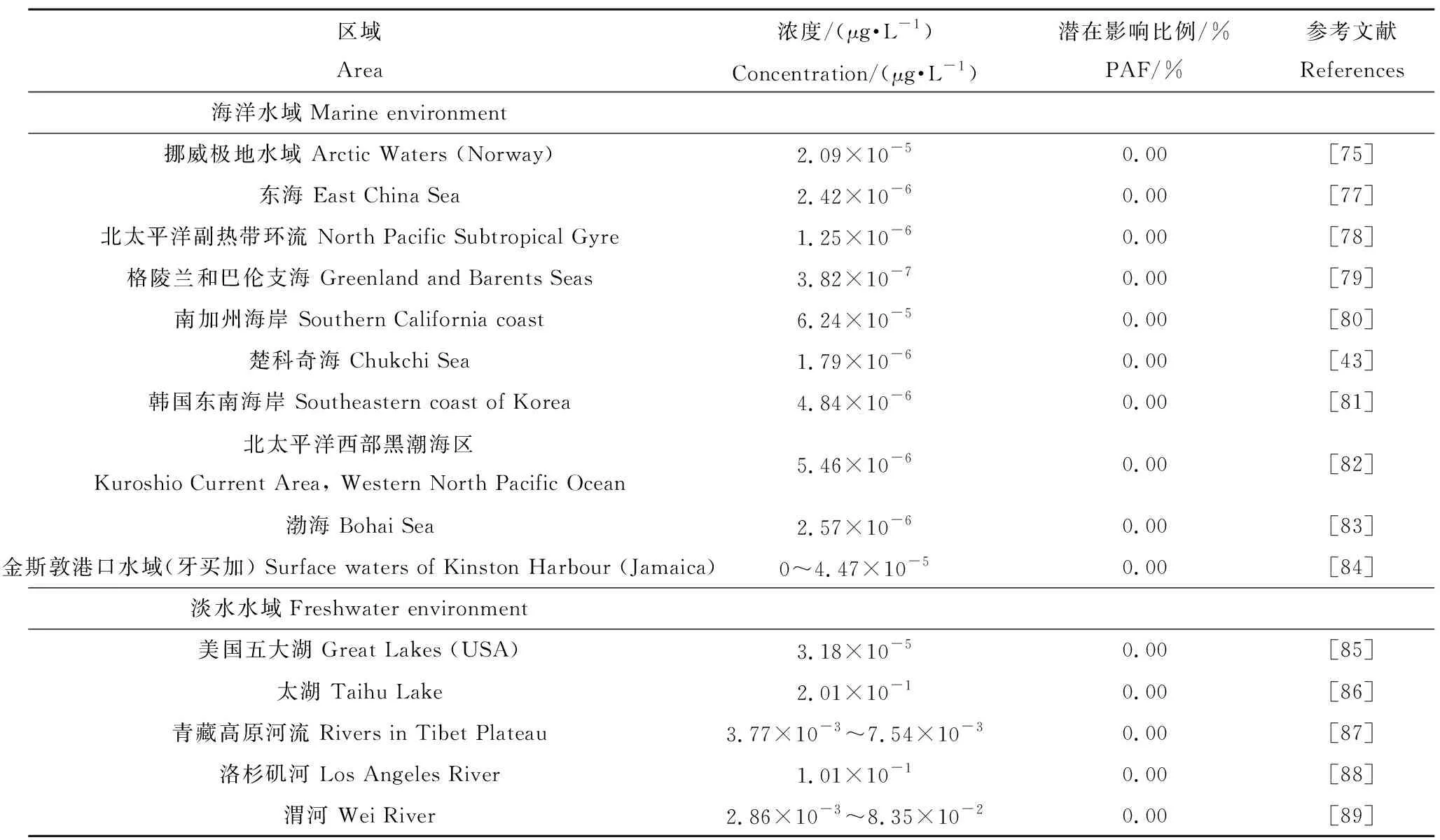
表2 世界部分典型水域内表层水的常见微塑料浓度及潜在影响比例(PAF)预测值Table 2 Predicted potential affected fractions (PAF) values of micro- and nanoplastics under various concentrations in some representative waters
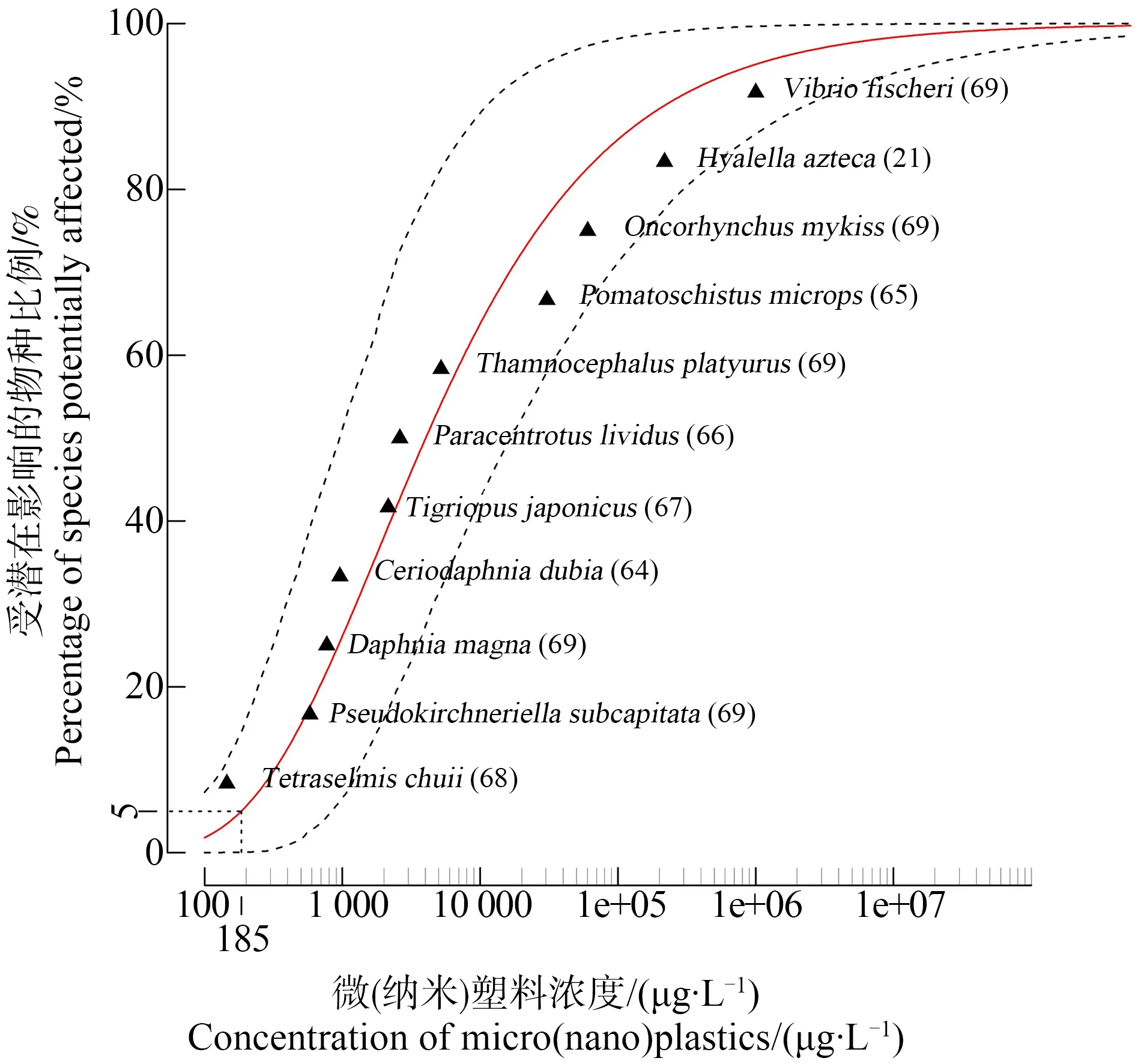
图1 水生生物对微(纳米)塑料的物种敏感性分布(SSD)曲线注:开展暴露实验所用物种的分类地位、微(纳米)塑料颗粒大小及类型等文献有关信息如表1所示;实际物种敏感性分布用红色实线表示,黑色虚线则分别表示上、下置信区间(95%),括号内数字则为对应参考文献的编号。Fig. 1 Species Sensitivity Distributions (SSD) curve for marine organisms exposed to micro- and nanoplasticsNote: The detailed information on the effect data from literatures, i.e. aquatic organisms exposed to micro- and nanoplastics, the size of the particles and the type of micro- and nanoplastics used are available in Table 1. Solid red curve represents SSDs with micro (nano)plastics concentrations expressed in particles per volume. Black dotted lines represent the 95% confidence intervals. Numbers between brackets refer to the listed references.
2.2 SSD曲线拟合结果及急性生态效应浓度阀值的计算
表3拟合曲线所采用的拟合模型为Reweibull,是根据SSD曲线拟合的相关函数值以及由软件计算得到的生态风险阀值HC5。HC5的数值大小表示微(纳米)塑料对水生生物的影响程度,数值越大表示微(纳米)塑料对水生生物体的影响越小。本研究计算得到的SSD曲线95%的置信区间为78~820 μg·L-1,微(纳米)塑料对水生生物的HC5为185 μg·L-1,比Burns和Boxall[76]估算的现实环境中微塑料浓度(MEC)6.63×10-2μg·L-1高出3个数量级。此外,从数据筛选的结果来看,水生生物急性数据满足构建SSD曲线的数据要求,可以使用评价因子法计算微塑料对水生生物的急性生态效应浓度阀值PNECacute,根据欧盟风险评估技术导则规定,评价因子取值1 000,因此PNECacute=HC5,acute/AF=185/1000=0.185 μg·L-1,跟现实环境中的微塑料浓度相差不大,仅高出3倍左右。
2.3 世界部分典型海水水域和淡水水域常见微塑料的生态风险评估
PAF值大小能够反映出不同浓度微塑料对水生生物的损害程度。利用Rurrlioz软件计算得到世界典型水域(包括淡水水域和海水环境)表层水微塑料对水生生物的PAF值如表2所示。所选择的世界部分典型海水水域和淡水水域内微塑料对水生生物的潜在影响比例都为0。此外,结合2.2计算得出的急性生态效应阀值PNECacute,将其与表2各水体中微塑料浓度进行比较后发现:除太湖外,其他水体环境中微塑料的浓度都低于PNECacute。上述结果说明,如果仅考虑微塑料本身的影响,目前这些水域内微塑料浓度对水生生物的损害程度大部分都在可接受范围内。
2.4 微(纳米)塑料不同暴露浓度下对水生生物的PAF值
微(纳米)塑料在不同浓度下得出的对不同海洋生物的PAF值,反映其对不同水生生物的损害程度。如表4所示,当微(纳米)塑料浓度≥10 μg·L-1时,所有水生生物不受影响;随着微(纳米)塑料浓度上升,受到影响的物种比例逐渐上升;在100 μg·L-1下,有2%的水生生物物种会受到微(纳米)塑料的损害;当浓度为1 000 μg·L-1时,受到影响的物种百分比为26%,说明在此浓度下产生的生态风险较大。

表3 利用Rurrlioz软件计算SSD参数的结果Table 3 SSD parameters calculated by Rurrlioz software
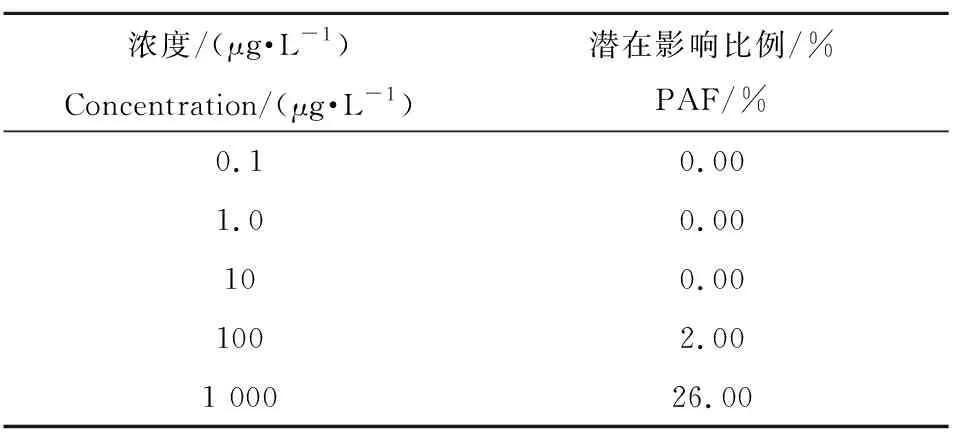
表4 微(纳米)塑料在不同浓度下对水生生物的PAF预测值Table 4 Predicted PAF values of micro- and nanoplastics to aquatic organisms under various concentrations
3 讨论(Discussion)
3.1 微(纳米)塑料急性毒性实验数据的选择
在利用SSD方法进行生态风险评估时,影响研究结果的一个最主要因素就是毒性数据的组成与容量大小[55]。SSD在实际应用中需要考虑急性和慢性毒性数据的选择。目前微(纳米)塑料生物毒性研究绝大多数是急性毒性实验,急性毒性实验通常是用半数致死浓度作为首选的实验终点[90]。虽然慢性数据更接近实际环境中的情况[53,55],但目前能够检索到的微(纳米)塑料对生物最大无影响浓度(NOEC)或最低有影响浓度(LOEC)的研究数据较少。此外,在构建SSD最小数据量的要求上,欧盟要求至少要包括敏感类群中的8个物种,而当受试生物为鱼类时,数据至少要包括5个物种[40,91],US EPA则要求受试生物至少包括3门8科[41]。数据过少会造成拟合优度的下降以及不确定性的增加[92]。然而数据并不是越多越好,数据过多会导致HC5过小,所以应将SSD曲线拟合的数据控制在一个合理的范围[60]。本研究选取了11个物种的急性毒性试验数据,包括5门10科,满足欧盟及US EPA关于SSD构建数据容量的要求。
3.2 物种的选择及敏感性差异的原因
物种的选择对SSD曲线拟合的结果也会有所影响,但主要是由于分类群组成上的差别,而地区分布的差异不会对SSD方法造成显著影响[70]。本研究对收集的生物毒理学数据进行分析,结果显示,不同水生生物对微(纳米)塑料的敏感性差异较大,其原因可能如下:(1)本研究中不同文献对水生生物进行毒理学实验时所用指示终点不同,而不同指示终点的敏感性差异是造成不同水生生物物种敏感性存在差异的原因之一;(2)此外,微(纳米)塑料毒性效应机制的不同也是造成水生生物物种敏感性差异的可能原因之一。目前,微(纳米)塑料对水生生物毒性效应机制研究的相关报道仍较少,主要集中在以下几个方面,即微(纳米)塑料诱导的氧化应激损伤、免疫毒性效应、干扰分泌作用以及抑制细胞生长、破坏细胞结构等[93-94]。如诱导氧化应激机制可通过产生活性氧引起的应激反应,导致细胞损伤,进而降低生物的生长率和繁殖力[95-96];免疫毒性效应机制则可通过损害生物免疫系统的功能如肝脏组织损伤病理水平增加等,从而引起生物免疫力下降或诱发炎症反应等,最终导致个体死亡[97-98]。而干扰内分泌作用机制则可严重影响生物体正常内分泌功能等[99-100]。(3)不同水生生物的生态位存在差异,微(纳米)塑料一般漂浮在水体的表层或下沉聚集在水体沉积物中,而在附近生活的水生生物通常无法区分食物与微塑料之间的差异,比较容易误食微(纳米)塑料[101],从而堵塞其消化道等器官或可引起假的饱腹感,导致营养物质摄入减少、摄食效率降低等一系列生理反应[6,102-103];(4)此外,不同物种所受潜在影响的比例与微(纳米)塑料的粒径大小存在一定关系。SSD结果显示,微(纳米)塑料对羊角月牙藻的生态风险大于朱氏四爿藻,其原因可能是:羊角月牙藻和朱氏四爿藻暴露实验采用的塑料分别为纳米和微米级别,而纳米级塑料被认为对生物的影响大于微米级塑料,因此对生物具有较大的生态风险[104]。由此可见,未来需比较研究具有不同生存机制和适应能力的水生生物对不同形状、材质、颜色及粒径大小微(纳米)塑料的摄取和生物学响应的差异。
3.3 微(纳米)塑料不同材质及粒径大小的选择
目前所开展的微(纳米)塑料毒理实验大多采用聚苯乙烯(PS)[23,25,29,65-69,105]和聚乙烯(PE)[21-22,27,51,64-65,68-69]等材质,此外也有少数的研究人员选用聚氯乙烯(PVC)、聚对苯二甲酸乙二醇酯(PET)和聚丙烯(PP)[65,73]等其他材质。科研人员在开展微(纳米)塑料对水生生物的暴露实验时,会选择不同材质的微塑料,其选择依据可能主要包括:(1)PS和PE是容易购得的2类商品化微(纳米)塑料。此外,PS和PE这2类微(纳米)塑料在大部分海域中占比较大,将其用于研究微(纳米)对水生生物的生态毒性具有代表意义;(2)不同材质的微(纳米)塑料在不同水域内的丰度不同,选择合适的微(纳米)塑料进行暴露实验能够较好地评估微(纳米)塑料对特定水域水生生物的生态风险[106];(3)不同材质的微(纳米)塑料自身携带的添加剂等污染物成分及其吸附其他化学污染物质和病原体的能力不同,对生物体表现出的生物毒性也不同[18,42,107-108]。因此,今后在进行微(纳米)塑料毒理研究时,除了根据受试物种及各种微(纳米)塑料的商品化程度选择适合毒理暴露实验的材质外,还需要考虑基于实际环境中的微塑料存在形式而选择合适的微塑料种类。
3.4 微(纳米)塑料的急性效应阀值的计算
基于微(纳米)塑料相关毒理学研究数据基础上,估算出微(纳米)塑料对全部水生生物的PNECacute为0.185 μg·L-1。然而,全球实际环境中不同类型水域水面漂浮的微(纳米)塑料浓度平均值约为6.63×10-2μg·L-1(8.5 particles·L-1)[76],约为本研究计算得出的急性生态效应阀值PNECacute的30%,表明如果单纯考虑微(纳米)塑料本身对水生生物的毒性,目前现实条件下大存在的大部分微(纳米)塑料对水生生物的影响在可接受范围之内。然而,如表2所示,目前少部分地区(如我国太湖)水体中微塑料的浓度已超过本研究计算得出的急性生态效应阀值,应当引起足够的重视和关注。此外,微(纳米)塑料产生毒性效应的一个重要方式是吸附环境中的其他化学污染物,进而对水生生物产生联合毒性效应。因此,实际环境中微(纳米)塑料对水生生物造成的损害可能大于单纯实验室环境中只考虑微(纳米)塑料本身对水生生物的毒性效应。而随着时间的推移,环境中微(纳米)塑料的丰度还可能持续增加,正如Koelmans等[109]在文章中提到“当前实际环境中微塑料的浓度并不等于未来实际环境中微塑料的浓度”(the realistic concentration of today are not the realistic concentration of tomorrow),其生态风险也将随之增加[110]。另外,Kooi等[111]认为,考虑到表面取样方法等因素,微塑料浓度被低估了,应为目前所测浓度的30倍以上,因而现实环境中微塑料可能会对近岸热点区域内对微塑料敏感的生物造成风险[71]。综上分析,今后应着重开展微(纳米)塑料在现实环境浓度水平下的毒性效应及机理研究,为生态风险评估提供更为全面的数据。
3.5 SSD方法对于微塑料等新型污染物风险评估的适用性分析
SSD法常被用于评估包括苯胺、重金属、杀虫剂或灭鼠剂、多环芳烃以及农药等污染物的毒性阀值及其对水生生态或土壤环境的生态风险[47,57-61]。相较于其他传统的污染物,微(纳米)塑料具有不易降解、尺寸小以及吸附其他化学污染物和病原体的特点,对水生生物表现出不同的生物毒性和影响途径。而由于其不确定性,生态风险评估的传统方法往往无法客观、准确地评估微塑料等新型污染物的生态风险。这种不确定性主要来源于污染排放、暴露变异性和物种敏感性3个方面,其解决方法一般包括修正系数、统计概率和Monte Carlo模拟技术等几个途径[62]。与传统方法不同,SSD曲线拟合方法摒弃了以往单一受体(物种)和单一化学污染物的模式,通过选择某一概率分布、从生态系统的角度来描述和分析某一污染物对一系列物种的毒性,一定程度上解决了传统方法的不确定性,可以有效地评估微(纳米)塑料等新型污染物的生态风险。
3.6 建议
与其他方法相比,SSD方法用于微塑料的生态风险评估既可以节约大量的人力和物力,又能够保证评估结果的科学性[61]。然而,目前国内外利用SSD对全球范围内微(纳米)塑料生态风险评估的研究极少,这种技术仍处于起步阶段[61]。鉴于全球水体环境中塑料及微(纳米)塑料含量的不断增加,应尽快开展微(纳米)塑料对我国水域内水生生物的生态毒理学研究与生态风险评估,以便为水生生态风险评价和管理提供参考,从而有效控制塑料及微(纳米)塑料污染。此外,建议对SSD研究中物种数量选择、拟合模型选择以及物种数量的选择等进行标准化评估。

