农药对秀丽隐杆线虫毒性效应及其机制的研究进展
华欣,陈海波,李杰,向明灯,王亚娥,#,于云江,*
1. 兰州交通大学环境与市政工程学院,兰州 730070 2. 生态环境部华南环境科学研究所,广州 510535 3. 国家环境保护环境污染健康风险评价重点实验室,广州 510535
秀丽隐杆线虫(Caenorhabditis elegans),以下简称为秀丽线虫,一般是雌雄同体,常以大肠杆菌为食。秀丽线虫是一种生活在土壤中的无脊椎动物,在土壤生态系统中具有重要地位。因其体积小(体长约1 mm)、通体透明、易于保存与培养、繁殖速度快、完整的基因组已知和对毒物的敏感性高等优势,在环境毒理学得到广泛应用[1]。秀丽线虫作为一种良好的模式生物,多种指标体系已经被广泛用于评价环境污染物毒性效应及其机制。秀丽线虫的暴露方式主要有水、土和琼脂暴露3种方式,毒性评价指标主要集中在致死率、生长发育、运动行为、繁殖、活性氧自由基(ROS)水平、细胞凋亡水平、相关基因表达量和相关蛋白水平等[2-3]。
本文总结农药对秀丽线虫毒性效应与其作用机制,为相关的环境管理政策的制定提供毒理学参考及支持。
1 农药的环境赋存及毒性效应(Occurrence and toxicity of pesticides)
农药,指为促进农作物健康生长,用于防治有害生物以及调节植物生长、去除杂草等一类药剂的总称。根据其防治对象,分为杀虫剂、杀菌剂、除草剂和杀鼠剂等[4]。目前,国内外对于农药的研究主要侧重于杀虫剂,例如有机磷类、有机氯类、拟除虫菊酯类和氨基甲酸酯等[5]。农药因其减少病虫害和提高农作物产量等特点而被广泛使用,并在农业生产中发挥着重要的作用。但多数农药具有高残留、剧毒、易迁移和难降解的特性,在生产与使用过程中会通过挥发、沉降等过程进入环境介质中。有研究表明,农药在大气、水体和土壤中均被检测到,说明农药对生态环境造成污染[6]。进一步研究发现,在不同的环境介质中,农药残留浓度有一定差异。例如,在大气介质中检测到灭菌丹、毒死蜱和二甲戊灵,浓度范围在7 pg·m-3~407.79 ng·m-3之间[7]。而在珠江三角洲地区的农用地中,97.85%的土壤中均检测到有机氯农药(OCPs),平均残留浓度为20.67 μg·kg-1[8]。Deknock等[9]对淡水环境中的农药分布进行调查,发现硫线磷、丁草胺和二甲戊灵的浓度分别高达0.081、2.006、0.557 μg·L-1。
农药因具有亲脂性、生物累积性和生物富集性等特征,容易通过食物链传递进入生物体。连子如等[10]在青岛市近海的鱼类、软体类和虾类等生物体内检测到了不同浓度的有机氯农药,平均含量为1 044.25 ng·g-1。农药对生物酶和免疫系统造成损伤,并造成遗传毒性、神经毒性、生殖和发育毒性[11]。最终富集于人体,对人体健康产生不利的影响[12-13]。研究表明,农药具有致癌性和细胞毒性,与人类的很多疾病有关,如帕金森病、非霍奇金病、糖尿病、内分泌干扰、神经失调、免疫和呼吸抑制[5,14-15]。
近年来,国内外学者将秀丽线虫用于农药的毒理学研究,如久效磷(monocrotophos)[16-18]、乐果(dimethoate)[19]、敌敌畏(dichlorvos)[20-22]、毒死蜱(chlorpyrifos)[23-24]、草甘膦(glyphosate)[2,25-26]、马拉硫磷(malathion)[27-29]和氯氰菊酯(cypermethrin)[20,30-31]等。
2 农药对秀丽线虫的衰老性影响的研究(Ageing effect of pesticides in C. elegans)
衰老和死亡是生物体正常的生理活动,但污染物的暴露会加速生物体的衰老和死亡过程。秀丽线虫从卵到成虫的时间只有3 d,且秀丽线虫的寿命仅有2~3周,因此选用秀丽线虫为模式生物研究农药对生物体的衰老和致死性的影响。表1梳理并总结了不同农药对秀丽线虫的寿命和致死率的影响。
2.1 秀丽线虫的农药暴露时期的比较
环境污染物的暴露途径一般包括皮肤接触、呼吸道摄入和摄食3种,因秀丽线虫没有呼吸系统,则主要以与毒物表面接触和摄食进行暴露。目前,关于农药对秀丽线虫的衰老和致死性影响的研究,国内外学者选取了不同时期的幼虫进行实验,如L1期-幼虫、L3期-幼虫、L4期-幼虫或年轻成虫[39-40]。农药因其毒性大小的不同,对秀丽线虫的暴露时间和浓度都不相同。常用暴露时间有4、6、12、24、36、48和72 h,而对于毒性较强的农药常以急性暴露来评价[19,36,38,41]。例如,将敌敌畏暴露液与秀丽线虫置于96孔板染毒24 h,观察秀丽线虫在2、4、12和24 h的死亡情况[22]。王云彪等[26]将野生型秀丽线虫在草甘膦染毒液中暴露24 h,观察其毒性效应。此外,秀丽线虫在0.1、1和10 μmol·L-1的硫丹中分别暴露6、12和24 h,结果发现秀丽线虫的寿命相应缩短[32]。
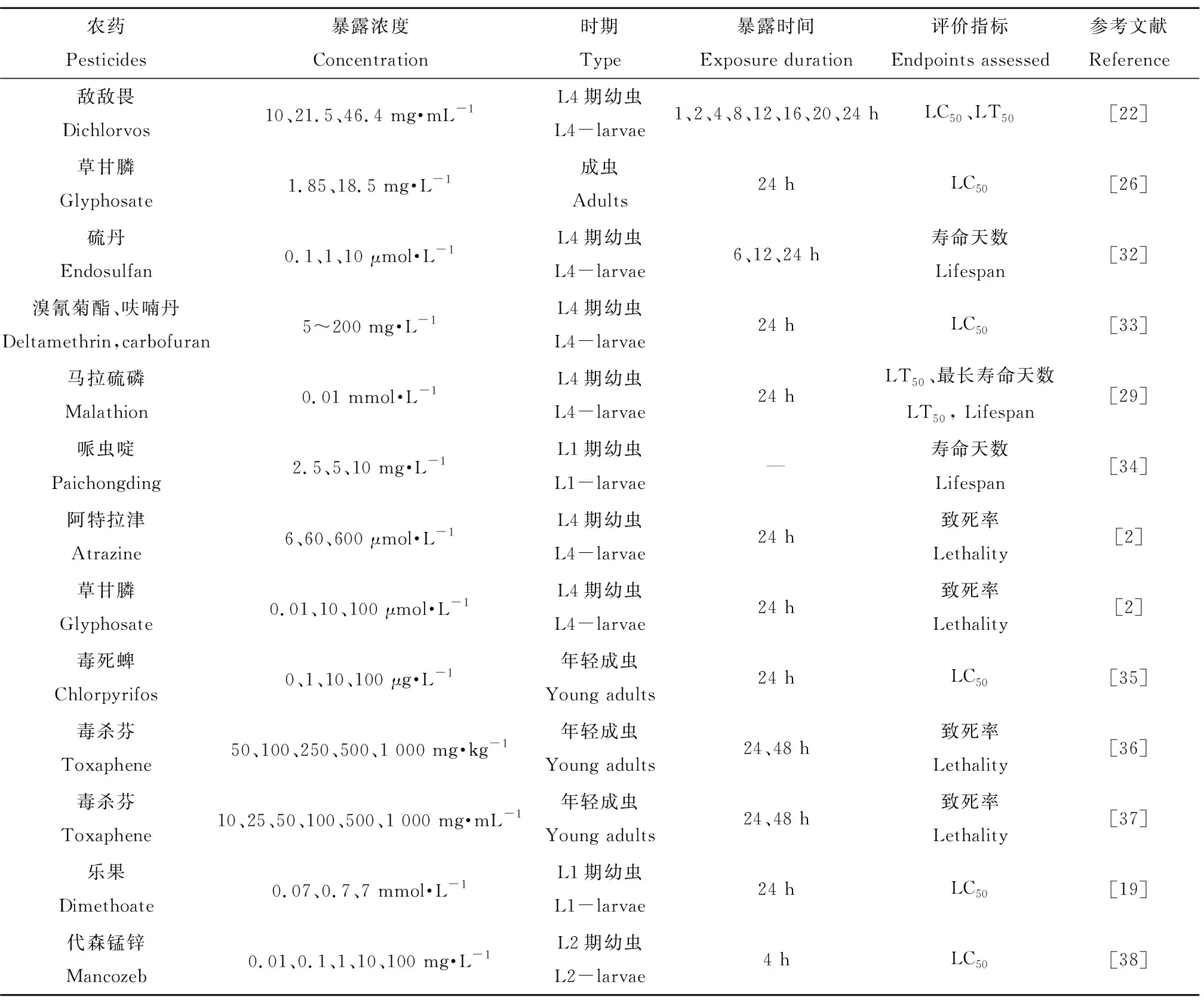
表1 农药对秀丽线虫的衰老性影响Table 1 The ageing effect of pesticides in C. elegans
注:LC50表示半数致死浓度,LT50表示半数致死时间。
Note: LC50stands for median lethal concentration; LT50stands for median lethal time.
2.2 农药对秀丽线虫致死性的影响
秀丽线虫致死性的评价指标已较为成熟,常用致死率进行评价。目前国内外学者将秀丽线虫暴露于毒死蜱、毒杀芬和乐果等农药,通过测定其致死率指标来评价农药毒性大小。致死率常用Probit衍生的半致死浓度(LC50)来表示,以对铂丝刺激没有反应作为秀丽线虫死亡的标准,评价急性暴露的短期效应[41]。例如,将L4期秀丽线虫在20 ℃下暴露于溴氰菊酯和呋喃丹24 h,在解剖显微镜下对活虫和死虫的数量进行统计。实验发现,溴氰菊酯对秀丽线虫的LC50为55.8 mg·L-1。而在相同条件下,呋喃丹对秀丽线虫的LC50为29.8 mg·L-1[33]。农药因结构、物理及化学性质的不同,呈现出一定的毒性差异。Garcia-Espineira等[2]发现阿特拉津在6、60和600 μmol·L-1下,分别产生了12%、15%和18%的致死率。但草甘膦显示出更强毒性,在0.01、10和100 μmol·L-1下分别产生20%、50%和100%的致死率,反映出极强的浓度依赖性。虽然致死率可以很直观地表现出农药毒性的大小,但对于低浓度长时间暴露的影响更需要与其他指标的结合。
2.3 农药对秀丽线虫衰老性的影响
对于秀丽线虫衰老程度的评价,主要测定寿命天数和半数致死天数(LT50)。寿命天数以秀丽线虫群体生存的最长天数计数;半数致死天数,常指实验活体秀丽线虫占总实验秀丽线虫一半时的天数。寿命天数和LT50表示出急性暴露的长期效应,常用于深入研究毒物的长期毒性。韩焱等[29]和Du等[32]分别研究了秀丽线虫暴露于硫丹、马拉硫磷后的寿命变化和致死情况。结果发现,暴露于10 μmol·L-1的硫丹和1 mmol·L-1的马拉硫磷后,秀丽线虫的寿命有一定程度的减少,但未观察到秀丽线虫的急性致死效应。研究表明,农药对秀丽线虫并未呈现出显著的致死毒性,只是加速了秀丽线虫的衰老。有研究表明,哌虫啶(IPP)和其中间体M1显著减少了L1期秀丽线虫的寿命,且随着暴露浓度的增加,线虫寿命相应地减少,呈现出一定的浓度依赖性[34]。
2.4 农药加速秀丽线虫衰老的机制研究
在衰老性机制的研究中,主要通过对蛋白质、脂质和DNA等生物大分子损伤作用进行分析确定。一方面,观察线粒体活动及活性氧水平(ROS)相关基因的变化,如hsp-6、hsp-4、gst-4、sod-3和clk-1等;另一方面,测定胰岛素信号通路(IIS)相关基因,如daf-2、daf-16、age-1和sod-3等[42]。Bian等[34]对哌虫啶致衰老的机制进行研究时,采用RT-PCR技术对靶向基因(daf-2、daf-16、age-1、sod-2和sgk-1等)进行相对定量分析。结果发现,暴露于5 mg·L-1的IPP或M1后,sod-2、sgk-1和daf-16的基因表达水平减少,而age-1和daf-2的基因表达水平增加。这表明,哌虫啶通过影响胰岛素信号通路的相关基因,进而影响秀丽线虫的寿命。
秀丽线虫的衰老程度和死亡率与农药浓度密切相关。致死率通常用来表示高浓度农药的毒性大小;而对于低浓度农药,常利用衰老性指标来评价毒性。一般情况下,农药的浓度越高,秀丽线虫的衰老程度越明显,死亡也越明显;农药浓度越低,线虫的死亡率越低甚至没有,但依然存在一定程度的衰老。对于农药毒性大小的研究,衰老程度和致死性指标可结合起来,综合考察农药对线虫的毒性。另外,通过测定衰老相关基因水平的表达,有助于农药毒性机理的更深层次探索。
3 农药对秀丽线虫的神经毒性的研究(Neurotoxicity of pesticides in C. elegans)
许多农药通过影响目标生物的神经系统发挥作用,但同时也对非目标生物体的神经系统产生毒性效应。目前,研究神经毒性的模式生物主要是鱼类和鼠类,但因其个体大、神经系统较为复杂等原因,对神经毒性的研究受到一定程度的限制。秀丽线虫的神经系统较为简单,行为有限,减少了复杂因素的干扰,更有利于研究农药对秀丽线虫的神经毒性。表2梳理并总结了农药对秀丽线虫神经的影响。
3.1 农药对秀丽线虫的神经毒性效应
生物体行为的变化,代表了毒物对秀丽线虫神经系统的可测影响,可以用肉眼或显微镜进行捕获和分析。目前,以秀丽线虫为模式生物进行神经毒性的研究,常用的评价指标包括运动行为(头部摆动频率、身体弯曲频率和咽泵运动)、学习行为(对NaCl的趋向性、温度趋向性)、觅食行为(菌落的接触率、嗅器弯曲位置和频率)、记忆行为、乙酰胆碱酯酶活性和多巴胺神经元变性[3,38,45-46]。Ruan等[25]将L4期秀丽线虫暴露于三氟氯氰菊酯,并以运动行为(头部摆动频率、身体弯曲频率)、生殖(后代数目、世代时间)和发育(虫体尺寸)为指示终点。结果发现,在高浓度的三氟氯氰菊酯中暴露72 h后,对发育和生殖指标没有产生显著性影响,但秀丽线虫的头部摆动频率和身体弯曲频率显著减少,这表明秀丽线虫运动行为对农药的神经毒性较为敏感。另一项研究证明,秀丽线虫暴露于有机磷杀虫剂久效磷,其运动、学习和觅食行为受到威胁,在高浓度下甚至造成了严重缺陷[18]。
3.2 农药对秀丽线虫神经毒性的机制
秀丽线虫是一种结构简单的模式生物,体内含有959个细胞和302个神经元,且已经有学者对其神经元谱系进行了充分描述。其中,秀丽线虫的运动神经元有75个,通常通过多个神经元和神经元突触之间的传递调节运动行为[47-48]。农药对秀丽线虫的神经毒性机制的研究主要有2个方面。一方面,通过抑制秀丽线虫体内乙酰胆碱酯酶(AChE)活性,导致突触中积累大量的乙酰胆碱(ACh),影响乙酰胆碱的正常代谢,使得神经纤维持续兴奋,干扰神经系统功能,从而造成秀丽线虫的神经毒性[11,18,49]。例如,Rajini等[43]利用乐果、敌敌畏和久效磷等10种有机磷农药对秀丽线虫进行急性暴露4 h后,暴露组秀丽线虫的乙酰胆碱酯酶活性受到抑制,运动速率降低,表现出显著的神经毒性效应。另一方面,通过对多巴胺能、羧酸酯酶活性和血清素等非胆碱能系统进行干扰,对中枢神经系统(CNS)造成一定程度的损伤,从而产生神经毒性[17,38,50]。Wu等[44]将秀丽线虫暴露于0.5~10.0 μmol·L-1鱼藤酮(RO)和0.2~1.6 mmol·L-1百草枯(PQ) 3 d,结果发现RO和PQ均会造成运动缺陷和多巴胺能变性;进一步对相关突变体进行研究,结果证实hop-1和pink-1通过诱导线粒体相关膜(MAMs)的线粒体自噬和内质网应激的改变,使RO和PQ造成了神经损伤,从而诱发帕金森病。通常情况下,对于秀丽线虫的神经毒性,胆碱能系统和非胆碱能系统在秀丽线虫体内同时起作用。在亚致死浓度的久效磷(MCP)中暴露4 h,AchE和羧酸酯酶(CaE)活性都受到了强烈的抑制[16]。
通过考察秀丽线虫的各种行为(运动、学习和觅食等)指标的变化,综合评价农药对秀丽线虫的神经毒性。此外,通过测定相关酶活性(如乙酰胆碱酯酶、非胆碱酯酶等),进一步探索农药对秀丽线虫的神经损伤机制。目前对于相关神经毒性机制的研究,主要考虑胆碱能系统的影响,但对非胆碱能系统的研究较少,且造成非靶生物神经毒性的主要因素还需进一步深入研究。
4 农药对秀丽线虫的生殖毒性的研究(Reproductive toxicity of pesticides in C. elegans)
农药长时间积累于生物体内,会对生物体的生殖产生一定的影响。由于哺乳动物的发育时间较长且生殖周期较为复杂,近几年国内外学者逐渐开始以细胞、胚胎或无脊椎动物进行生殖毒性的研究。秀丽线虫作为一种无脊椎动物且其与人类基因同源性高达60%~80%,因此可用于生殖毒性的研究[51]。表3列举了大量国内外关于农药对秀丽线虫生殖毒性方面的研究现状。

表2 农药对秀丽线虫的神经毒性Table 2 The neurotoxicity of pesticides in C. elegans

表3 农药对秀丽线虫的生殖毒性Table 3 The reproductive toxicity of pesticides in C. elegans
4.1 农药对秀丽线虫的生殖毒性效应
农药在秀丽线虫的发育繁殖中会产生生殖毒性,评价秀丽线虫生殖毒性的指标有发育指标和生殖指标2个方面。发育指标包括体长、体宽、虫体面积和是否出现畸形发育。体长通常是经过火焰轻微灼烧热处理后,在显微镜下观察并利用ImageJ计算其长度(沿其身体的体轴纵向长度);体宽以虫体产卵部位的横向宽度为标准;虫体面积是体长与体宽的乘积。韩焱等[29]对马拉硫磷染毒后的秀丽线虫的体长、体宽和体面积进行测量,结果发现,与对照组相比,暴露组秀丽线虫的体宽没有显著差异;与对照组相比,暴露组秀丽线虫的体长和虫体面积呈现出显著性差异(P<0.01),表明马拉硫磷对秀丽线虫个体发育具有毒性效应。
生殖指标通常指后代数目、世代时间、生殖腺生殖细胞数目、精细胞数目和大小、排卵速率和单侧性腺臂卵母细胞形态等。在环境中外源性化学物质的影响下,秀丽线虫的生殖腺会发生一定程度的细胞凋亡,从而诱导了生殖系统的毒性效应。例如,Jones等[54]将L1期幼虫分别暴露于浓度为EC29(0.634 μmol·L-1)和EC50(0.385 μmol·L-1)的毒死蜱中,对其后代数目进行了统计。结果发现,与对照组相比,暴露于EC29后秀丽线虫的后代数目减少了16%,而暴露于EC50后减少了45%,表明毒死蜱对线虫的生殖造成了影响。同样地,Ruan等[24]对暴露于0.003、0.03、0.3和3.0 mg·L-1毒死蜱中的L4期幼虫进行分析,发现后代数目减少。除此之外,在不同暴露浓度下均观察到秀丽线虫育雏大小和精子细胞尺寸的减小,异常精子细胞数量和凋亡细胞数量增加,影响了精子活动和卵母细胞的受精,结果表明不同浓度的毒死蜱通过抑制了精子细胞的活化,进而导致秀丽线虫的生殖毒性。
不同的暴露时间也会对秀丽线虫的生殖系统产生影响。阮秦莉等[31]发现暴露于0.08、0.8和8 mg·L-1的氯氰菊酯48 h后,秀丽线虫的后代数目、子宫内受精卵数目和排受精卵速率显著降低。然而将L4期秀丽线虫暴露于氯氰菊酯(浓度为1、5和15 mmol·L-1)4 h后,后代数目和产卵量均有显著减少,表明氯氰菊酯对秀丽线虫产生一定的生殖毒性[30]。
4.2 农药对秀丽线虫生殖毒性的机制
对于秀丽线虫生殖毒性机制的研究,主要包括活性氧(ROS)水平、生殖相关基因表达。而农药生殖毒性机制的研究,主要在内分泌干扰作用、生殖细胞凋亡、生殖细胞周期阻滞和DNA损伤等方面。活性氧水平反映出秀丽线虫的氧化应激损伤,可评价对生殖系统的毒性效应。戴抒豪等[52]研究了十氯酮对秀丽线虫生殖情况的影响,研究发现,与对照组相比,暴露组秀丽线虫的后代数目和生殖细胞数目均发生显著性减少,并且暴露组线虫的世代时间也发生了一定程度的延长。此外,对秀丽线虫体内活性氧水平和性腺相关的单侧性腺远端顶细胞(DTC)细胞进行测定,发现线虫体内活性氧水平明显升高,并且DTC细胞荧光强度明显减弱,表明性腺是十氯酮对秀丽线虫生殖毒性的靶器官,且毒性机制与氧化应激损伤有关。
生殖相关基因可从分子层面上对秀丽线虫进行调控,进而产生一定的生殖毒性。戊唑醇对秀丽线虫的生殖毒性影响包括2个方面:一方面,通过影响与精子发生过程相关的daf-2、akt-1、daf-16和age-1基因表达量的变化,使得生殖腺生殖细胞(精细胞)数目减少,导致精子发生过程的异常;另一方面,精子形成相关的基因(try-5、spe-4、spe-6、fer-1和swm-1)表达量的上升,导致精子变小和活化能力降低,从而产生生殖毒性[53]。此外,Ruan等[24]将秀丽线虫暴露于毒死蜱后,对生殖细胞的变化的机制进一步研究,发现与精子细胞大小、精子细胞活化和形态、卵母细胞形态、卵母细胞功能和细胞凋亡有关的spe-10、spe-15、fer-1、prg-1、glp-1、mlh-1、cyb-3、ced-3、ced-4和ced-9的基因表达发生了改变。这表明,通过影响精子和卵细胞的产生,对秀丽线虫产生生殖毒性。
秀丽线虫的生殖毒性主要体现在个体发育和繁殖2个方面,后代数目、卵母细胞和精细胞形态的变化均可反映出显著性差异。一般情况下,农药暴露浓度越高,生殖毒性越强,呈现浓度依赖性现象。同时,活性氧水平和生殖相关基因的表达,可进一步验证生殖毒性的靶向器官,更深入地了解生殖毒性机制。
5 研究展望(Research prospect)
近年来,环境污染物对生态环境和人体健康的影响,受到了国内外学者的广泛关注。由于秀丽线虫具有通体透明、培养周期短和基因组已知等独特优势,秀丽线虫在环境污染物毒性评价研究中的应用更为成熟,已成为毒理学研究的重要手段。基于秀丽线虫的各类指标综合评价农药对线虫的毒性效应。同时,从分子层面揭示出农药对秀丽线虫潜在毒性机制。本文旨在总结以秀丽线虫为模式生物,从衰老性、神经毒性及生殖毒性3个方面,对有机磷、有机氯和拟除虫菊酯等农药的毒性效应及机制进行研究。
尽管目前关于秀丽线虫对农药在毒理学方面的研究较多,但仍有以下几方面的不足:
(1)目前的研究主要集中在单一高浓度农药暴露对秀丽线虫的毒性效应,然而对环境浓度下的农药毒性效应的研究相对较少。实际环境中农药残留量较低,但多种低剂量农药联合作用会对人类产生危害。同时,环境中污染物的种类和相互作用具有多样性和多变性,实验室模拟研究中无法全面考虑到各种影响因素。
(2)目前大多数实验对毒性效应的评估主要集中在一代秀丽线虫的暴露,忽略了农药对秀丽线虫的多代毒性。农药的毒性具有潜在性和遗传性,在传代过程中毒性被激活或增强。
(3)目前对于毒性机理的研究,对于基因表达和潜在分子机制的研究不够全面。基因和蛋白质的表达密切相关,通常需对一定时间或环境条件下生物体内的所有基因和蛋白质进行综合分析。因此,为了更好地研究潜在的毒性机制,需进行系统的基因组学与蛋白组学分析,更精确地确定信号通路。
致谢:感谢课题组全体成员在论文撰写过程中的帮助与支持。

