氧化石墨烯抗菌性及生物安全性研究进展
宋雅丽,王林变,高莉,2,*,孙友谊,王海宾,赵英虎,柴艳芳
1. 中北大学化学工程与技术学院,太原 030051 2. 山西医科大学基础医学院,太原 030001 3. 中北大学材料科学与工程学院,太原 030051 4. 中北大学环境与安全工程学院,太原 030051
氧化石墨烯(graphene oxide, GO)是单层碳原子以sp2杂化形式存在的二维蜂窝状晶格结构[1],是石墨烯的衍生物,故具备了石墨烯易导热、强机械特性等卓越的性能;同时因其表面含有丰富的含氧官能团,如羟基、羧基和环氧基等,使得GO具有了大比表面积且表面易修饰的优良特性,也使得其在水和大多数极性有机溶剂中具有良好的分散稳定性、亲水性和生物相容性[2]。由于GO的诸多优良特性,目前已被批量生产并广泛应用于光伏电池、抗菌和生物医学等方面[3-5],尤其在生物医学方面,GO已在成像、癌症治疗和药物输送、疫苗增强剂等领域成为研究热点[6]。但大规模的使用使得GO不可避免地流入空气、水或土壤等环境介质和生物体内,不仅生态安全受到了影响,人类健康也受到了威胁,引发了公众对GO生物安全性问题的高度关注。本文综述了近几年GO的抗菌性和生物安全性的研究进展,旨在更全面地揭示其生物安全性,为GO有效安全的使用作出指导。
1 GO的抗菌性研究(Antibacterial research of GO)
1.1 GO的抗菌性
近年来,大量研究表明,GO对细菌、真菌和病毒均具有较强的抑菌效果,如表1所示。
由表1可知,GO对3种微生物的毒性影响来看,其对细菌的毒性最大,且均具有浓度依赖性。
但在某些情况下,GO对菌种的生长却显示出良好的促进作用。Ruiz等[11]首次于2011年证明,GO可作为细菌黏附的骨架,促进其生长、增殖和形成细菌生物膜。Varela等[12]将GO纳米颗粒给予流感嗜血杆菌后,GO诱导了菌落形成单位(CFU)的增加。Hui等[13]发现,200 μg·mL-1的GO在LB培养基中与大肠埃希菌作用3 h后,细菌存活率可达97.95%。实验证实,GO可以通过非共价吸附LB培养基中的蛋白、牛血清蛋白和色氨酸等成分,这些蛋白物质覆盖GO后导致其丧失抗菌能力。
1.2 GO的抗菌机制
GO的抗菌机制主要体现在5个方面。(1)GO片层上的大量含氧基团能与组成细胞壁的糖类或者蛋白质形成氢键,将细胞包裹起来使胞内外物质交换受阻,从而使细胞缺乏营养物质而死亡。(2)GO锐利的边缘能够破坏细胞膜,大量胞质流出而产生空腔结构,最终能破坏细菌或真菌结构和功能的完整性导致细菌死亡[14]。(3)GO可以通过非活性氧机制诱发氧化压力,导致细胞物质被氧化,破坏细胞内部组成致细胞死亡[15-16]。(4)氧化应激。高浓度能完全包裹菌体,主要依赖于隔绝营养物质来发挥抗菌性,但低浓度下,GO不能完全包裹菌体,所以主要靠氧化应激对壁和膜的破坏来抗菌[6]。(5)高浓度(>3 000 mg·L-1)GO还可能通过改变细菌细胞的离子通道而使离子溶出细胞体外,从而导致细菌细胞因生理活性丧失而死亡[17]。
相比于对GO抗菌机理的研究,人们对其抗病毒机理的研究较少,有学者认为GO的抗病毒机理主要依赖于其特有的单层结构及其所带的负电荷,带负电荷的GO在病毒进入细胞前与病毒静电结合,其单层片状结构所致的锋利边缘导致了病毒结构的破坏[10]。
此外,GO的抗菌、抗病毒性能还与其尺寸有关。大尺寸GO更容易覆盖在细菌细胞表面,从而限制细胞膜上的生命活动,比横向尺寸小的GO抑菌效果好[18]。
2 GO的陆生生物毒性研究(Terrestrial biological toxicity of GO)
2.1 GO的陆生植物毒性效应研究
2.1.1 GO对陆生植物的毒性
GO的排放会对环境中的植物产生一定影响。有研究显示,土壤会阻隔GO的运输,所以低浓度的GO对植物毒性是不明显的,但在一些有阳离子存在的土壤中,GO因吸附作用会与之产生联合毒性,从而影响植物的正常生长,而高浓度的GO会大量积累在植物根部,少量会进入植物体内的其他部位,最终影响植物的干重、含水量和叶绿体等的指标,如表2所示。
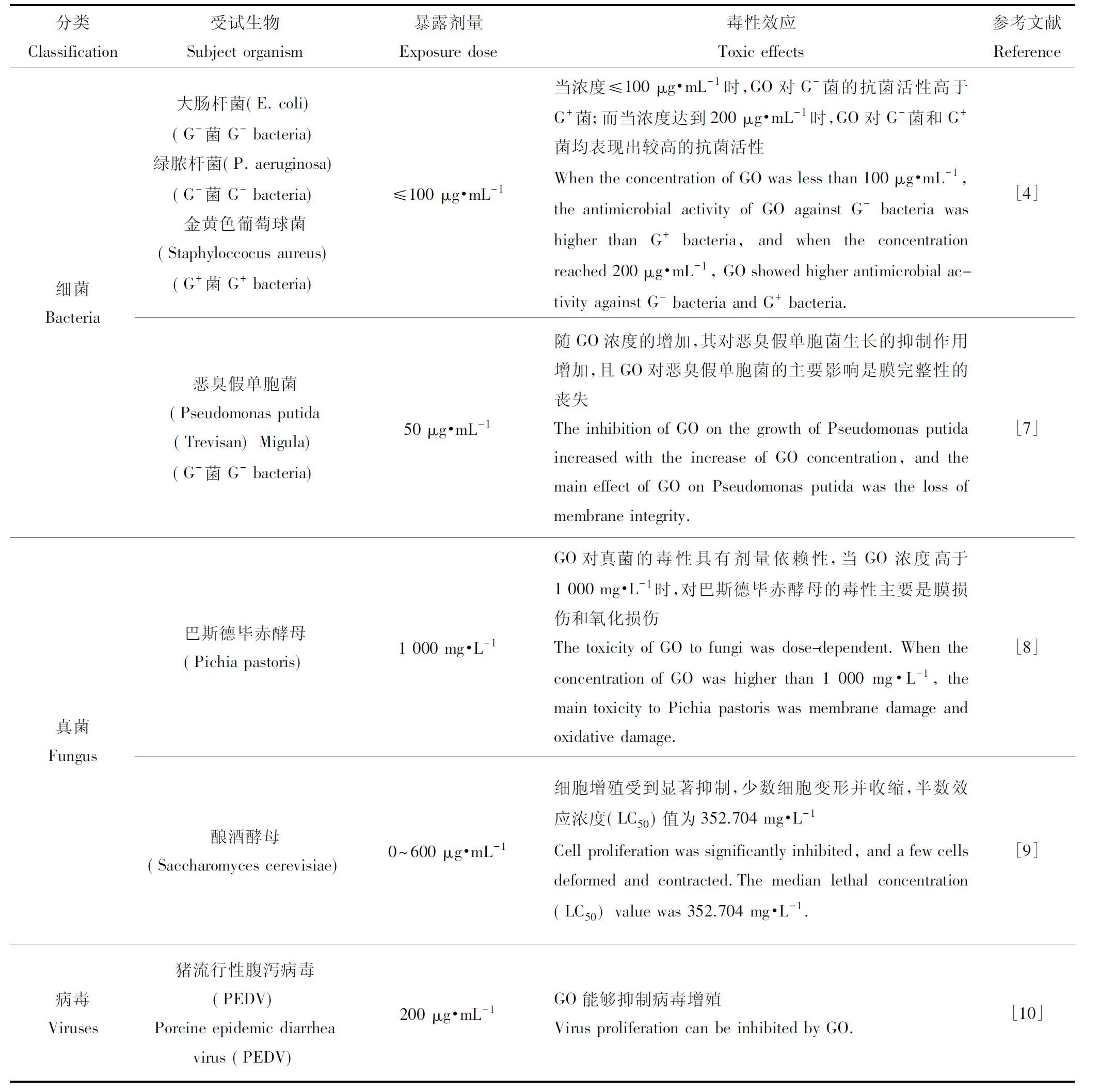
表1 氧化石墨烯(GO)对细菌、真菌和病毒的毒性Table 1 Toxicity of graphene oxide (GO) to bacteria, fungi, and viruses
2.1.2 GO对陆生植物的毒性机制
GO对植物的毒性机制总结为以下6个方面:(1)氧化应激;(2)通过调节植物激素对植物产生毒性;(3)GO和植物细胞之间的相互作用,引起与关键生物过程相关物质代谢的紊乱;(4)在植物根部大量富集,阻碍了植物对营养物质的吸收与利用[19];(5)高浓度GO的富集可能会使环境中的渗透压增大,从而降低根皮质细胞的直径并导致细胞收缩和变形;(6)GO抑制了碳水化合物(例如吡喃葡萄糖和麦芽糖)和氨基酸(例如缬氨酸和脯氨酸)代谢,使得不饱和脂肪酸和饱和脂肪酸的比例增加[25]。
2.2 GO的陆生动物毒性效应研究
2.2.1 GO对陆生动物的毒性
GO一旦进入动物体内会随着血液流通到身体的各个部位,不同部位对GO的敏感程度是不同的,如表3所示,所以近几年人们通过对动物的呼吸、生殖、感官和循环等各大系统的大量研究来评估GO的动物毒性及其毒性机理。
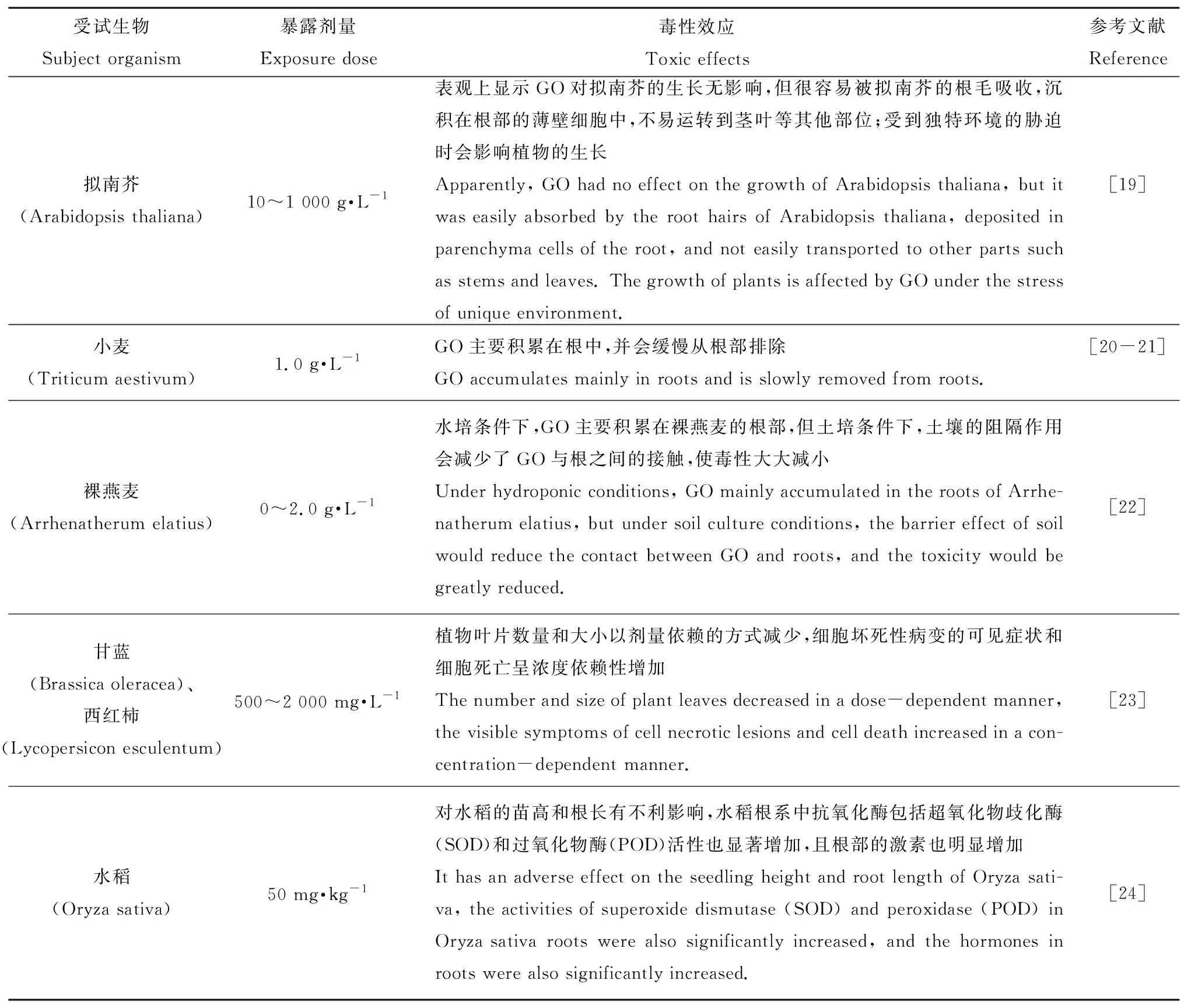
表2 GO对陆生植物的毒性Table 2 Toxicity of GO to terrestrial plants
2.2.2 GO对陆生动物的毒性机制
GO对动物的毒性机制可以从以下2个方面来阐明。从细胞水平上来看,GO对动物的毒性机制总结为以下3点。(1)质膜损伤:GO可以从双层质膜中抽取磷脂分子造成膜损伤,导致孔形成和水分子流入膜中[39];(2)氧化应激:这2点在GO诱导的动物毒性中起到了关键性作用[40];(3)GO的疏水区域和膜的脂质尾部之间的强分散相互作用[41]。从分子水平上,GO的动物毒性机制可能跟其与蛋白质、RNA等生物大分子相互作用有关。具体的毒性机制总结为以下5点。(1)与细胞膜上的蛋白受体直接作用,封闭蛋白活性位点,影响细胞正常的信号通路,抑制蛋白功能的正常发挥[35];(2)GO暴露通过调节某些基因在遍在蛋白连接酶复合体(APC)中的表达、调节某些蛋白的正常表达来破坏主要和次要靶器官的功能[42];(3)形成GO-溶菌酶复合物,破坏溶菌酶蛋白的二级结构[43];(4)干扰酶基因的转录过程;(5)抑制氨基酸代谢和不饱和脂肪酸与饱和脂肪酸的比例。
此外,石墨烯基材料的大小、形状、表面性质、化学性质,浓度、聚集、剂量和制备也是可能导致毒性的生物学活性的决定因素。比如,较大尺寸的GO比小尺寸的GO毒性更大[44];GO纳米带(GONRS; 310 nm×5 000 nm)比GO纳米片(GONPS; 100 nm×100 nm)的毒性更强[45]。
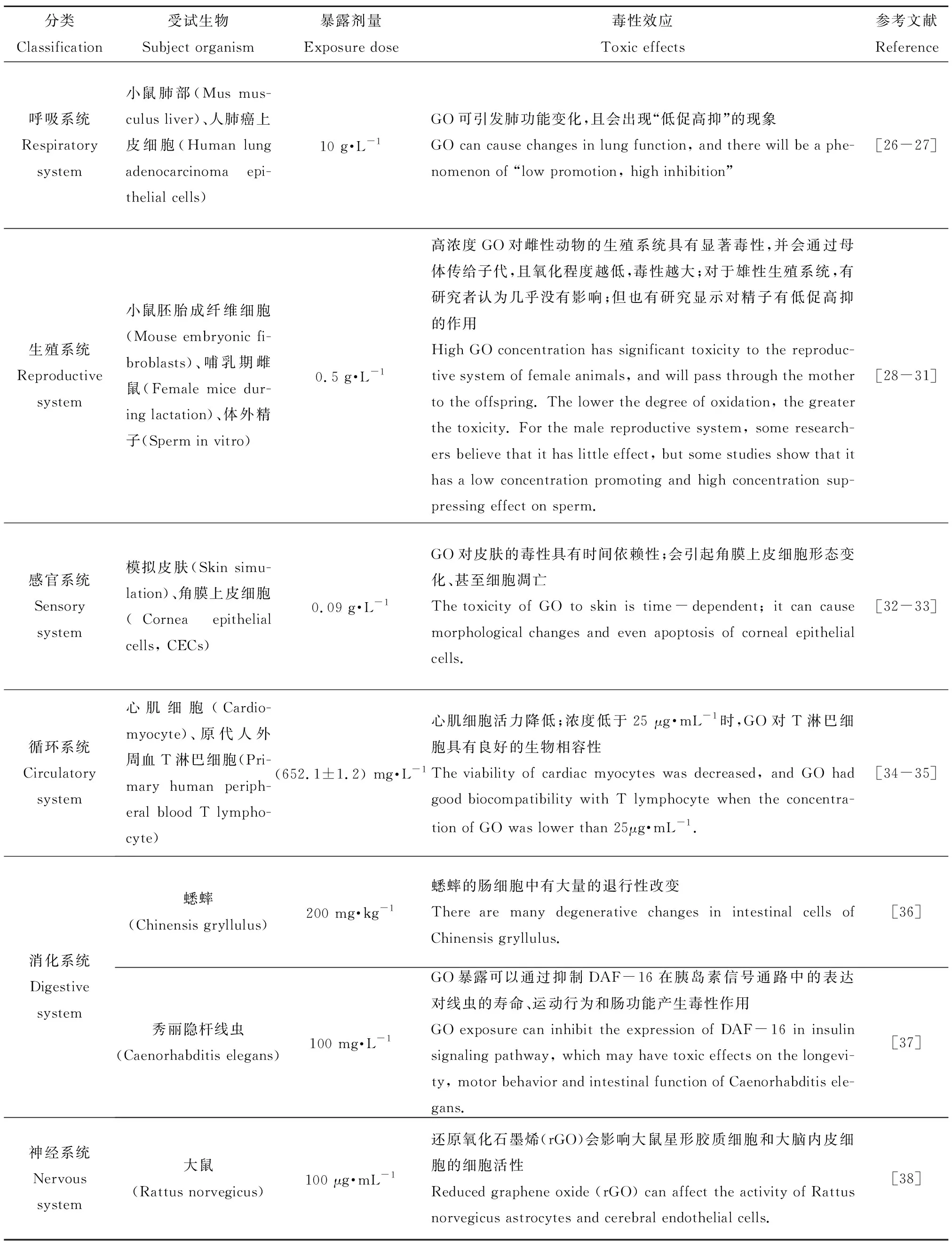
表3 GO对陆生动物的毒性Table 3 Toxicity of GO to terrestrial animals
低浓度GO对细胞活性的促进作用机制尚不明确,可能与GO材料本身具有丰富的含氧官能团,水溶性好,吸附性强有关,还需在以后的研究中进一步证明。
3 GO的水生生物毒性研究(Aquatic biological toxicity of GO)
3.1 GO的水生植物毒性效应研究
3.1.1 GO对水生植物的毒性
GO的大量使用与生产,导致其在制造、运输、使用和处置过程中被释放到土壤中影响陆生生物的同时,也不可避免地释放到水中,对水生生物造成重大不利影响,甚至影响到水生生态系统,将近期典型研究成果总结于表4中。
3.1.2 GO对水生植物的毒性机制
GO对水生植物的毒性机制如下。(1)氧化应激,在这一点上与陆生植物是相似的。(2)GO不会改变水生植物的鲜重,但会严重抑制干物质的增加,导致更高的持水率,还会抑制叶绿素的含量,上调叶绿素a/b的比值,从而影响光合作用。(3)GO还会对水生植物的微观结构和超微结构造成干扰,诱导细胞壁和细胞膜的分离以及叶片表面微孔的形成[49]。(4)GO能够显著下调光系统Ⅱ的活性;作为半透明涂层附着于藻细胞表面,造成细胞壁和膜完整性的损伤,从而抑制了藻类的生长和光合作用[50]。(5)GO大量富集在水生植物根部,逐渐积累形成一层覆盖物,阻碍根对营养物质的吸收利用[48],不过这一机制尚需深入研究。(6)GO可以吸附藻类中的大量营养素(N、P、Mg和Ca),从而导致营养物质耗竭[51]。另外,和陆生植物相似,GO对水生植物也会出现“低促高抑”现象,可能是由于低浓度的GO暴露能显著增加藻细胞蛋白质和总脂含量;还能刺激藻细胞内碳水化合物的合成;促进光合色素产生,使光合作用增强[46]。
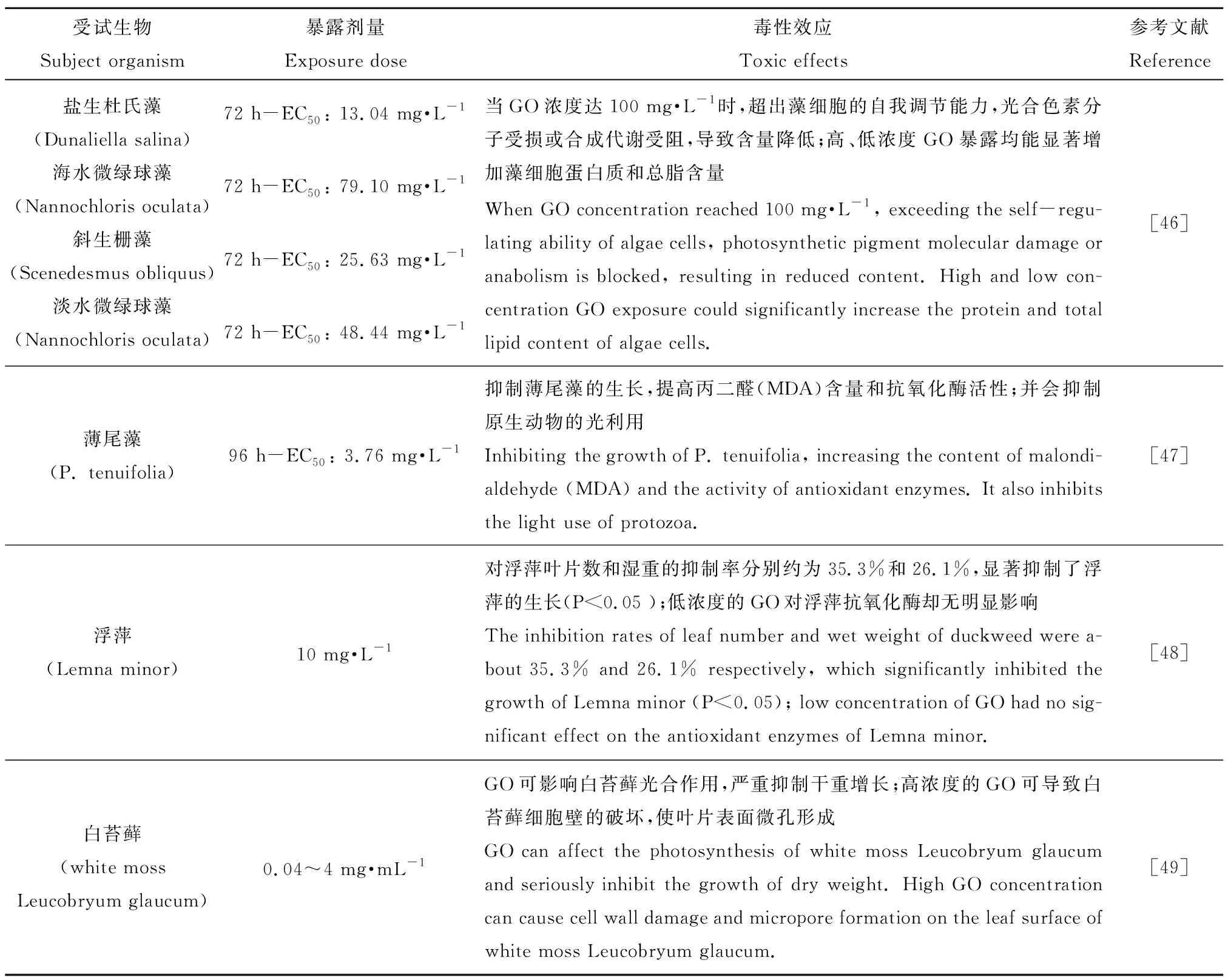
表4 GO对水生植物的毒性Table 4 Toxicity of GO to aquatic plants
注:EC50表示半数效应浓度。
Note: EC50is concentration for 50% of maximal effect.
3.2 GO的水生动物毒性效应研究
3.2.1 GO对水生动物的毒性
为了更全面了解GO对水体生态系统的潜在危害,近几年也有研究者报道了GO对水生动物的毒性,结果总结于表5中。
3.2.2 GO对水生动物的毒性机制
GO对水生动物的毒性机制与其对陆生动物的毒性机制是大体相同的,GO纳米片引起质膜的内陷和穿孔,并在血细胞的胞质溶胶和内溶酶体囊泡中发现GO,从而造成膜损伤,其毒性是活性氧族(ROS)介导的氧化损伤[59]。但由于二者在身体构造上的细微差异与所处环境的不同,导致GO对水生动物的毒性机制还可能是消化道堵塞,也可能是水生动物吸收GO以后产生的分泌物(GOBS)造成的影响[60],有研究显示,因为分泌物独特的纳米板形貌,厚度约为10 nm,横向长度为19.5~282 nm,尺寸比GO纳米流体(GONS)小,表现出比GONS更多的负表面电荷和更低的聚集状态,使斑马鱼β-半乳糖苷酶上调和斑马鱼胚胎线粒体膜电位损失,导致斑马鱼畸形甚至死亡。

表5 GO对水生动物的毒性Table 5 Toxicity of GO to aquatic animals
4 总结与展望(Summary and prospect)
综上所述,GO能够有效抑制细菌、真菌和病毒,并且GO的抑菌性和潜在毒性均与石墨烯基材料的大小、形状、聚集、剂量、浓度、制备、表面性质和化学性质等密切相关,且释放到空气中的GO大多数情况下并不是单一发挥毒性作用,而是与环境中的金属、金属离子等物质相互结合,从而产生更大的毒性,对环境的影响与人类的潜在危害是不容忽视的,但已有研究的一些结论是相互矛盾的,仍需要进一步的研究。且如何在极大地发挥GO应用潜力的同时,又能够减少其对人体健康的毒害,成为摆在研究者面前的首要问题。有研究者将GO功能化,将一些基团(羧基、聚乙二醇(PEG)、氨基化聚乙二醇(PEG-NH2)和丝素等)交联到GO上,产生的功能化GO毒性减小,具有良好的生物相容性[61-63]。因此,将GO功能化有望成为大剂量并安全使用GO的一种新方法。虽然大多数研究表明,不论是对动物还是对植物,GO的主要毒理性机制都是氧化应激,但是还有一些其他的毒性机制有待深入的研究和进一步的确定。本综述将为后续GO的毒理性机制研究提供参考,进而找到相应的控制和解决办法,为GO的临床应用提供安全性评价资料,并在此基础上建立全面的、切实可行的GO使用安全评价标准。

