浮游动物物种构成对于淡水测试系统抗农药胁迫能力的影响
徐吉洋,张文萍,李少南
浙江大学农药与环境毒理研究所,杭州 310058
农药产品的生态风险主要取决于2个方面:一是农药产品在环境介质中沉积量和沉积范围,二是其对非靶生物的危害。出于经济和时效方面的考虑,农药危害鉴定试验目前大多分步骤、分层次进行。如果初评能够排除农药产品的生态风险,试验过程即可终止;反之则需要开展高层次试验[1-3]。方法之一是扩大物种测量范围,构建物种敏感度分布(SSD)曲线[4-5]。SSD曲线的使用无疑会降低风险评估中“假阴性”结论的出现概率。然而SSD曲线赖以建立的基础是依据个体试验。众所周知,以个体试验的结果来评判农药在种群或群落层次的危害,其结论往往并不可靠。正如按照经济合作与发展组织(Organisation for Economic Co-operation and Development, OECD)制定的OECD 202[6]开展溞类急性毒性试验而得到的48-h EC50难以被用来判断农药在种群层次的危害,更谈不上对相关的群落演替的影响。OECD 202中的48 h试验[6]如此,OECD 211中的21 d试验[7]同样如此,可见对于初评呈“阳性”的农药产品,开展种群或群落试验十分必要。
在种群或群落层次开展农药危害性测试,需要建立相应的系统。这就涉及物种的选择。笔者尝试构建包含隆线溞(Daphnia carinata)、锯缘真剑水蚤(Eucyclops serrulatus)和中华薄壳介(Dolerocypris sinensis) 3种甲壳动物当中的1种或全部,以及包含小球藻(Chlorella vulgaris)、萼花臂尾轮虫(Brachionus calyciflorus)和轮叶黑藻(Hydrilla verticillata)的4组测试系统。溞、剑水蚤、介形虫和轮虫之所以被选用,主要是因为它们时常出现在同一水域[8-10],藻可以作为食物被上述浮游动物当中的部分或全部物种所取食[11-13],水草可以抑制藻在测试系统内过度生长[14]。本研究选择有机磷杀虫剂毒死蜱作为受试农药。毒死蜱应用范围广,其对淡水测试系统的影响已有不少研究[15-21],是考察农药直接和间接效应的理想化学品。本研究的主要目的包括:(1)了解物种构成对于淡水测试系统群落结构稳定性的影响;(2)了解物种构成不同的测试系统在抗农药胁迫能力上的差别。
壳二糖酶(chitobiase)编号EC 3.2.1.52,又被称为ß-N-乙酰己糖胺糖苷酶(ß-N-acetylhexosaminidase),或被称为N-乙酰氨基葡萄糖胺糖苷酶(N-acetylglucosaminidase),是有能力水解ß-1,4-糖苷键(ß-1,4-glycosidic bonds)的酶类。节肢动物在生长过程中需要经历多次脱皮,脱皮过程需要壳二糖酶的参与[22]。水生节肢动物在每次脱皮之后会将其富含壳二糖酶的脱皮液释放到水中,动物个体越大数量越多,单位时间内释放到水中的壳二糖酶的量就越多[23-25]。Duchet等[26]和Qi等[27]分别研究了多杀菌素、除虫脲和吡虫胍对溞类种群壳二糖酶释放量的影响,结果显示,随着农药对种群的压制,介质中壳二糖酶的比活性也有所下降。笔者将游离态壳二糖酶作为一项测量指标,希望探明其作为农药种群胁迫指示因子的功效。
1 材料与方法(Materials and methods)
1.1 受试农药
毒死蜱(chlorpyrifos),化学名称为O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,由浙江新农化工有限公司提供,纯度97%。
1.2 受试物种
本文所涉及的隆线溞(Daphnia carinata)属于溞科(以下简称溞water fleas)、锯缘真剑水蚤(Eucyclops serrulatus)属于剑水蚤科(以下简称剑水蚤cyclops)、中华薄壳介(Dolerocypris sinensis)属于金星介科(以下简称介形虫seed shrimps)、萼花臂尾轮虫(Brachionus calyciflorus)(以下简称轮虫rotifers)以及(罗氏)轮叶黑藻(Hydrilla verticillata)均采自浙江大学华家池校区人工池塘。溞和轮虫用小球藻饲养,剑水蚤和介形虫用轮虫饲养。小球藻(Chlorella vulgaris)购自中国科学院淡水藻种库并按其提供的配方营养液进行饲养。
1.3 测试系统构成和组建
采用能够容纳2 L稀释液的玻璃烧杯。施药前26 d将轮叶黑藻植入试验容器。水草取茎尖以下约7 cm,先植入25 mL小烧杯。小烧杯底部铺上1 cm厚的泥炭。上面覆盖3 cm厚的石英砂(30目)。每1只小烧杯植入1株水草。每只试验容器内放3只植入水草的小烧杯。以OECD M4营养液作为稀释水。配方参见OECD211中附件2[7]。其中,除了CaCl2、MgSO4、KCl和NaHCO3,微量元素的浓度是原配方的3倍。植入水草的同时(施药前26 d)将稀释水引入试验容器。通过预实验得知系统中氮、磷浓度随着时间的延续呈下降趋势,因此自施药前23 d开始,每隔3 d向每只试验容器内补充浓度为1 200 mg·L-1的KH2PO4和浓度为7 000 mg·L-1的KNO3各0.5 mL。共构建4组测试系统。前3组系统当中只包含1种节肢动物。第4组同时包含溞、剑水蚤和介形虫。
给药前18 d接种小球藻(接种密度约105cells·mL-1)。给药前7 d接种浮游动物。轮虫接种密度为0.35 只·mL-1(相当于每只试验容器接种约700只)。给药前4 d接种节肢动物。溞、介形虫和剑水蚤每只试验容器各接种25只。分别从施药前6 d和3 d开始向第4组测试系统内补充藻和轮虫,每隔3 d向每只试验容器内补充1 mL浓度为7×106cells·mL-1的藻液,每隔3 d向每只试验容器内补充700只。
1.4 温度和光照
将系统置于温度24~27 ℃和光照强度3 500~2 200 lx条件下进行培养,每日光照16 h。
1.5 给药
试验共设1个对照组和5个浓度组。每组设3个重复。根据预试验的结果,对于“溞”系统,毒死蜱添加浓度分别为0、0.02、0.1、0.5、2.5和12.5 μg·L-1,对于其他3组测试系统,毒死蜱添加浓度分别为0、0.05、0.25、1.25、6.25和31.25 μg·L-1。由于受试农药水溶解度有限,先用丙酮将其溶解配成初级母液,再用丙酮将初级母液稀释成系列浓度的次级母液。用微量注射器量取初级或次级母液50 μL加入各试验容器。
1.6 采样
使用美国材料与试验协会(American Society for Testing and Materials, ASTM)制定的ASTM E 1366-02中推荐的柱状取水器采集水样[28]。每只试验容器每次采样100 mL。采样规程如表1所示。试验容器内因采样和挥发而损失的稀释液用无离子水加以补充。
用270目滤网滤除浮游动物,剩下的水样过0.22 μm醋酸纤维素滤膜(天津博纳艾杰尔科技有限公司),供水质指标和壳二糖酶活性测量之用。
1.7 样品测量
1.7.1 浮游动物
隆线溞以及体型较大的介形虫和剑水蚤肉眼可见,轮虫以及体型较小介形虫和剑水蚤肉眼难以分辨。鉴于此,借助体视显微镜(日本Nikon,SMZ1500)和浮游动物计数框(德国HYDRO-BIOS,435 010)对于水样内浮游动物进行计数。为减少对测试系统的干扰,计数后的浮游动物及水样尽量返还。

表1 采样规程Table 1 Sampling schedule
注:1)以施药当天作为0 d。
Note:1)To take date of pesticide application as 0 d.
1.7.2 水质指标
被测量的水质指标包括pH、电导率、总氮、总磷、铵态氮(NH4-N)和浊度。pH测量采用GB 6920—1986的方法[29];电导率测量采用DZ/T 0064.6—93的方法[30];总磷测量采用GB/T 11893—1989的方法[31];总氮测量采用GB/T 11894—1989的方法[32];NH4-N测量采用GB/T 7479—1987的方法[33];浊度测量采用GB 13200—91的方法[34]。
1.7.3 壳二糖酶
以4-甲基伞形酮N-乙酰基-β-D-氨基葡萄糖苷(4-methylumbelliferyl N-acetyl-ß-D-glucosaminide, MUF-NAG)作为底物,采用荧光分光光度法进行测量[35]。具体方法如下:向96孔聚苯乙烯板中加入150 μL经过0.22 μm醋酸纤维素滤膜过滤后的水样(作为酶源),加入50 μL含0.31 mmol·L-1MUF-NAG的0.15 mol·L-1柠檬酸磷酸盐缓冲液(pH=5.5),在25 ℃下温育1 h,用50 μL 0.25 mol·L-1NaOH终止反应。作为空白,向水样中同时加入底物和NaOH,其余步骤同前。采用荧光酶标仪(美国MD,GEMINI xps)在激发波长360 nm和发射波长450 nm下测量酶的产物发出的荧光。用水解产物4-甲基伞形酮(4-methylumbelliferone, MUF)建立标准方程。将测量结果带入方程求出单位体积水样在单位时间内生成MUF的量。
1.7.4 水草
试验结束时将轮叶黑藻取出,测量其主根和主茎长度,对于侧根和侧茎进行计数,最后称量湿重并加以记录。
1.8 数据处理
单变量分析(包括回归分析和差异显著性分析)采用DPS©[36];多变量分析采用排序软件CANOCO 5的主成份分析(principal component analysis, PCA)模块[37]。
2 结果与分析(Results and analysis)
2.1 浮游动物
浮游动物在“溞”、“介形虫”和“剑水蚤”系统中的变化趋势如图1、图2和图3所示。图4显示上述浮游动物在“多节肢动物”系统中的变化趋势。从图1、图2和图3中可以看出,浮游动物在3组测试系统中的变化趋势各有不同:溞先升后降,介形虫持续上升,剑水蚤先升后降然后再上升。从图4中可以看出,节肢动物在该系统中先上升然后保持相对平稳。轮虫在该系统中的变化趋势也是先升后降,但是下降速度较图1、图2和图3缓慢。
以浮游动物的群密度作为应变量,以受试农药添加浓度作为解释变量,对数据组做PCA,结果如图5所示。从解释变量和应变量箭头在图5中的走向上看,毒死蜱对各系统中溞、介形虫和剑水蚤的影响均为负,对轮虫的影响则并不一致。以单个物种为目标做PCA,结果显示,毒死蜱在“溞”、“介形虫”和“剑水蚤”系统中对轮虫的影响均为负(影响率分别为<0.1%、0.5%和0.2%);在“多节肢动物”系统中,毒死蜱对轮虫的影响为正(影响率为35.1%)。
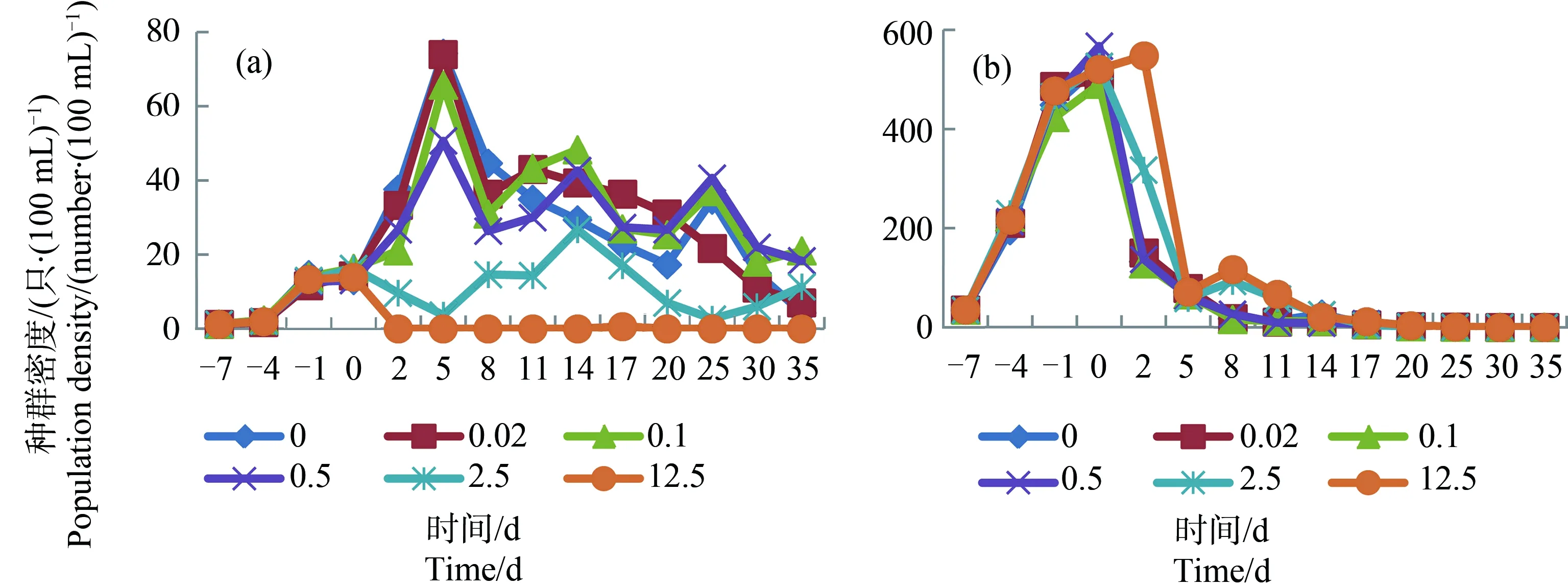
图1 “溞”系统内的隆线溞(a)和萼花臂尾轮虫(b)在毒死蜱暴露下(0~12.5 μg·L-1)的种群动态注:图中每1个点代表3个测定结果的平均值。Fig. 1 State of D. carinata (a) and B. calyciflorus (b) in “water flea” systems being exposed to chlorpyrifos (0~12.5 μg·L-1)Note: Each spot in the figures represented average of three measurements.
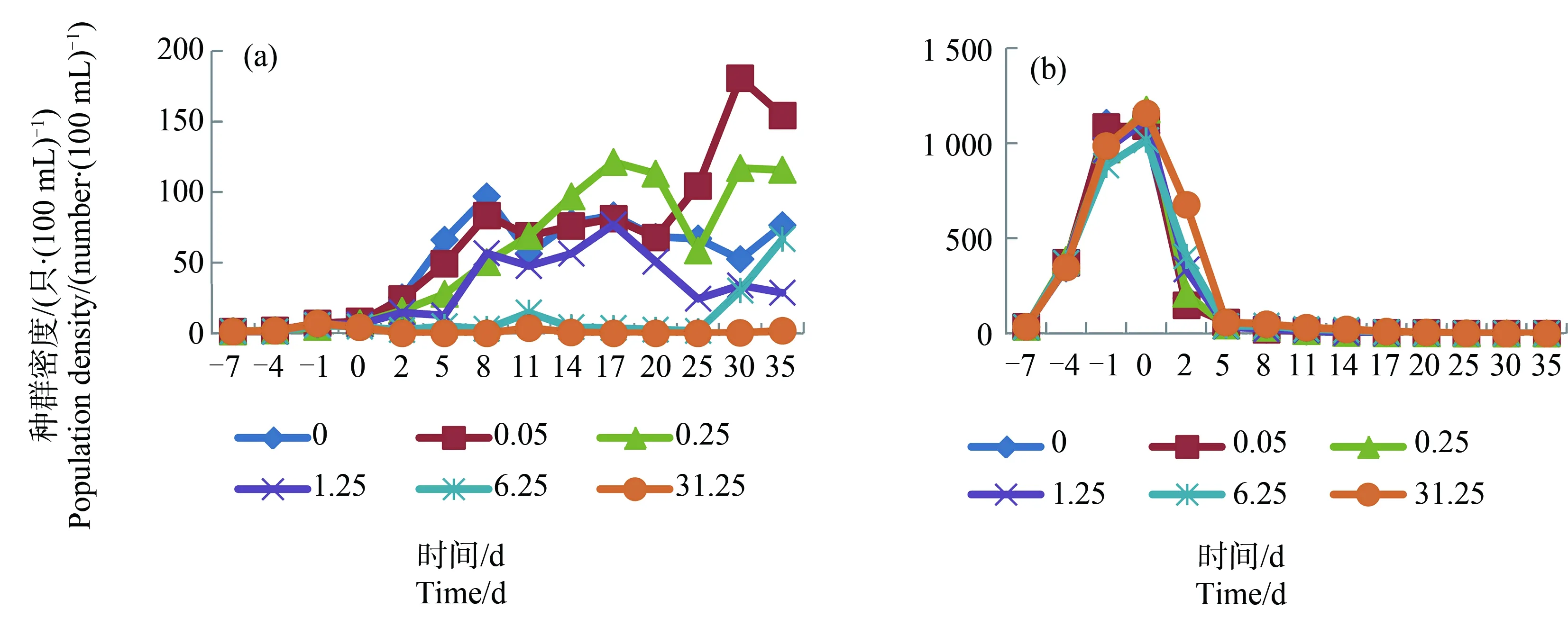
图2 “介形虫”系统内的中华薄壳介(a)和萼花臂尾轮虫(b)在毒死蜱暴露下(0~31.25 μg·L-1)的种群动态注:图中每1个点代表3个测定结果的平均值。Fig. 2 State of D. sinensis (a) and B. calyciflorus (b) in “seed shrimp” systems being exposed to chlorpyrifos (0~31.25 μg·L-1)Note: Each spot in the figures represented average of three measurements.
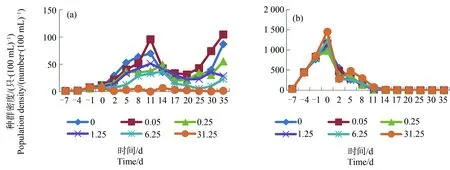
图3 “剑水蚤”系统内的锯缘真剑水蚤(a)和萼花臂尾轮虫(b)在毒死蜱暴露下(0~31.25 μg·L-1)的种群动态注:图中每1个点代表3个测定结果的平均值。Fig. 3 State of E. serrulatus (a) and B. calyciflorus (b) in “cyclop” systems being exposed to chlorpyrifos (0~31.25 μg·L-1)Note: Each spot in the figures represented average of three measurements.
2.2 水质指标
pH、电导率、总氮、总磷、NH4-N和浊度等6项水质指标在“溞”、“介形虫”、“剑水蚤”和“多节肢动物”系统中的变化趋势分别如图6、图7、图8和图9所示。在4组测试系统中,总氮、总磷和浊度总体呈下降趋势(总磷在有些系统的中间过程中有波动),电导率总体呈上升趋势,pH变化不大(在“多节肢动物”系统中,该指标有上升趋势),NH4-N前升后降(在“多节肢动物”系统中的下降不充分)。
为鉴定农药对上述6项指标的影响,以单项指标测量结果作为应变量,以受试农药添加浓度作为解释变量,对数据组做PCA,结果如表2所示。就影响性质而言,毒死蜱在各系统之间具有相似性;就指标而言,毒死蜱促进了系统内pH、NH4-N和电导率水平的上升以及总氮、总磷和浊度水平的下降。这在“多节肢动物”系统中尤为明显。
2.3 水草
试验结束时对“溞”、“介形虫”和“剑水蚤”系统内各株轮叶黑藻的生长指标进行了测量。以测量结果作为应变量,以受试农药添加浓度作为解释变量,对数据组做PCA,结果如图10所示。从图10中可以看出,除了湿重,农药对大部分生长指标(主根、主茎、侧根和侧茎)有负面影响,农药对湿重的影响在系统之间有所差异。

图4 “多节肢动物”系统内的浮游动物在毒死蜱暴露下(0~31.25 μg·L-1)的种群动态注:图中每1个点代表3个测定结果的平均值。Fig. 4 State of zooplanktons in “multi-arthropod” systems being exposed to chlorpyrifos (0~31.25 μg·L-1)Note: Each spot in the figures represented average of three measurements.

表2 针对水质指标测量结果的非限制性排序Table 2 Unconstrained ordination for result of measurements for selected water-quality indexes
注:1)“+”表示解释变量对应变量有正面影响,“-”表示解释变量对应变量有负面影响;2)“Ⅰ”表示溞+轮虫测试系统,“Ⅱ”表示介形虫+轮虫测试系统,“Ⅲ”表示剑水蚤+轮虫测试系统,“Ⅳ”表示多节肢动物+轮虫测试系统。
Note:1)“+” means a positive impact of supplementary variable(s) on response variable; “-” means a negative impact of supplementary variable(s) on response variable;2)“Ⅰ” means water flea+rotifer test system; “Ⅱ” means seed shrimp+rotifer test system; “Ⅲ” means cyclop+rotifer test system; “Ⅳ” means multi-arthropod+rotifer test system.
2.4 壳二糖酶
壳二糖酶在4组测试系统中的比活性变化趋势如图11所示。可以看出,壳二糖酶的比活性在“溞”系统中先升后降,在“介形虫”系统中持续上升,在“剑水蚤”系统中先升后降然后再上升,在“多节肢动物”系统中先上升然后保持相对平稳。这与节肢动物在图1~图4中的变化有相似之处。以浮游动物在水体中的丰度作为应变量,以游离态壳二糖酶比活性作为解释变量,对数据组做PCA,结果如图12所示。可以看出,壳二糖酶与节肢动物之间的协同关系比较明显,与轮虫之间的协同关系不明显。

图5 毒死蜱对浮游动物的影响注:X和Y轴上所标的数值代表坐标轴的相对长度;X和Y轴上所标的数值绝对值越大,变量的变化率越大;括号中的百分数表示解释变量引起的变化在应变量总变化中所占的比例。Fig. 5 The effects of chlorpyrifos on zooplanktonsNote: Values marked on the X- and Y-axis indicated relative length of the axes; the larger the absolute value marked on the axes, the larger the change rate of the variables; the percentage in blankets represent portions of variation resulted from explanatory variable to the total variation of response variables.

图6 “溞”系统内部分水质指标在毒死蜱暴露下(0~12.5 μg·L-1)的变化注:图中的每1个点代表3个测定结果的平均值。Fig. 6 Change in some water quality indexes in “water flea” systems being exposed to chlorpyrifos (0~12.5 μg·L-1)Note: Each spot in the figures represented average of three measurements.
3 讨论(Discussions)
3.1 农药对生物指标的影响
3.1.1 浮游动物
PCA结果显示,本研究中建立的“多节肢动物”系统能够揭示毒死蜱对于轮虫的诱导。这种诱导在野外发生的频率很高[15-17]。根据现有资料,溞和轮虫之间存在食物竞争关系[38-39],剑水蚤和轮虫之间存在捕食与被捕食关系[40-41],同样的关系也存在于介形虫和轮虫之间[42]。可以设想在作为食物竞争者的溞和作为捕食者的介形虫和剑水蚤受到毒死蜱压制的情形下,轮虫得到一定程度的恢复。在“溞”、“介形虫”和“剑水蚤”系统中,轮虫因受到溞、介形虫和剑水蚤的高强度压制而过快下降,其恢复潜力得不到正常发挥。这提示,维持测试系统群落结构的相对稳定对于农药效应,特别是间接效应的测量十分重要。本研究的结果显示,在维持稳定方面“多介质动物”系统优于“溞”、“介形虫”和“剑水蚤”系统。
对于图5对应的各组系统,提取后台数据CaseR.1(即应变量在第1轴上的分值),对它们在各处理组之间的差异做多重比较,结果如表3所示。
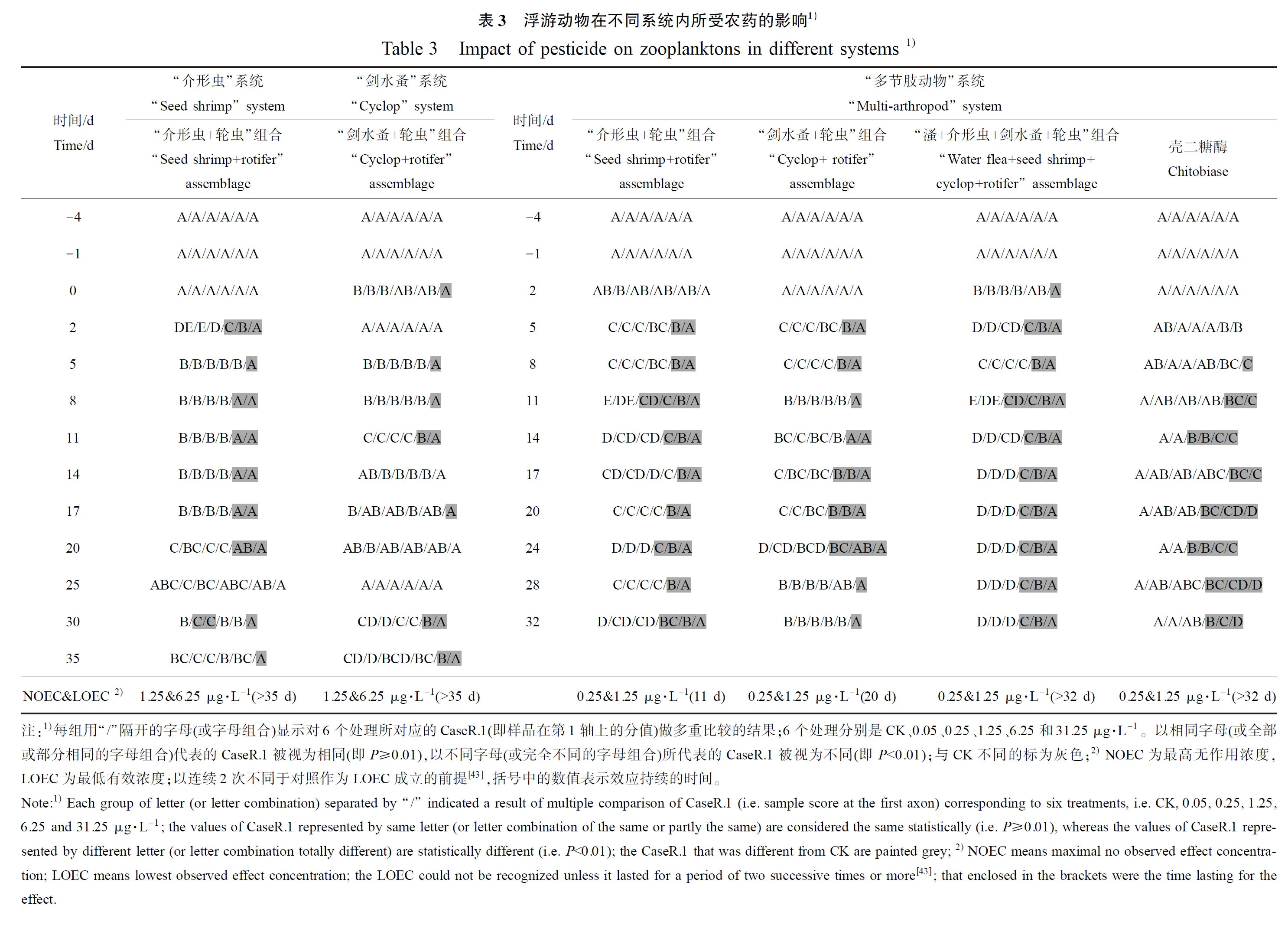
注:1)每组用“/”隔开的字母(或字母组合)显示对6个处理所对应的CaseR.1(即样品在第1轴上的分值)做多重比较的结果;6个处理分别是CK、0.05、0.25、1.25、6.25和31.25 μg·L-1。以相同字母(或全部或部分相同的字母组合)代表的CaseR.1被视为相同(即P≥0.01),以不同字母(或完全不同的字母组合)所代表的CaseR.1被视为不同(即P<0.01);与CK不同的标为灰色;2)NOEC为最高无作用浓度,LOEC为最低有效浓度;以连续2次不同于对照作为LOEC成立的前提[43],括号中的数值表示效应持续的时间。
Note:1)Each group of letter (or letter combination) separated by “/” indicated a result of multiple comparison of CaseR.1 (i.e. sample score at the first axon) corresponding to six treatments, i.e. CK, 0.05, 0.25, 1.25, 6.25 and 31.25 μg·L-1; the values of CaseR.1 represented by same letter (or letter combination of the same or partly the same) are considered the same statistically (i.e. P≥0.01), whereas the values of CaseR.1 represented by different letter (or letter combination totally different) are statistically different (i.e. P<0.01); the CaseR.1 that was different from CK are painted grey;2)NOEC means maximal no observed effect concentration; LOEC means lowest observed effect concentration; the LOEC could not be recognized unless it lasted for a period of two successive times or more[43]; that enclosed in the brackets were the time lasting for the effect.

图7 “介形虫”系统内部分水质指标在毒死蜱暴露下(0~31.25 μg·L-1)的变化注:图中的每1个点代表3个测定结果的平均值。Fig. 7 Change in some water quality indexes in“seed shrimp” systems being exposed to chlorpyrifos (0~31.25 μg·L-1)Note: Each spot in the figures represented average of three measurements.
从表3中可以看出,在“介形虫”和“剑水蚤”系统中,对于“介形虫+轮虫”和“剑水蚤+轮虫”组合,在给药之后(2~35 d)采集60个样品,其中分别有14个和9个不同于对照;在“多节肢动物”系统中,对于相应的组合,在给药之后(2~32 d)采集60个样品,其中分别有23个和18个不同于对照。可见在感受毒死蜱胁迫方面,“多节肢动物”系统比“介形虫”和“剑水蚤”系统更灵敏。此处未对“多节肢动物”和“溞”系统中的“溞+轮虫”组合进行比较,原因是溞和轮虫在2个系统中的受胁迫水平不同(它们分别是0、0.02、0.1、0.5、2.5、12.5 μg·L-1和0、0.05、0.25、1.25、6.25、31.25 μg·L-1)。
作为一种应用广泛的杀虫剂,有关毒死蜱对淡水生态系统及浮游动物影响的研究较多。Daam等[16]在室外测得毒死蜱对浮游动物群落(包含3种溞、7种轮虫、剑水蚤(未分类)、哲水蚤(未分类)、介形虫(未分类)、桡足类无节幼虫和原生动物(砂壳虫))的LOEC为100 μg·L-1;López-Mancisidor等[17]在室外测得毒死蜱对枝角类(8种)、桡足类(3种)、轮虫(24种)的LOEC分别为1 μg·L-1;可见两者之间存在差异。在室内,Daam和van den Brink[44]测得毒死蜱对浮游动物群落(包含6种溞、11种轮虫、介形虫(未分类)、剑水蚤(未分类)和昆虫(蜉蝣))的LOEC为0.05 μg·L-1;van Wijngaarden等[45]测得毒死蜱对包含2种溞、3种轮虫以及哲水蚤、剑水蚤、桡足类无节幼虫、纤毛虫、太阳虫的“地中海”群落,对包含4种溞、11种轮虫以及哲水蚤、剑水蚤的“温带”群落,以及对包含7种溞、5种轮虫以及哲水蚤、剑水蚤、桡足类无节幼虫的另一“地中海”群落的LOEC均为1 μg·L-1。表3显示毒死蜱对浮游动物群落(包含溞、介形虫、剑水蚤和轮虫)的LOEC为1.25 μg·L-1,可见本研究所构建的“多节肢动物”系统抗农药胁迫能力适中。

图8 “剑水蚤”系统内部分水质指标在毒死蜱暴露下(0~31.25 μg·L-1)的变化注:图中的每1个点代表3个测定结果的平均值。Fig. 8 Change in some water quality indexes in “cyclop” systems being exposed to chlorpyrifos (0~31.25 μg·L-1)Note: Each spot in the figures represented average of three measurements.
3.1.2 水草
本研究的4组测试系统中均接种了轮叶黑藻。一是防止单细胞藻类在试验过程中可能出现的过度生长[14],二是为介形虫之类的浮游动物提供适宜生长的环境[46]。有关杀虫剂对水草影响的研究目前鲜有报道。在陆生植物方面,人们发现如毒死蜱这样的杀虫剂能够影响绿豆(Vigna radiata)植株的氮代谢[47]并有可能引起植株的氧化损伤[48]。Bertrand等[49]以属于沼生目(Helobiae)、眼子菜科(Potamogetonaceae)的小眼子菜(Potamogeton pusillus)作为受试植物,测量毒死蜱对植株抗氧化指标的影响,发现农药在极低浓度(3.5~94.5 ng·L-1)之下即可引起植株抗氧化反应。在本研究中,笔者仅测量了水草在试验结束时的生长情况,并未测量水草在试验过程中的变化,因此无法确定毒死蜱对水草的影响阈值。鉴于水草在维持系统稳定方面的重要性,其抗农药胁迫能力理应得到人们的关注,这方面还需要更加细致的研究。
3.2 农药对水质指标的影响
作为一种应用广泛的杀虫剂,已有不少研究考察了毒死蜱对淡水生态系统的影响,包括对于水质指标的影响。然而正如表4所示,这些研究的结果似乎并不一致。PCA结果显示,毒死蜱对于测试系统内pH和NH4-N水平的上升以及总氮和总磷水平的下降有促进作用(表2)。其中,NH4-N的上升可能与浮游动物在农药胁迫下对NH4-N释放量增加有关[50-51]。pH升高的现象在以往研究中也有报道,这预示系统内的光合作用得到毒死蜱的促进[18,44-45]。二嗪农[18]这样的杀虫剂有类似功效,莠去津[43]和利谷隆[52]这样的除草剂则相反。考虑到水质变化的生态学意义,有关农药对水质的影响,今后还应深入研究。
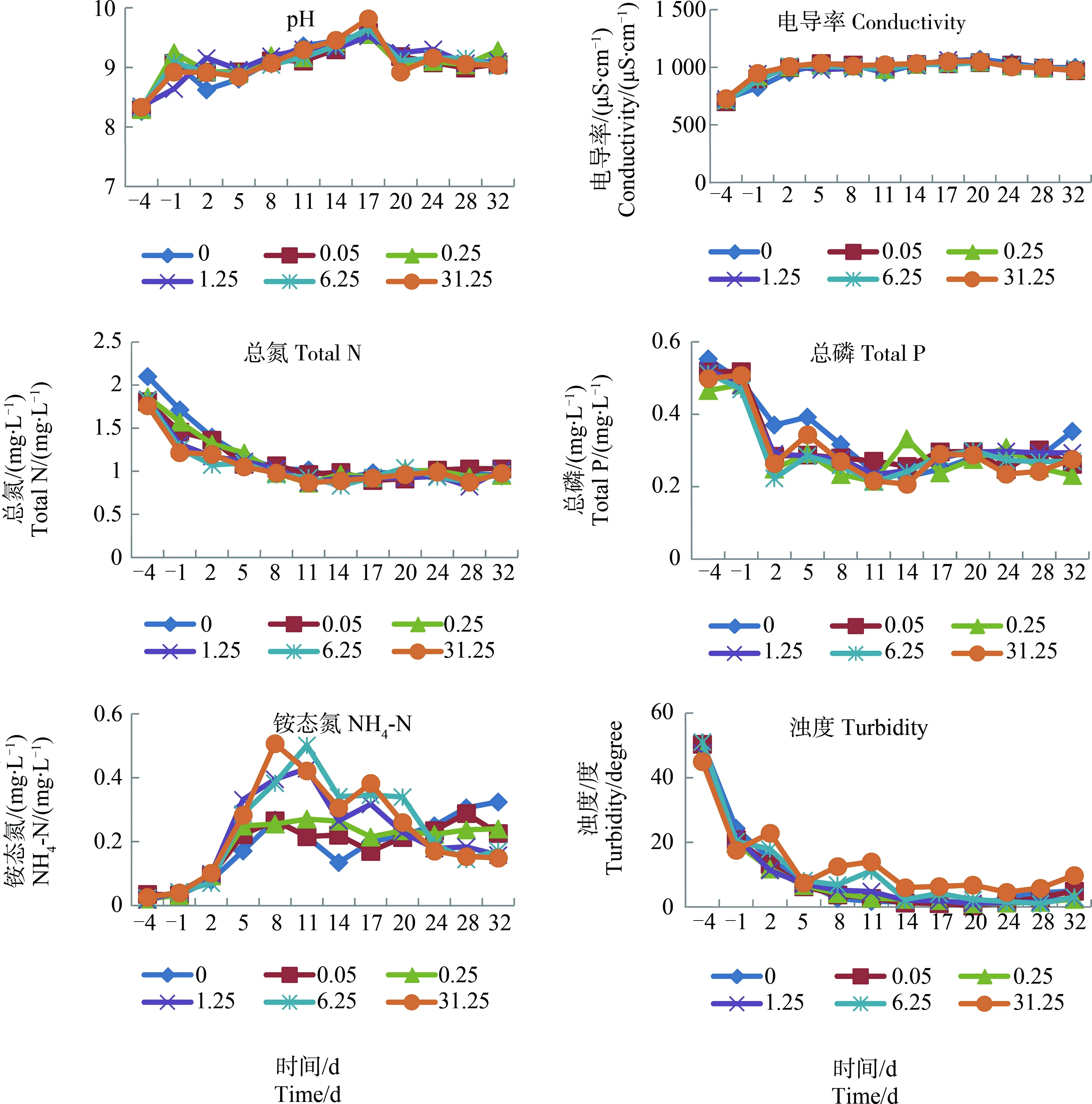
图9 “多节肢动物”系统内部分水质指标在毒死蜱暴露下(0~31.25 μg·L-1)的变化注:图中的每1个点代表3个测定结果的平均值。Fig. 9 Change in some water quality indexes in“multi-arthropod” systems being exposed to chlorpyrifos (0~31.25 μg·L-1)Note: Each spot in the figures represented average of three measurements.

表4 有关毒死蜱影响测试系统水质的文献研究结果1)Table 4 Reports from previous researchers concerning impacts of chlorpyrifos on quality of water in test systems 1)
注:1)“+”表示正面影响;“-”表示负面影响;“0”表示无影响;“/”表示未测量。
Note:1)“+” means a positive impact; “-” means a negative impact; “0” means no impact; “/” means not measured.
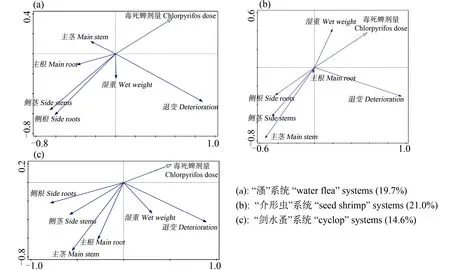
图10 毒死蜱对轮叶黑藻的影响注:X和Y轴上所标的数值代表坐标轴的相对长度;X和Y轴上所标的数值绝对值越大,变量的变化率越大;括号中的百分数表示解释变量引起的变化在应变量总变化中所占的比例。Fig. 10 The effects of chlorpyrifos on Hydrilla verticillataNote: Values marked on the X- and Y-axis indicated relative length of the axes; the larger the absolute value marked on the axes, the larger the change rate of the variables; the percentage in blankets represent portions of variation resulted from explanatory variable to the total variation of response variables.

图11 测试系统中游离态壳二糖酶在毒死蜱暴露下的比活性变化注:图中的每1个点代表3个测定结果的平均值;(a)为“溞”系统,给药浓度0~12.5 μg·L-1;(b)为“介形虫”系统,给药浓度0~31.25 μg·L-1;(c)为“剑水蚤”系统,给药浓度0~31.25 μg·L-1;(d)为“多节肢动物”系统,给药浓度0~31.25 μg·L-1。Fig. 11 Change in specific activity of free-living chitobiase in systems being exposed to chlorpyrifosNote: Each spot in the figures represented average of three measurements; (a) represents “water flea” systems, with administrative concentrations of 0~12.5 μg·L-1; (b) represents “seed shrimp” systems, with administrative concentrations of 0~31.25 μg·L-1; (c) represents “cyclop” systems, with administrative concentrations of 0~31.25 μg·L-1; (d) represents “multi-arthropod” systems, with administrative concentrations of 0~31.25 μg·L-1.
3.3 壳二糖酶
表2右起第1列显示“多节肢动物”系统内各处理组壳二糖酶比活性差异多重比较结果。从中可以看出,毒死蜱对酶指标的最高无作用浓度(NOEC)和最低有效浓度(LOEC)分别为0.25和1.25 μg·L-1,LOEC延续时间>32 d,这与计数获得的结果(表2右起第2列)比较一致,说明酶指标能够用来指示农药对浮游动物群落的影响阈值。
为量化壳二糖酶与节肢动物之间的协同关系,笔者仍以“多节肢动物”系统为例,以壳二糖酶比活性作为解释变量,以肢动物丰度作为应变量制作散点图并且建立回归方程,结果分别如图13和表5所示。从点对点的角度,自变量与应变量之间存在协同关系(图13(a))。方程A的R2=0.7563,F=330.5602,P=0.0000。从时段对时段的角度,自变量与应变量之间的协同关系明显改善(图13(b))。方程B的R2=0.9655,F=209.9833,P=0.0000。
节肢动物在生长过程中不断向水中释放酶,被释放的酶又不断被降解。如果种群处于平衡状态,酶的释放率与降解速率相等。基于这一假设,人们常以酶在移除节肢动物的水体中的降解率来衡量节肢动物的种群繁殖率[53-55]。也只有在这种状态下,酶的比活性才能够以较小偏差来指示种群丰度。相反如果节肢动物种群处于扩张(或萎缩)状态,动物的丰度会被高估(或低估)。
从图4中可以看出,以给药后第8天为界,之前动物大约处于扩张状态,之后它们趋于稳定。为此分别以壳二糖酶比活性和节肢动物丰度在-4~8 d和8~32 d的测量结果(平均值)作为解释变量和应变量制作散点图(图13(c)和13(d))并得到回归方程(表5中的方程C和D)。对比方程B和D,可以看出方程B对动物的丰度有所高估。这正是由于动物在前期的扩张引起的。可见要想提高壳二糖酶作为农药胁迫指示因子的可靠性,所构建的测试系统需要维持稳定。
从系统稳定性以及系统对杀虫剂胁迫的直接和间接反应上看,本研究所构建的“多节肢动物”系统相比只包含1种节肢动物的测试系统更能够准确衡量农药对浮游动物的生态胁迫。

图12 浮游动物丰度变化与壳二糖酶活性变化的关系注:X和Y轴上所标的数值代表坐标轴的相对长度;X和Y轴上所标的数值绝对值越大,变量的变化率越大;括号中的百分数表示解释变量引起的变化在应变量总变化中所占的比例;浮游动物(节肢动物和轮虫)在“多节肢动物”系统内的丰度以其在单位体积内的生物量(μg·(100 mL)-1)作为衡量依据,隆线溞、中华薄壳介、锯缘真剑水蚤和萼花臂尾轮虫的个体生物量分别以1.32、0.659、0.0674和0.0473 μg·只-1进行计算;它们在另外3个系统内的丰度以种群密度(只·(100 mL)-1)作为衡量依据。Fig. 12 The relationship between change in abundance of zooplanktons and change in activity of chitobiaseNote: Values marked on the X- and Y-axis indicated relative length of the axes; the larger the absolute value marked on the axes, the larger the change rate of the variables; the percentage in blankets represent portions of variation resulted from explanatory variable to the total variation of response variables; abundances of zooplankton (arthropods and rotifer) were scaled with biomass per volume (μg·(100 mL)-1) in “multi-arthropod” systems; the biomass of D. carinata, D. sinensis, E. serrulatus, and B. calyciflorus was counted as 1.32, 0.659, 0.0674, and 0.0473 μg·individual-1, respectively; those in other three systems were scaled with population density (individuals·(100 mL)-1).

表5 壳二糖酶活性与节肢动物生物量在“多节肢动物”系统中的协同关系Table 5 Correlation between activity of chitobiase and biomass of arthropods in “multi-arthropod” systems
注:1)数据来源时段;2)“x”为壳二糖酶在稀释液中的比活性(μmol·h-1·L-1),“y”为节肢动物的单位生物量(mg·(100 mL)-1);“x”和“y”在方程A中意指-4~32 d之内的任何一个时间点上的测定值,在方程B中意指-4~32 d之内12个时间点上的测定结果的平均值,在方程C中意指-4~8 d之内5个时间点上的测定结果的平均值,在方程D中意指8~32 d之内8个时间点上的测定结果的平均值。
Note:1)Time period for collection of the data;2)“x” is activity of chitobiase in dilutions (μmol·h-1·L-1); “y” is biomass of arthropods population in dilutions (mg·(100 mL)-1); either “x” or “y” is a measurement at any point of time from -4 to 32 d in Equation A, an average of measurements at 12 points of time from -4 to 32 d in Equation B, an average of measurements at 5 points of time from -4 to 8 d in Equation C, and an average of measurements at 8 points of time from 8 to 32 d in Equation D.
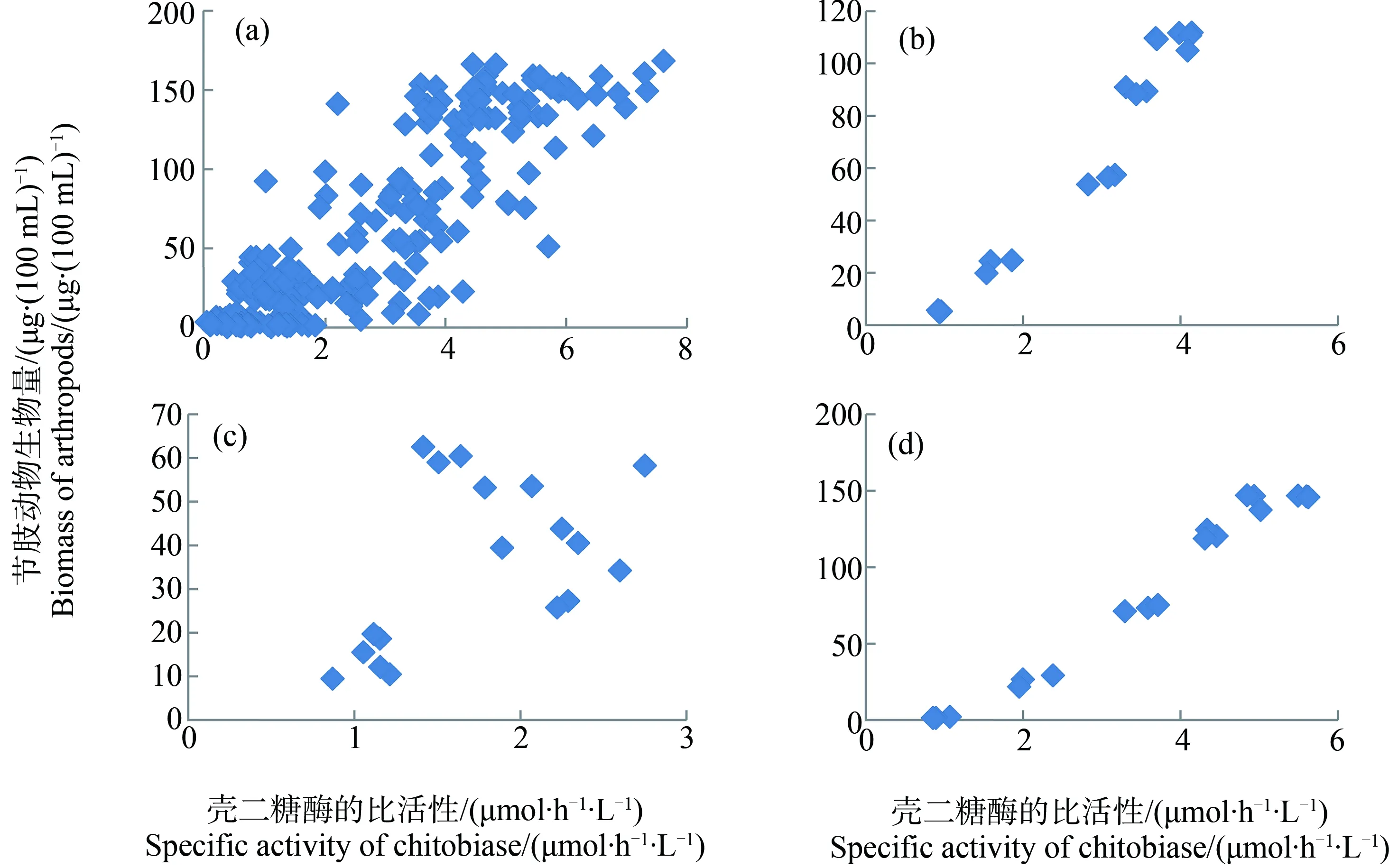
图13 壳二糖酶和生物量在“多节肢动物”系统内的变化Fig. 13 Change in chitobiase and biomass in “multi-arthropod” systems
致谢:本项研究中的溞和剑水蚤由南开大学生命科学学院王新华教授鉴定,介形虫由华东师范大学生命科学学院禹娜教授鉴定。在此一并致谢!
——以“不同咖啡因饮料对水蚤心率的影响”为例

