马铃薯A病毒在云南省的发生及其P3蛋白序列分析
杜 霞,吴 阔,苏晓霞,张丽珍,刘 霞,高玉林,张仲凯,杨艳丽*,董家红*
(1.云南农业大学云南省植物病理重点实验室/云南农业大学植物保护学院,云南 昆明 650201;2.云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部西南作物基因资源与种质创制重点实验室,云南 昆明 650205;3.中国农业科学院植物保护研究所,北京 100193)
【研究意义】中国2015年启动了马铃薯主粮化战略,马铃薯成为继小麦、水稻、玉米后的第四大主粮。中国是马铃薯产量最多的国家,云南省是中国马铃薯五大产区之一,其种植面积和总产量均居全国前四[1]。病害是马铃薯生产的重要限制因素,尤其是马铃薯病毒病会导致马铃薯种薯退化,产量降低,严重时减产达50 %以上[2]。通过田间样品症状识别、实验室RT-PCR、ELISA检测鉴定病害类型和病原种类,可为病害的准确防控提供依据[1,3]。【前人研究进展】马铃薯A病毒(Potato virus A,PVA virus)属于马铃薯Y病毒属(Potyvirus),其病毒粒子是线状,长约730 nm,直径15 nm[4]。PVA的基因组是一个正义单链RNA分子,长度9.5 kb左右,只包含一个开放阅读框架(Open reading frame,ORF),5′-末端共价结合基因组连接蛋白(Viral genome-linked protein,Vpg),3′-末端是多聚腺苷酸,其编码11个成熟功能蛋白,从N端到C端分别是P1蛋白(P1 protein)、HC-Pro酶(Helper component-proteinase)、P3蛋白(P3 protein,)、6K1蛋白(6K1 protein)、CI蛋白(Cylindrical protein)、6K2蛋白(6K2 protein)、Vpg、核内含体蛋白a(Nuclear inclusion body a protein,NIa-pro)、核内含体蛋白b(Nuclear inclusion body b protein,NIb-pro)和外壳蛋白(Coat protein,CP)[5]。马铃薯Y病毒属中在P3蛋白编码区,新发现第11个蛋白,命名为PIPO[6],对该蛋白的功能,有研究进行了初步探索,芜菁花叶病毒(Turnipmosaicvirus,TuMV)PIPO敲除突变体,仅敲除了PIPO蛋白的表达,但保持TuMV氨基酸序列不改变,该侵染性克隆对烟草不具有侵染性,这对病毒来说是致命的[6]。因此,推断PIPO可能会影响病毒的致病性[7]。有研究在大豆花叶病毒(Soybeanmosaicvirus,SMV)的PIPO不同位点处插入一个或多个终止子,发现病毒被限制在局部细胞中,但没有影响病毒复制,由此推测,PIPO的缺失影响了SMV的细胞间运动[8]。近些年,大量研究报道,P3可能会影响病毒基因组复制[9]、侵染[10]、细胞间运动以及植株抗性[11]。PVA是马铃薯上一类危害比较严重的病毒病,2007年PVA被列入《中华人民共和国进境植物检疫性有害生物名录》[12]。目前,PVA已在中国云南、浙江、福建、新疆、重庆、湖南、贵州、黑龙江、四川、青海、山西、内蒙古、甘肃[13-19]等地发生,PVA可以通过蚜虫以非持久性的方式进行传播,而这些传播PVA的蚜虫在中国又比较常见,PVA在中国大规模流行的风险很大,因此要引起重视。【本研究切入点】用DAS-ELISA方法对云南省不同地区马铃薯样品进行PVA检测,对呈阳性的马铃薯样品进行PVA P3蛋白基因的扩增和序列分析,并与国内外不同序列进行差异比较。【拟解决的关键问题】基于不同地区PVA病毒的基因信息,明确病毒的传播路径,为PVA防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 马铃薯病样 取样方法:各地取2个主栽品种,每个品种选3片田,每片田随机取5个点,每个点采集5株马铃薯的叶片。
分别在云南马铃薯的春作种薯区(2018年5月3日至2018年7月30日):大理州的洱源县和剑川县、迪庆州的香格里拉县和小中甸镇、曲靖市的会泽县和宣威市、昭通市的昭阳区和鲁甸县、丽江市的玉龙县;春作商品薯区(2018年3月5日至2018年6月19日):大理州的大理市、弥渡县和南涧县,曲靖市的罗平县和陆良县,昆明市的寻甸县;冬作区(2018年1月11日至2018年1月31日):临沧市的云县和双江县、大理州的宾川县、红河州的开远市等地共采集389个样品。马铃薯品种主要有合作88、丽薯6号、丽薯7号、宣薯6号、宣薯2号、米拉、青薯9号、青薯7号、云薯505、威芋5号、剑川红等主栽品种。
1.1.2 仪器与试剂 主要仪器有PCR仪(TaKaRa)、电泳仪、凝胶成像系统(基因有限公司);高通量微孔洗板机(Elx405)和酶标仪(Elx808)为BioTek公司产品。主要试剂有RNAiso Plus、PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit、Taq(5 U/μl)、10×Ex PCR Buffer(20 mmol/L Mg2+Plus)、dNTP Mixture(各2.5 mmol/L)、pMD18-T载体、大肠杆菌DH5α感受态细胞及DL2000 DNA Marker为TaKaRa公司产品;DNA回收试剂盒为AXYGEN公司产品;PVA DAS-ELISA试剂盒为Agdia公司产品;牛血清为Solarbio公司产品;底物(4-Nitrophenyl phosphate di(tris) salt)和10 %底物缓冲液(Diethanolamine)均为SIGMA公司产品。
1.2 方法
1.2.1 ELISA检测 采用PVA DAS-ELISA试剂盒进行PVA检测,步骤如下:在酶标板中加入1∶200包被抗体(Coating Buffer稀释),4 ℃包被过夜;以PBST洗板6次后,取待检测的马铃薯样品约0.2 g研磨后,加入500 μl Coating Buffer缓冲液混匀(1∶30,W/V),以健康的马铃薯叶片作为阴性对照,感病的组培马铃薯作为阳性对照,Coating Buffer为空白对照,向已包被的酶标板上加入样品,每个样品取100 μl,每个待测样品2个重复,37 ℃孵育2 h;PBST洗板6次,向板中每孔加入200 μl含2 %(牛血清:PBS,m/V)牛血清封闭液,37 ℃封闭30 min或4 ℃过夜;甩掉封闭液,将板中每孔加入100 μl效价1∶200的酶联抗体(2 %的牛血清稀释),37 ℃放置3 h;PBST洗板6次,拍干后,向板中每孔加入1 mg/mL(底物 ℃底物缓冲液,m/V)100 μl显色液,37 ℃避光放置30 min,酶标仪上读数,吸收波长为405 nm。
1.2.2 植物总RNA提取 对2018年在云南省临沧市的双江县(18YV013,2018年1月16日,丽薯6号),昆明市的寻甸县(18YV255,2018年6月19日,丽薯6号)、曲靖市的宣威市(18YV262,2018年6月20日,宣薯2号)、昭通市的昭阳区(18YV267,2018年6月26日,宣薯2号)和大理州的剑川县(18YV446,2018年7月18日,剑川红)所采集的经ELSIA检测叶片呈阳性的马铃薯样品采用TRIzol法提取马铃薯叶片的总RNA,所得RNA保存于-80 ℃备用。研磨样品的研钵需在180 ℃干热灭菌箱中处理3 h以上。操作步骤如下:用液氮在研钵中充分研磨样品,取样品60 mg至1.5 mL离心管中并加入1 mL RNAiso Plus充分混匀后,室温静置5 min;加入200 μl三氯甲烷,剧烈震荡30 s使溶液至乳白色,室温孵育5 min;4 ℃,12 000 r/min离心15 min;从离心机小心取出离心管,此时匀浆分为3层,即:无色的上清液(含RNA)、中间的白色蛋白层(大部分DNA)及带有颜色的下层有机相;吸取上清液转移到新的离心管中(切勿吸出白色中间层);向上清中加入500 μl异丙醇,上下颠倒充分混匀后,室温静置10 min;4 ℃,12 000 r/min离心10 min,一般在离心后,试管底部会出现RNA沉淀;弃掉上清,加入1 mL 75 %乙醇,洗涤,12 000 r/min离心5 min,弃掉上清,重复1次;自然干燥后,加入适量DEPC水溶解RNA。
1.2.3 引物的设计与合成 根据GenBank数据库中登录号为KF977085(China-Hunan)的PVA P3基因全长序列,利用引物设计软件Primer 5.0设计一对特异性引物,引物如下:PVA-P3-F:5′-GGCACTCCAAATTCTCAGATCAAT-3′;PVA-P3-R:5′-TTGAAACAGAACCACCTCTGCAC-3′。
预期扩增片段长度是1041 bp,引物由昆明擎科新业生物技术有限公司合成。反转录时所用引物初始浓度为100 pmol/L,PCR时所用引物初始浓度为10 pmol/L。
1.2.4 RT-PCR扩增、克隆 cDNA合成参照试剂盒说明书操作。反应体系如下:特异性引物 PVA-P3-R 1 μl,dNTPMixture(各2.5 mmol/L)1 μl,RNA 8μl以上为A,将A置于65 ℃,5 min后冰上迅速冷却;将以下组分加入A中,5×PrimeScriptⅡBuffer 4 μl,RNase Inhibitor(40 U/μl)0.5 μl,PrimeScriptⅡRtase(200 U/μl)1 μl,RNase free dH2O 4.5 μl,缓慢将其混匀后,46 ℃ 1 h,95 ℃ 5 min。得到的cDNA保存于-20 ℃备用。
PCR反应体系:cDNA 3 μl,PVA-P3-F 1 μl,PVA-P3-R 1 μl,10×Buffer(Mg2+) 5 μl,dNTPs(各2.5 mmol/L)4 μl,rTap聚合酶1 μl,加ddH2O至50 μl。
PCR反应程序:94 ℃ 4 min;94 ℃ 1 min,57 ℃ 1 min,72 ℃ 90 s,30个循环;72 ℃ 10 min。取5 μl PCR扩增产物与1 μl 6×Loading Buffer混匀,用1 %的琼脂糖凝胶电泳检测PCR产物,在凝胶成像系统中拍照。
用DNA胶回收试剂盒回收纯化克隆产物,将其与pMD18-T载体连接,转入大肠杆菌DH5α感受态细胞中,用含氨苄青霉素(Ampicillin)抗性LB培养基进行筛选阳性克隆,经菌落PCR鉴定后送去测序。目的片段的测序工作在昆明擎科新业生物技术有限公司进行。
1.2.5 序列分析 使用BLASTN工具进行序列比对;用DNAStar和DNAMAN等软件分析序列;采用MEGA 6.0邻接法(Neighbor-Joining,NJ)构建系统进化树。用于序列分析的13个PVA分离物下载自GenBank: AF543212(USA-U clone1-Potato)、AJ131400(Finland-Her-Potato)、AJ131401(Germany-Ali-Potato)、AJ131402(USA-U-Potato)、AJ131403(New Zealand-TamMV-Tamarillo)、AJ296311(Hungary-B11-Potato)、GU144321(UK-143-Potato)、KF977085(China-Hunan-Potato)、KM365067(New Zealand-007-Tamarillo)、KM365068(New Zealand-B14-Tamarillo)、KM365069(New Zealand-LL6-Tamarillo)、KU586450(Peru-GAF318-Potato)、Z21670(USA-M-Potato)。
2 结果与分析
2.1 ELISA检测结果
用Agdia公司的PVA DAS-ELISA试剂盒检测云南省19个县(市)的389个马铃薯样品,PVA的阳性检出率为20.82 %;其中检测主栽品种宣薯2号30个样品,阳性率为50.00 %,丽薯6号的110个样品阳性率为21.82 %,合作88的53个样品阳性率为18.87 %、9个剑川红样品均为阳性(表1)。

表1 云南省389个马铃薯样品的ELISA检测Table 1 ELISA detection of 389 potato samples from Yunnan province

续表1 Continued table 1
2.2 PVA P3蛋白基因RT-PCR扩增、克隆、测序
以ELISA检测呈阳性的马铃薯叶片所提的总RNA为模板,PVA-P3-F和PVA-P3-R为引物进行反转录和扩增(图1)、克隆及测序,用DNAMAN软件分析获得1041bp的特异性片段,其产物大小与预期一致。
2.3 云南省不同地区PVA分离物之间P3及PIPO蛋白序列分析
用DNAStar软件分析云南省5个不同地区PVA分离物之间的P3蛋白基因和PIPO蛋白基因的核苷酸序列及氨基酸序列的同源性。结果发现,云南省5个地区PVA分离物之间P3蛋白基因的核苷酸序列的同源性为98.7 %~99.6 %;推导的氨基酸序列同源性为98.8 %~99.7 %。
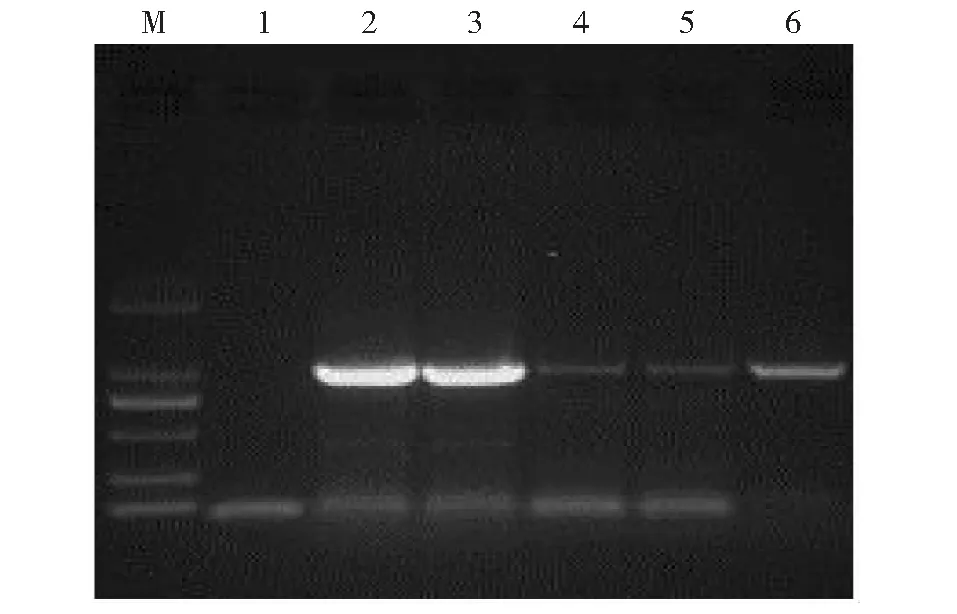
M:DL2000 DNA Marker;1:阴性;2:18YV013;3:18YV255;4:18YV262;5:18YV267;6:18YV446M: DL2000 DNA Marker; 1: Negative; 2: 18YV013; 3: 18YV255; 4: 18YV262; 5: 18YV267; 6: 18YV446图1 云南省5个PVA分离物P3基因扩增Fig.1 P3 protein gene amplification of 5 PVA Yunnan isolates
PIPO蛋白基因的核苷酸序列同源性为99.2 %~100.0 %,推导的氨基酸序列同源性为97.6 %~100.0 %。
2.4 云南省和其他已报道的PVA分离物的P3蛋白及PIPO蛋白序列同源性分析
用DNAStar软件分析云南省5个分离物(18YV013、18YV255、18YV262、18YV267及18YV446),与GenBank中的13个已发表的PVA P3蛋白基因之间的同源性,发现云南省分离物与湖南省分离物China-Hunan具有最高的核苷酸序列同源性和氨基酸序列同源性分别为99.2 %和99.1 %;其次是秘鲁分离物Peru-GAF318,核苷酸序列同源性和氨基酸序列同源性分别为98.9 %和99.1 %。与新西兰树番茄(Solanumbetaceum)4个分离物(New Zealand-007、New Zealand-B14、New Zealand-LL6和New Zealand-TamMV)的核苷酸序列同源性和氨基酸序列同源性最低,分别为84.5 %~99.2 %和90.8 %~97.4 %。用软件构建的系统进化树分析,发现来自世界各地的PVA主要分为2个大组,其中新西兰树番茄的3个分离物(New Zealand-007、New Zealand-LL6和New Zealand-TamMV)成一组,其余马铃薯分离物与新西兰树番茄分离物New Zealand-B14成一组,在马铃薯分离物组中,中国的6个PVA分离物聚为一个亚分支,他们之间具有最近的亲缘关系(图2)。

表2 云南省5个PVA分离物和其他已报道的13个PVA分离物的P3蛋白基因核苷酸序列和推导的氨基酸同源性分析Table 2 Nucleotide and putative amino acid sequenceidentitiesof P3 protein gene between Yunnan 5 PVA isolatesand other reported13 PVA isolates
注:nt 表示核苷酸序列,aa表示氨基酸序列,下同。
Notes:nt is nucleotide suquence,aa is amino acid sequence.The same as below.
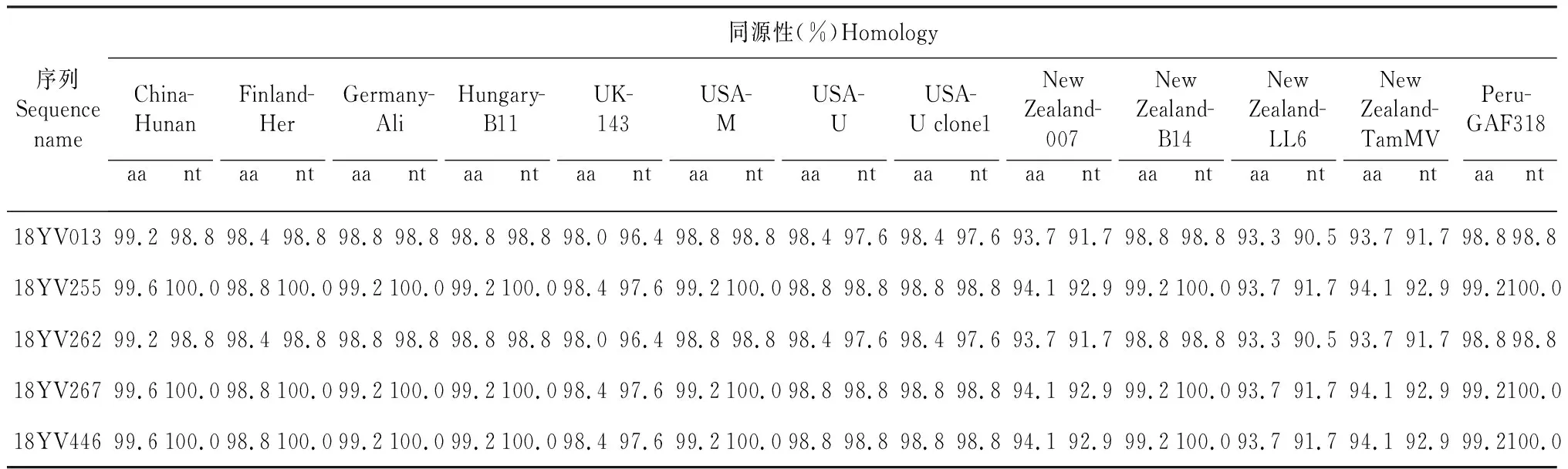
表3 云南省5个PVA分离物和其他已报道的13个PVA分离物的PIPO蛋白基因的核苷酸序列和推导的氨基酸同源性分析Table 3 Nucleotide and putative amino acid sequence identities of PIPO protein gene between Yunnan 5 PVA isolatesand other reported13 PVA isolates
用DNAStar软件分析云南省5个分离物(18YV013、18YV255、18YV262、18YV267及18YV446)与GenBank中的13个已发表的PVA PIPO蛋白基因之间的同源性,相比P3蛋白之间的亲缘关系,PIPO间具有更高的同源性。14个马铃薯分离物之间的核苷酸序列和氨基酸序列的同源性分别为98.0 %~99.6 %、96.4 %~100.0 %;而云南省5个分离物之间的核苷酸序列和氨基酸序列的同源性分别为99.2 %~100.0 %、97.6 %~100 %;分离自昆明寻甸、昭通昭阳、大理剑川、临沧双江与其余PVA马铃薯分离物具有更近的亲缘关系,而分离自曲靖宣威的分离物独立为一分支(图3)。
3 讨 论
为了解马铃薯A病毒在云南省的发生情况,于2018年通过云南省农业现代化马铃薯产业体系各试验站分别针对云南种薯繁育、春作区、冬作区马铃薯进行调查取样,对各样品进行了ELISA检测,PVA检出率为20.82 %,其中迪庆、丽江、大理、昭通、宣威等种薯繁育带毒率为27.70 %,主要感染的品种是丽薯6号,感染率为7.98 %;曲靖的罗平、陆良和昆明等春作区带毒率为21.05 %,主要感染的品种是丽薯6号和宣薯2号,感染率均为4.64 %;临沧、开远等冬作区的带毒率为19.70 %,主要感染的品种是丽薯6号,感染率为13.64 %。PVA在云南马铃薯上发生较为普遍,但在田间调查时,马铃薯植株上症状表现不明显,绝大部分为无症,并没有引起更多关注,对马铃薯产量、品质的影响也需要开展更多研究。
文献报道,马铃薯Y病毒属P3蛋白有可能影响病毒基因组复制、侵染、细胞间运动以及植株抗性。PVA 的P3蛋白与NIb相关,参与病毒的复制,P3是马铃薯Y病毒属中变异性最大的部分,推测与其在病毒专化型进化过程扮演重要的角色相关,P3可能是致病性决定性的因素之一[20]。P3还是决定寄主抗性的主要因子[11]。P3序列的变化会影响其编码的氨基酸序列的变化,导致其功能产生较大的变化,影响病毒的复制、侵染,对植物的产生的影响也会随之变化。PIPO是包含在P3序列中的一部分,是一个新发现的蛋白,对其功能还并不是很明确,但有文献报道,PIPO会影响病毒的致病性和病毒在细胞间的运动。为了确定云南不同地区PVA亲缘关系,设计了PVA的P3特异性引物对云南5个地区(昆明市的寻甸县、宣威市的宝山镇、昭通市的昭阳区、大理州的剑川县和临沧市的双江县)的3个品种(丽薯6号、宣薯2号和剑川红)上的5个分离物进行序列扩增、克隆、测序分析。5个云南省PVA分离物与国内外其它地区分离物的13个PVA分离物的同源性的相互比较,发现侵染云南省马铃薯的PVA之间亲缘关系较近,云南省与湖南省马铃薯PVA分离物亲缘关系最近,云南省5个PVA分离物之间变异不大(P3变异度0.3~1.2,PIPO变异度0.0~2.4);与其它地区马铃薯分离物的变异也不大(P3变异度0.9~2.3,PIPO变异度0.0~3.7);但与新西兰树番茄分离物的变异均较大(P3变异度2.6~9.9,PIPO变异度0.0~10.2),显示PVA具有寄主适应性。云南省5个地区的PVA之间存在一定的变异性,但是差异不大,推测其来源于同一个PVA分离株。基于18个PVA的P3和PIPO氨基酸序列构建系统进化树也表明马铃薯分离的PVA较树番茄上分离的PVA有较近的亲缘关系,也表现出一定的地域相关性。

图2 根据PVA P3蛋白基因的氨基酸序列构建5个云南省PVA分离物与其他已报道的PVA分离物之间的系统进化树Fig.2 Phylogenetic tree based on animo acid sequences of P3 proteingene of Yunnan 5 PVA isolates and other reported 13 PVA isolates
通过对PVA的P3和PIPO分析,可以为PVA的防控及其的分布、传播,变异与进化分析提供理论依据,对马铃薯产业具有重要意义。
4 结 论
PVA在云南省的危害较为普遍,研究明确了云南省5个地区PVA的P3蛋白序列和PIPO蛋白序列,以及云南省不同地区分离物之间有较近的亲缘关系,表现一定的地域相关性。通过同源一致性分析,明确了云南省5个地区的PVA之间存在一定的变异性,但是差异不大。通过进化树分析,5个地区的PVA遗传变异和地理来源存在一定的相关性。

用烟草叶脉斑点病毒 (TVMV)作为组外的根Tobacoo vein mottling virus (TVMV) was regarded as root outside the group图3 根据PIPO蛋白基因的氨基酸序列构建云南省5个分离物与其他已报道的分离物之间的系统进化树Fig.3 Phylogenetic tree based on animo acid sequences of PIPO proteingene of Yunnan 5 PVA isolates and other reported 13 PVA isolates

