褪黑素对精神分裂症模型大鼠海马神经元氧化应激损伤的保护作用
陈宏,梁艳,金颖莉,虞希冲,赵永忠,王维千,林青霞,林海西,杨闯
(1.温州医科大学附属第一医院 精神卫生科,浙江 温州 325015;2.温州医科大学附属第二医院 消化内科,浙江 温州 325027;3.温州医科大学 药学院,浙江 温州 325035)
精神分裂症是一种涉及感知觉、思维、情绪和行为等多方面障碍以及精神活动不协调的重性精神疾病,临床表现异质性大,药物治疗转归欠佳[1],然而发病机制尚不明确。近年来有关精神分裂症谷氨酸受体功能紊乱假说受到足够关注,认为谷氨酸受体缺陷导致谷氨酸能系统异常是精神分裂症发生的重要原因,在此基础上采用MK-801特异性阻断谷氨酸受体能导致大/小鼠产生精神分裂症患者类似的异常行为[2-3]。褪黑素(melatonin,MT)是由脑松果体合成分泌的一种吲哚类神经内分泌激素,具有调节机体昼夜节律、保护胆碱、抗氧化、抗炎等功效,参与体内多种生理反应[4]。近年来,MT在神经保护方面的作用受到重视,研究表明其能修复受损的神经元突触,促进神经元间的信号交流,延缓神经退行性疾病的发生[5]。然而,MT能否影响精神分裂症的发生发展进程,尚未见相关报道。本研究旨在观察MT能否对精神分裂症模型大鼠海马神经元产生保护作用,并探讨其作用机制,为MT治疗精神分裂症提供实验依据。
1 材料和方法
1.1 实验动物与主要试剂 雄性SD大鼠60只,6~8周龄,体质量180~220 g,由上海斯莱克实验动物有限公司提供,许可证号SCXK(沪)2017-0005。整个实验期间大鼠均饲养在SPF级标准环境中,适应性喂养5 d后开始正式实验。MT、Luzindole(美国Sigma公司);双氢罗丹明(DHR)-123试剂盒(上海碧云天公司);SOD、MDA酶联免疫试剂盒(南京建成公司);兔抗大鼠核因子E2相关因子2(nuclear factor E2-elated factor 2,Nrf2)、血红素加氧酶-1(heme oxygenase-1,HO-1)多克隆抗体(英国Abcam公司);NeuN多克隆抗体(美国CST公司);山羊抗兔IgG二抗(美国CST公司)。
1.2 造模和实验分组 将大鼠随机分为5组,包括对照组、模型组、模型+MT低剂量组、模型+MT高剂量组、模型+MT受体阻断剂组,每组12只。除对照组大鼠外,其余均采用持续性腹腔注射MK-801的方法建立精神分裂症大鼠模型[6],注射剂量为每天0.6 mg/kg,持续注射14 d。通过SAMS-DODD刻板行为评分法[7]对造模大鼠进行评分,证实所有大鼠均造模成功。于实验第15天开始给药,其中模型+MT低剂量组和模型+MT高剂量组分别腹腔注射MT溶液12.5 mg/kg、25 mg/kg,模型+MT受体阻断剂组腹腔注射Luzindole 1 mg/kg,对照组及模型组分别腹腔注射10%无水乙醇溶液,各组均给药21 d。给药完成后,所有大鼠进行行为学检测,测试完成后麻醉大鼠,腹主动脉取血,并分离海马组织进行后续指标检测。
1.3 Morris水迷宫实验 Morris水迷宫实验分为两部分。①定位航行实验:于给药第17天开始进行训练,连续4 d,考察大鼠的学习能力;将大鼠从Morris水迷宫左下方平台所在区域放入,放入时头朝向池壁,待其自由游泳,找到并爬上平台,并记录时间(逃避潜伏期);若大鼠在1 min内未找到,则将其牵引至平台,停留10 s后放回笼内,其潜伏期时间记为60 s。②空间探索实验:在连续4 d的学习后撤去平台,将大鼠从水迷宫右上方面向池壁放入,记录其在1 min内穿越原平台区域次数及在原平台区域的停留时间(空间探索时间)。
1.4 氧化应激检测方法 采用DHR-123试剂盒检测大鼠海马匀浆液中活性氧(reactive oxygen species,ROS)的相对水平,ELISA试剂盒检测海马匀浆液中超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malonic dialdehyde,MDA)的含量,实验操作过程均按照试剂盒说明书进行。
1.5 免疫组织化学方法 取固定完全的海马组织,经石蜡包埋后切片,分别用75%、95%、100%梯度乙醇脱水、浸蜡、水化、冲洗、滴加山羊血清封闭液,在37 ℃孵育30 min,加一抗孵育过夜(1:100稀释);PBS洗3次,加二抗孵育15 min,冲洗,加DAB液染色,苏木精复染,梯度乙醇脱水,封片。于显微镜下选择4个视野,统计阳性细胞数量,取平均值。
1.6 Western blot方法 取冷冻保存的海马组织,加入强力组织裂解液,冰上匀浆,离心,取上清液测定总蛋白含量。根据目的蛋白分子量制备分离胶和浓缩胶,蛋白变性,上样,跑凝胶电泳,电泳完成转膜,在室温下用脱脂牛奶封闭1 h,裁剪条带,加入稀释后的Nrf2、HO-1一抗(1:1 000),4 ℃冰箱孵育过夜。采用TBST溶液洗涤条带4次,每次15 min,加入二抗继续孵育4 h,洗涤,化学发光法显影。采用图像分析软件统计Nrf2和HO-1蛋白条带灰度值,计算目的蛋白的相对表达水平。
1.7 统计学处理方法 采用SPSS21.0统计学软件进行数据分析。计量资料用表示,多组间比较用单因素方差分析,组间两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组定位航行实验结果比较 与对照组比,训练第3天和第4天模型组逃避潜伏期时间明显延长,差异有统计学意义(均P<0.05);与模型组比,训练第3天和第4天模型+MT高剂量组的逃避潜伏期时间明显缩短,差异有统计学意义(均P<0.05);与模型+MT高剂量组比,训练第4天模型+MT受体阻断剂组逃避潜伏期时间延长,差异有统计学意义(P<0.05),见表1。
表1 各组定位航行实验中逃避潜伏期时间比较(每组n=12,s)
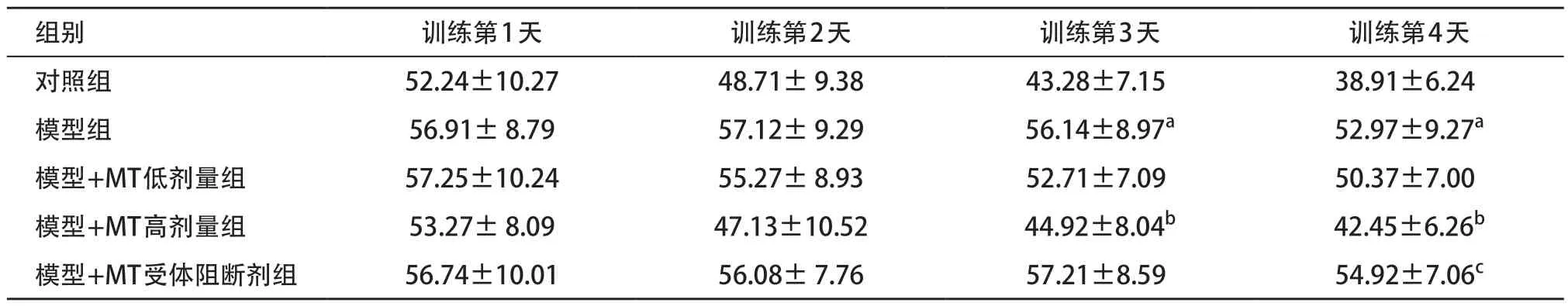
表1 各组定位航行实验中逃避潜伏期时间比较(每组n=12,s)
与对照组比:aP<0.05;与模型组比:bP<0.05;与模型+MT高剂量组比:cP<0.05
组别 训练第1天 训练第2天 训练第3天 训练第4天对照组 52.24±10.27 48.71± 9.38 43.28±7.15 38.91±6.24模型组 56.91± 8.79 57.12± 9.29 56.14±8.97a 52.97±9.27a模型+MT低剂量组 57.25±10.24 55.27± 8.93 52.71±7.09 50.37±7.00模型+MT高剂量组 53.27± 8.09 47.13±10.52 44.92±8.04b 42.45±6.26b模型+MT受体阻断剂组 56.74±10.01 56.08± 7.76 57.21±8.59 54.92±7.06c
2.2 各组空间探索实验结果比较 与对照组比,模型组穿越平台次数及停留时间均显著减少,差异有统计学意义(均P<0.05);与模型组比,模型+MT低剂量组和模型+MT高剂量组原平台区域的停留时间均显著增加,差异有统计学意义(均P<0.05);与模型+MT高剂量组比,模型+MT受体阻断剂组原平台区域的停留时间显著减少,差异有统计学意义(P<0.01),见表2。
表2 各组空间探索实验结果比较(每组n=12
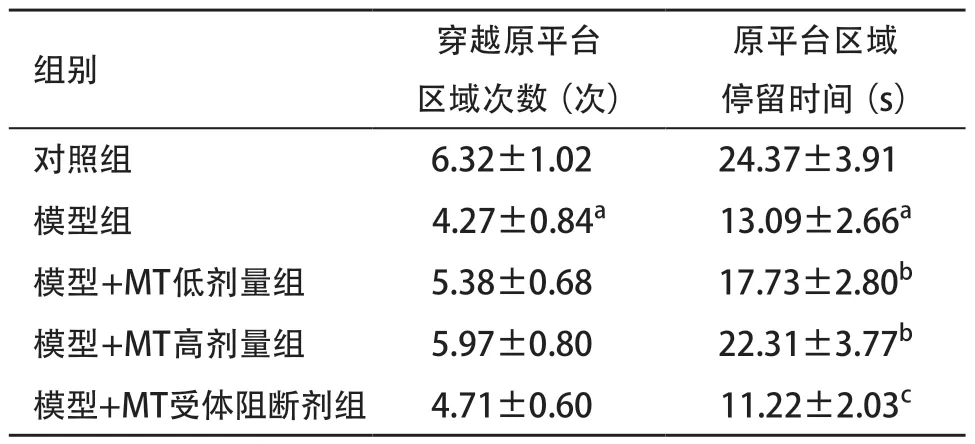
表2 各组空间探索实验结果比较(每组n=12
与对照组比:aP<0.05;与模型组比:bP<0.05;与模型+MT高剂量组比:cP<0.05
组别 穿越原平台区域次数(次)原平台区域停留时间(s)对照组 6.32±1.02 24.37±3.91模型组 4.27±0.84a 13.09±2.66a模型+MT低剂量组 5.38±0.68 17.73±2.80b模型+MT高剂量组 5.97±0.80 22.31±3.77b模型+MT受体阻断剂组 4.71±0.60 11.22±2.03c
2.3 各组海马氧化应激因子水平比较 与对照组比,模型组海马匀浆液中ROS、MDA含量显著增加,SOD活性下降,差异有统计学意义(均P<0.05);与模型组比较,模型+MT高剂量组大鼠海马ROS、MDA含量均下降,SOD活性升高,差异有统计学意义(均P<0.05);与模型+MT高剂量组比,模型+MT受体阻断剂组ROS、MDA含量增加,差异有统计学意义(均P<0.05),见表3。
2.4 各组大鼠海马NeuN蛋白表达量比较 对照组大鼠海马神经元丰富,排列整齐有序;模型组大鼠海马神经元稀疏、排列散乱,部分神经元胞体变大,呈空泡状,NeuN阳性细胞数较对照组显著减少,差异有统计学意义(P<0.01);与模型组比,模型+MT高剂量组海马NeuN阳性表达明显增加,差异有统计学意义(P<0.01);与模型+MT高剂量组比,模型+MT受体阻断剂组NeuN阳性细胞明显减少,差异有统计学意义(P<0.01),见图1和表4。
2.5 各组大鼠海马Nrf2、HO-1蛋白表达水平比较 与对照组比,模型组大鼠海马Nrf2、HO-1蛋白表达均显著上升,差异有统计学意义(P<0.01);与模型组比,模型+MT高剂量组Nrf2、HO-1表达均显著增加,差异有统计学意义(P<0.01);与模型组比,模型+MT低剂量组Nrf2表达增加,差异有统计学意义(P<0.05);与模型+MT高剂量组比,模型+MT受体阻断剂组Nrf2、HO-1表达水平均显著下调,差异有统计学意义(P<0.01)。见表5。
表3 各组海马氧化应激因子水平比较(每组n=6,
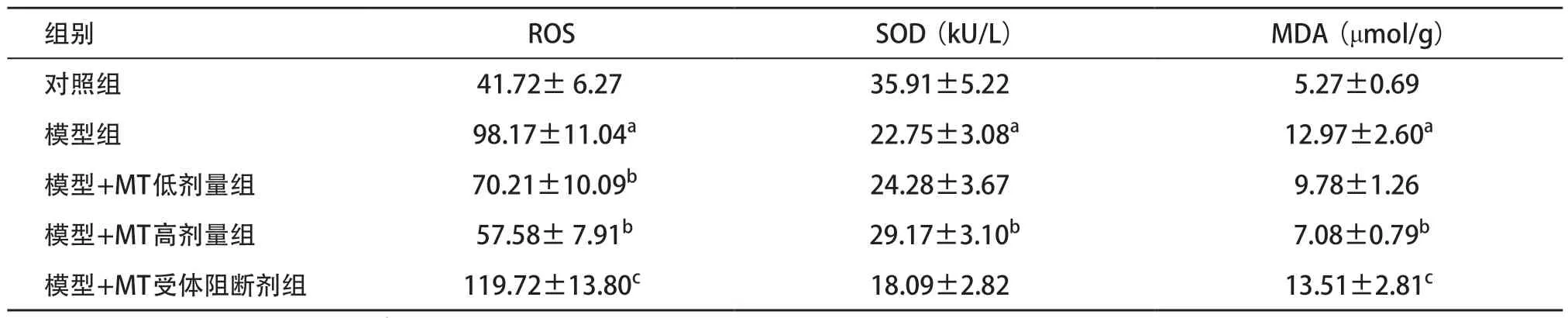
表3 各组海马氧化应激因子水平比较(每组n=6,
与对照组比:aP<0.05;与模型组比:bP<0.05;与模型+MT高剂量组比:cP<0.05
组别 ROS SOD(kU/L) MDA(μmol/g)对照组 41.72± 6.27 35.91±5.22 5.27±0.69模型组 98.17±11.04a 22.75±3.08a 12.97±2.60a模型+MT低剂量组 70.21±10.09b 24.28±3.67 9.78±1.26模型+MT高剂量组 57.58± 7.91b 29.17±3.10b 7.08±0.79b模型+MT受体阻断剂组 119.72±13.80c 18.09±2.82 13.51±2.81c
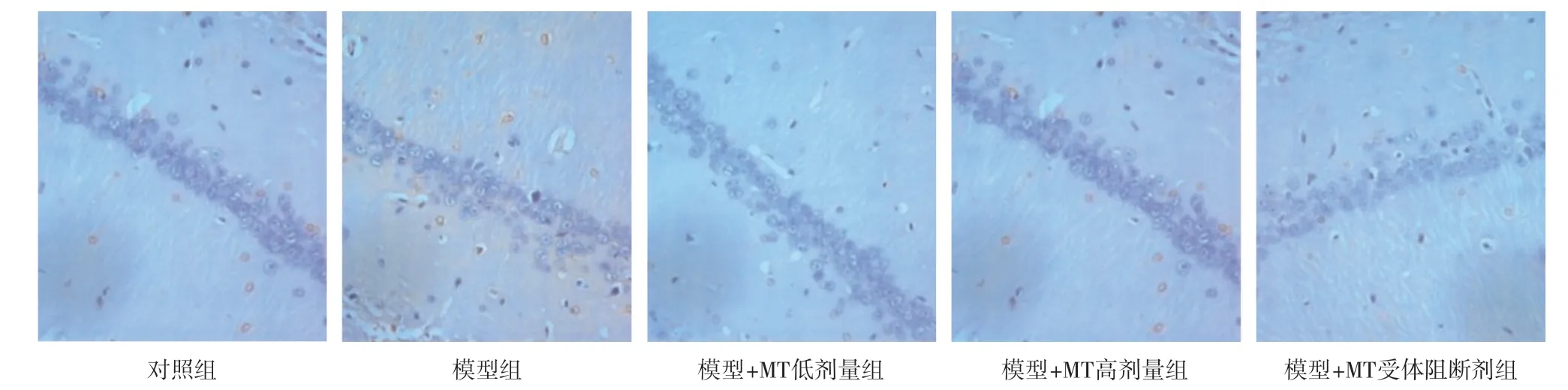
图1 大鼠海马NeuN阳性细胞表达情况(免疫组织化学染色,×200)
表4 各组大鼠海马NeuN阳性细胞数比较(每组n=6,
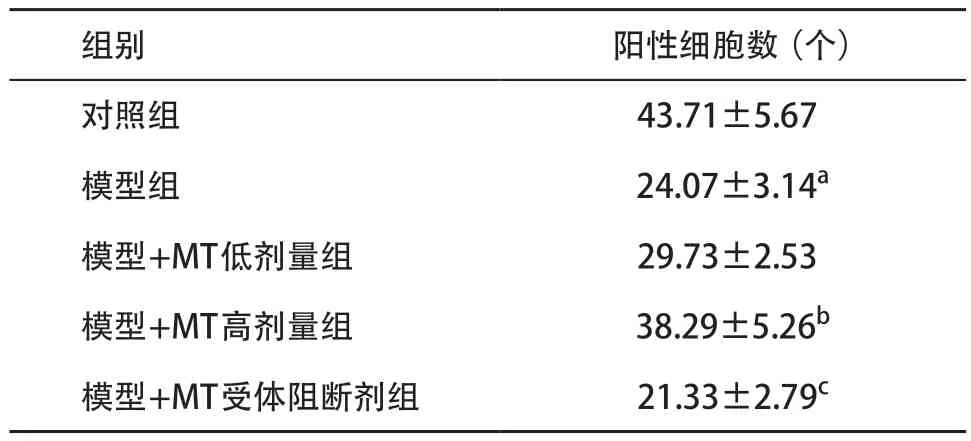
表4 各组大鼠海马NeuN阳性细胞数比较(每组n=6,
与对照组比:aP<0.05;与模型组比:bP<0.05;与模型+MT高剂量组比:cP<0.05
组别 阳性细胞数(个)对照组 43.71±5.67模型组 24.07±3.14a模型+MT低剂量组 29.73±2.53模型+MT高剂量组 38.29±5.26b模型+MT受体阻断剂组 21.33±2.79c
表5 各组大鼠海马Nrf2、HO-1蛋白表达水平比较(每组n=4±s)
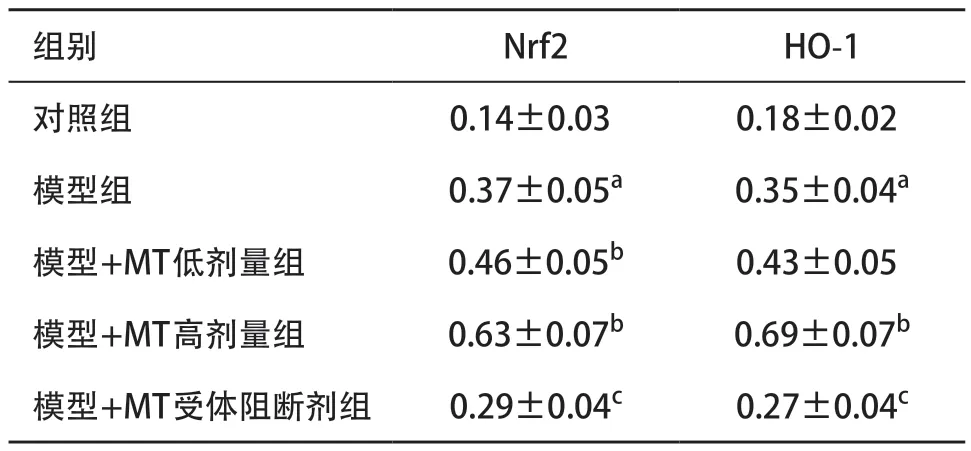
表5 各组大鼠海马Nrf2、HO-1蛋白表达水平比较(每组n=4±s)
与对照组比:aP<0.05;与模型组比:bP<0.05;与模型+MT高剂量组比:cP<0.05
组别 Nrf2 HO-1对照组 0.14±0.03 0.18±0.02模型组 0.37±0.05a 0.35±0.04a模型+MT低剂量组 0.46±0.05b 0.43±0.05模型+MT高剂量组 0.63±0.07b 0.69±0.07b模型+MT受体阻断剂组 0.29±0.04c 0.27±0.04c
3 讨论
目前国际上认为,精神分裂症的发生是由于N-甲基-D天冬氨酸(NMDA)受体功能障碍导致的。MK-801是NMDA受体的特异性阻断剂,广泛用于建立精神分裂症动物模型,能引发啮齿类动物认知功能障碍、活动迟缓或亢进、动作异常等与人类临床发病类似的特征[8]。本研究中,MK-801持续注射后大鼠学习与记忆功能均明显下降,海马结构受损,神经元数量下降,均符合精神分裂症动物模型的病理特点。
氧化应激是导致神经元损伤的重要原因,其机制是外界刺激引起的机体氧化-抗氧化间的失衡,ROS大量累积,造成脑稳态失调及细胞色素C过量释放等,引发神经炎症和线粒体功能紊乱,神经元损伤甚至凋亡[9-10]。研究表明,抑郁症、阿尔茨海默症、帕金森病等脑神经精神疾病均与氧化应激损伤有关[11]。本研究发现,精神分裂症模型大鼠海马ROS和MDA含量均显著增加,SOD活性下降,同时海马神经元稀疏,排列散乱,神经元标志蛋白NeuN阳性表达较正常大鼠显著降低,说明在精神分裂症疾病状态下,海马遭受严重的氧化应激而导致神经元损伤,认知功能障碍,表现出疾病的临床特征;MT则能呈剂量依赖性地发挥抗氧化作用,保护海马神经元。
Nrf2是调控细胞对抗氧化应激损伤的关键转录因子。生理状态下,Nrf2通常与其抑制物Keap1结合于胞浆中,未能进入细胞核发挥转录活性;而在氧化应激状态下,Nrf2会与Keap1解离,进入到胞核中与抗氧化反应元件结合,从而启动下游抗氧化蛋白、抗炎性因子、免疫因子等多种靶基因的转录[12]。HO-1是Nrf2调控的下游关键靶基因之一,主要在对抗氧化应激损伤中发挥重要作用[13]。研究表明,Nrf2基因敲除小鼠的抗氧化应激效应明显减弱,H0-1活性降低,ROS水平升高[14];在激活Nrf2相关通路后,能减轻阿尔兹海默症大鼠海马神经元的损伤,发挥神经保护作用[15]。在本研究中,模型大鼠海马Nrf2、HO-1蛋白表达均显著上升,表明大鼠在应对外源氧化应激损伤时启动了内源性保护机制,Nrf2蛋白核转位,并促进下游抗氧化HO-1基因的转录及表达;MT治疗后,Nrf2、HO-1表达进一步增加,说明MT能激活Nrf2/HO-1通路,而应对疾病状态下的神经元氧化应激损伤。
MT是由松果体分泌的一种内源性激素,可通过矫正生物钟和调节神经内分泌功能而发挥清除氧自由基、抗应激及延缓衰老等作用,临床治疗失眠疗效显著[16]。研究证实,在焦虑症、抑郁症、精神分裂症、恐怖症等与睡眠障碍有关的精神类疾病中均存在MT分泌不足的现象[17]。本研究发现,MT能降低精神分裂症大鼠氧化应激损伤,保护海马神经元,改善认知功能,其机制可能与调控Nrf2/HO-1信号通路有关;本研究还设置了MT受体阻断剂组,发现在阻断MT受体后,模型大鼠海马神经元损伤程度及认知障碍均更为严重。本研究提示MT在保护精神分裂症大鼠神经元氧化应激损伤中的重要作用,为其在该疾病的临床应用提供一定的借鉴意义。

