新型冠状病毒S蛋白B细胞表位的预测与分析
朱珊丽,丁宁,项丹,董海艳,薛向阳,张丽芳
(温州医科大学 微生物学与免疫学教研室 分子病毒与免疫研究所,浙江 温州 325035)
2019年末开始,我国暴发了新型冠状病毒(SARS-CoV-2)感染肺炎疫情,形势严峻。SARS-CoV-2属β冠状病毒属,其长约30 kb的基因组中仅10 kb为编码区,编码结构蛋白与辅助蛋白,其编码的结构蛋白分别为:刺突蛋白(S protein)、膜蛋白(M protein)、包膜蛋白(E protein)和核衣壳蛋白(Nucleocapsid)[1-3]。其中,S蛋白可被宿主蛋白酶裂解为S1与S2两个亚单位,其中S1亚单位位于包膜刺突的顶端,介导病毒与宿主细胞表面的病毒受体结合,是决定病毒入侵易感细胞的关键蛋白;而S2亚单位则形成刺突的茎部,介导病毒包膜与宿主细胞膜融合,促使病毒进入宿主细胞。因此,SARSCoV-2的S刺突蛋白在病毒对宿主细胞的吸附和侵入过程中发挥着重要作用,而通过阻断病毒对宿主细胞的吸附和穿入是特异性预防SARS-CoV-2感染的重要途径。本研究拟利用生物信息学预测分析SARSCoV-2 S蛋白二级结构及可能的B细胞表位,为研究该蛋白的功能及疫苗开发提供理论依据。
1 材料和方法
1.1 SARS-CoV-2 S蛋白氨基酸序列 从NCBI数据库(https://www.ncbi.nlm.nih.gov/nuccore/NC_045512)获得SARS-CoV-2 S区域的核苷酸及相应的氨基酸序列(NC_045512.2)。
1.2 SARS-CoV-2 S蛋白二级结构预测 应用EXPASY服务器(https://www.expasy.org/resources)上的SOPMA、GOR等方法分析预测S蛋白的二级结构。1.3 SARS-CoV-2 S蛋白跨膜区预测 采用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测分析S蛋白的跨膜区。
1.4 SARS-CoV-2 S蛋白亲水性、表面可及性、抗原性预测 采用Kyte-Doolittle亲水性参数[4]、Emini表面可及性参数[5]、Jameson-Wolf抗原性指数(antigenicity index,AI)[6]等进行预测。
1.5 综合分析 对上述预测的结果进行综合分析,兼顾各预测参数推测SARS-CoV-2 S蛋白可能的B细胞表位,并用吴玉章等[7]建立的AI计算方法,综合评判SARS-CoV-2 S蛋白的B细胞优势表位。
2 结果
2.1 S蛋白二级结构预测 SARS-CoV-2 S蛋白的氨基酸有1 273个氨基酸,相对分子质量为140 kDa。分别应用EXPASY服务器上的SOPMA、GOR方法预测S蛋白的二级结构。2种方法对S蛋白的二级结构预测一致性较高,均提示S蛋白二级结构中的柔性区域以无规卷曲为主,少见β-转角,且无规卷曲主要位于其氨基酸的19~35、69~90、145~168、205~219、228~236、247~262、379~393、437~451、461~506、515~689、695~718、789~814、1 105~1 119、1 133~1 145区段(见图1)。
2.2 S蛋白跨膜区预测 经TMHMM预测分析,SARSCoV-2 S蛋白为一单次跨膜蛋白,N端大部分氨基酸位于膜外,C末端位于膜内(见图2)。这一预测结果与SARS-CoV S蛋白的跨膜区一致,即S蛋白N端氨基酸组成刺突顶部与人肺泡细胞膜表面血管紧张素转换酶II(angiotensin converting enzyme II,ACE2)受体结合,C端除融合肽、HR区段外,末端约60个氨基酸组成跨膜区和膜内区。

图2 TMHMM预测SARS-CoV-2 S蛋白的跨膜区

图1 SARS-CoV-2 S蛋白二级结构预测
2.3 S蛋白的亲水性、表面可及性、抗原性参数预测 应用不同的方法预测,SARS-CoV-2 S蛋白B细胞抗原表位的数量及抗原表位可能出现的肽段均不同,但其中71~84、144~168、352~361、404~428、525~539、565~582、676~689、772~779、807~818区段则基本一致(见图3)。
2.4 SARS-CoV-2 S蛋白表位的综合分析 综合以上预测结果,并根据吴玉章等[7]建立的AI计算方法,计算SARS-CoV-2 S蛋白可能的B细胞表位区段平均AI。结果显示,S蛋白的354~360、437~445、454~471、527~537、567~582、678~685、772~779和806~818区段AI相对较高,这些区域可能是SARS-CoV-2 S蛋白潜在的B细胞表位(见表1)。
3 讨论
冠状病毒基因组编码的S刺突蛋白是病毒最大的结构蛋白,也是介导冠状病毒感染和入侵宿主细胞的关键因子。有研究报道SARS-CoV S蛋白可诱导机体产生保护性中和抗体,故S蛋白是疫苗、治疗性抗体的研制及临床诊断的主要靶蛋白[8]。
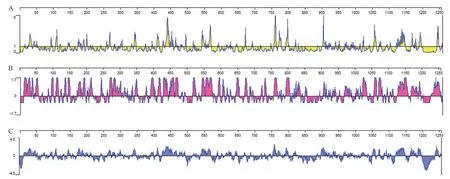
图3 多种不同参数对S蛋白的预测结果
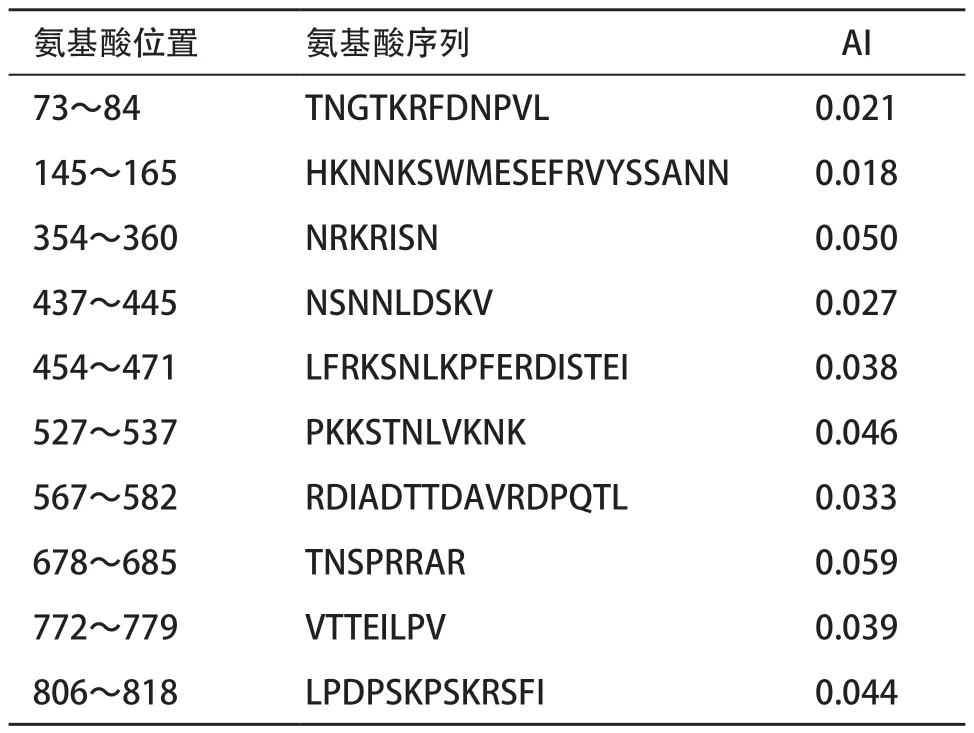
表1 SARS-CoV-2 S蛋白的B细胞表位优势区域的平均AI
然而,前期动物实验证实SARS-CoV全长S蛋白作为疫苗可诱导机体产生的抗体IgG,在降低肺部病毒滴度的同时还可产生病理性免疫反应,即促进炎性细胞因子IL-8、MCP-1的产生和炎性巨噬细胞在肺部聚集引起急性肺损伤[9]。另有研究报道,接种全长S蛋白疫苗后接受SARS-CoV攻击,机体中病毒的感染量更高,即产生了抗体依赖的增强作用(antibody-dependent enhancement,ADE),并可引起受试动物肝损伤[10-12]。故推测全长S蛋白并不是疫苗研发的最佳选择,其安全性和保护性能需进一步考虑。且S蛋白的高度糖基化可以使其结构更稳定,通过表位覆盖逃避机体免疫力[13]。故多种因素导致迄今尚无成功的SARS-CoV疫苗上市[14]。筛选S蛋白中的优势B细胞表位作为疫苗设计、免疫治疗和临床诊断的靶点,可避免全长S蛋白的局限性和副作用。
全基因组测序结果提示,SARS-CoV-2与SARSCoV S蛋白的氨基酸序列同源性有76.47%[3,15],说明两者在结构和功能有一定的相似度,如两者均利用高度糖基化的三聚体S蛋白进入宿主细胞;酶解后的S1亚单位结合到宿主细胞ACE2蛋白受体上,S2亚单位形成高度稳定的结构与宿主细胞膜融合[16-17]。相较于SARS-CoV,SARS-CoV-2最显著的变化是具有S1/S2蛋白酶切割位点“RRAR”氨基酸序列,而SARS-CoV中该酶切位点仅具单个精氨酸[18],且SARS-CoV-2与ACE2的亲和力远高于SARS-CoV[19]。进一步研究发现,尽管两病毒S刺突蛋白的受体结合区(receptor binding domain,RBD)结构高度相似,但针对SARS-CoV RBD的抗体对SARS-CoV-2并无明显的结合反应[19]。基于以上研究结果,笔者推测如同SARS-CoV,SARS-CoV-2 S蛋白全长作为疫苗研制靶点具有局限性,即可引起病理性免疫反应,虽然目前尚无研究证实这一点;同时SARS-CoV-2 S蛋白又具备独特的表位区,故S蛋白中B细胞表位的预测、筛选及鉴定显得尤为重要。根据B细胞表位的内在特征,先采用生物信息学分析预测,再合成相应多肽进行实验验证,不失为一种省时、省力、经济的方法。本研究联合使用Kyte-Doolittle的亲水性方案、Emini的蛋白质表面可能性方案、Jameson-Wolf的AI方案和吴玉章AI预测法,辅以跨膜区和二级结构分析,预测SARS-CoV-2 S蛋白的B细胞表位。推测其可能的优势B细胞表位主要集中于S蛋白的中间位置,如354~360、437~445、454~471、527~537、567~582、678~685、772~779和806~818位氨基酸或其附近。进一步分析,437~445和454~471位氨基酸位于SARS-CoV-2 S蛋白的RBD,若经实验证实这些表位的存在,则可以此为基础,开展SARSCoV-2预防性疫苗和药物的研究。上述几个区域仅仅是SARS-CoV-2 S蛋白中B细胞表位优势区段,并不包括所有的抗原表位,如73~84位氨基酸也有可能是B细胞表位。
本研究仅是对SARS-CoV-2 S蛋白候选B细胞表位进行初步筛选,但最终必须用实验结果来确认。

