新型冠状病毒肺炎的临床特征、CT表现与动态变化
叶晓雪,谢益兵,许崇永,徐慧,严志汉,方必东,杨超颖,陈梅魁,陈棋
(1.永嘉县人民医院 放射科,浙江 温州 325100;2.温州医科大学附属第二医院 放射科,浙江 温州325027)
新型冠状病毒属β属的新型冠状病毒,目前研究显示与蝙蝠SARS样冠状病毒同源性达85%以上[1]。新型冠状病毒存在人际传播,人群普遍易感,传播途径主要为飞沫及接触传播。病毒潜伏期一般3~7 d,亦可更长,潜伏期具有传染性,该病毒所致的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)目前仍没有特异治疗方法。本研究通过回顾性分析COVID-19的临床表现、实验室特点、CT表现与动态变化,旨在提高对本病的认识,尽快切断传播途径,做到早发现、早隔离、早诊断、早治疗。
1 资料和方法
1.1 一般资料 收集2020年1月20至2月10日永嘉县人民医院收治的COVID-19患者39例,其中轻型3例,普通型28例,重型8例。男22例,女17例,年龄22~87岁,中位年龄52岁。初诊39例患者中30例有发热,体温37.2~38.4 ℃,发热至就诊时间为7 h~5 d不等,其中1例在住院第4天体温升高至39.5 ℃,对症治疗后恢复正常,余38例在住院期间体温均在39 ℃以下。
1.2 方法 39例COVID-19患者均在首诊时行流行病学史调查,胸部CT及实验室检查。除8例患者在入院后治疗期间先后因重症转至上级医院治疗外,其余患者分别于入院后3 d、6 d、9~11 d进行胸部CT检查。CT检查使用西门子SIEMENS SOMATOM Emotion 16排螺旋CT机扫描,扫描参数:管电压130 kV,自动管电流,层厚5 mm,螺距1.0,1.25 mm薄层重建图像。扫描范围从胸廓入口到膈底。实验室检查包括血常规、肝酶、肌酶、C反应蛋白(C-reactive protein,CRP)、血清淀粉样蛋白酶A(serum amyloid proteinase A,SAA)、血气分析、新型冠状病毒核酸检测。
1.3 诊断依据及治疗方法 参照新型冠状病毒肺炎诊疗方案(试行第六版)[2]。
2 结果
2.1 流行病学史、临床资料、实验室检查 39例COVID-19患者经咽拭子新型冠状病毒核酸检测,33例第1次阳性,4例第2次阳性,2例第3次阳性。39例患者首诊时,5例外周血白细胞计数降低,最低值2.68×109/L,7例淋巴细胞计数降低,最低值为0.4×109/L,18例CRP升高,最高值85.26 mg/L,35例SAA升高,最高值275.5 mg/L,4例乳酸脱氢酶(lactate dehydrogenase,LDH)升高,最高值357 U/L。见表1。出院前复查时,实验室指标基本恢复正常。

表1 39例COVID-19患者首诊时的临床资料
2.2 CT表现 肺内病灶CT动态变化特征见表2。首诊CT:39例患者中,6例肺内未见病灶,33例肺内表现为纯磨玻璃(见图1)和(或)实变密度(见图2),其中20例表现为纯磨玻璃密度;病灶形态球形13例,斑片状18例,扇形2例,以胸膜下分布为主,其中1例球形病灶内见小叶间隔增厚,边缘见多发短细毛刺影,如“刺梨征” (见图1),其中3例多发球形病灶内见“反晕征” (见图3)。两肺受累24例,单肺受累9例(右肺4例,左肺5例),肺野内带均未见受累。1例肺部合并陈旧性结核患者显示两肺散在含气囊腔及纤维钙化灶并存,3例慢性支气管炎患者显示肺气肿、肺大泡,余患者均未见其他病灶,肺门、纵隔未见淋巴结肿大及胸腔积液征象。
入院3 d复查CT:其间2例重症患者转至上级医院治疗,37例患者复查CT,3例肺内未见病灶,26例示肺内病灶增多、范围扩大,不同肺叶出现新病灶,其中15例表现为两肺多发环带状、扇形、斑片图4),1例伴少量胸腔积液;4例病灶较初诊CT有所吸收改变,4例病灶较初诊CT相仿。状磨玻璃密度伴实变,内见支气管充气征(见图2),其中2例见局部轻度支气管扩张,新增病灶以胸膜下分布为主,由肺外周向中央浸润,呈“涂布征” (见
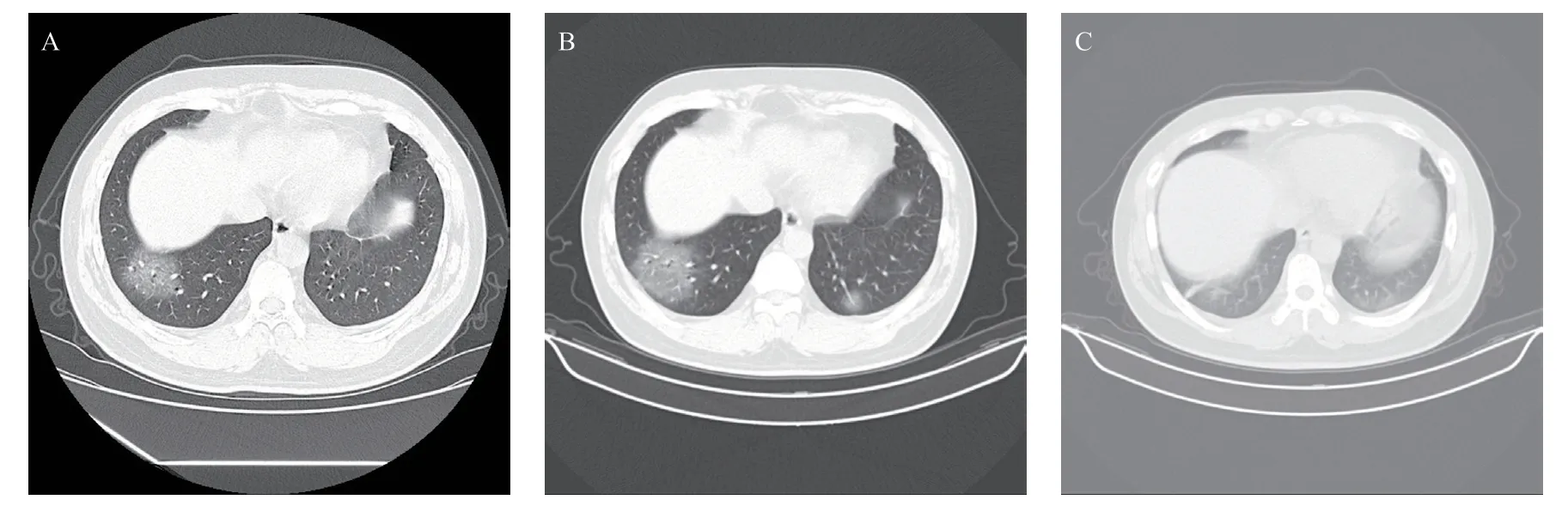
图1 武汉返乡,畏寒发热2 d,伴胸闷的30岁COVID-19男性患者CT图像
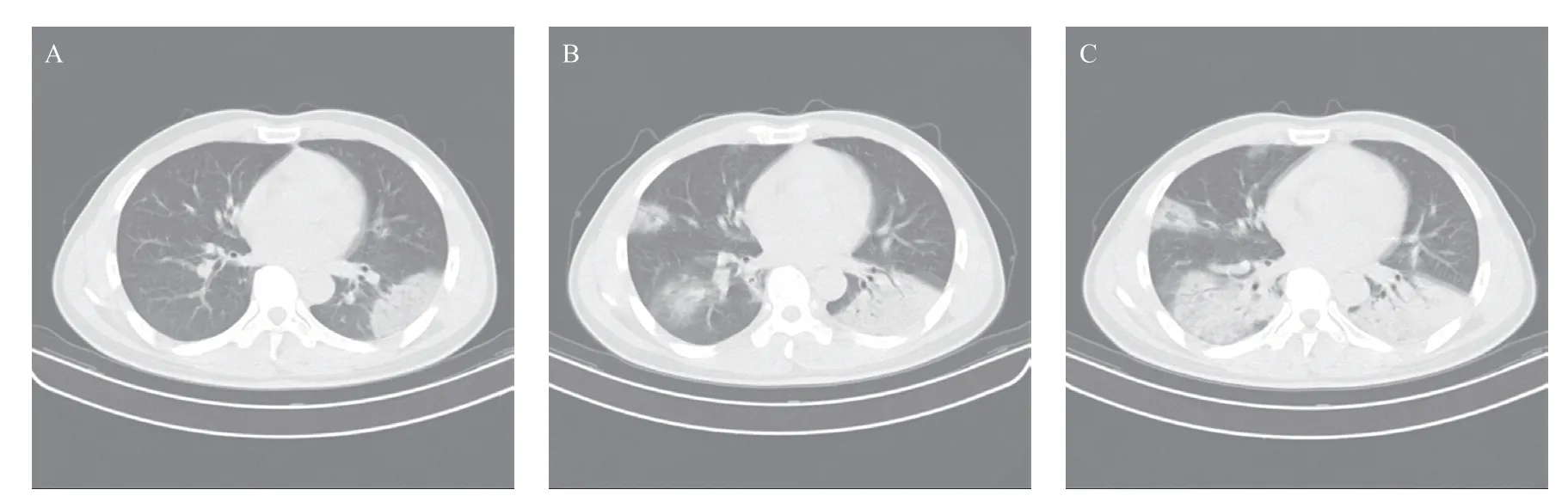
图2 有武汉返乡人员接触史,发热3 d,伴畏寒、流涕、腹泻的47岁COVID-19男性患者CT图像
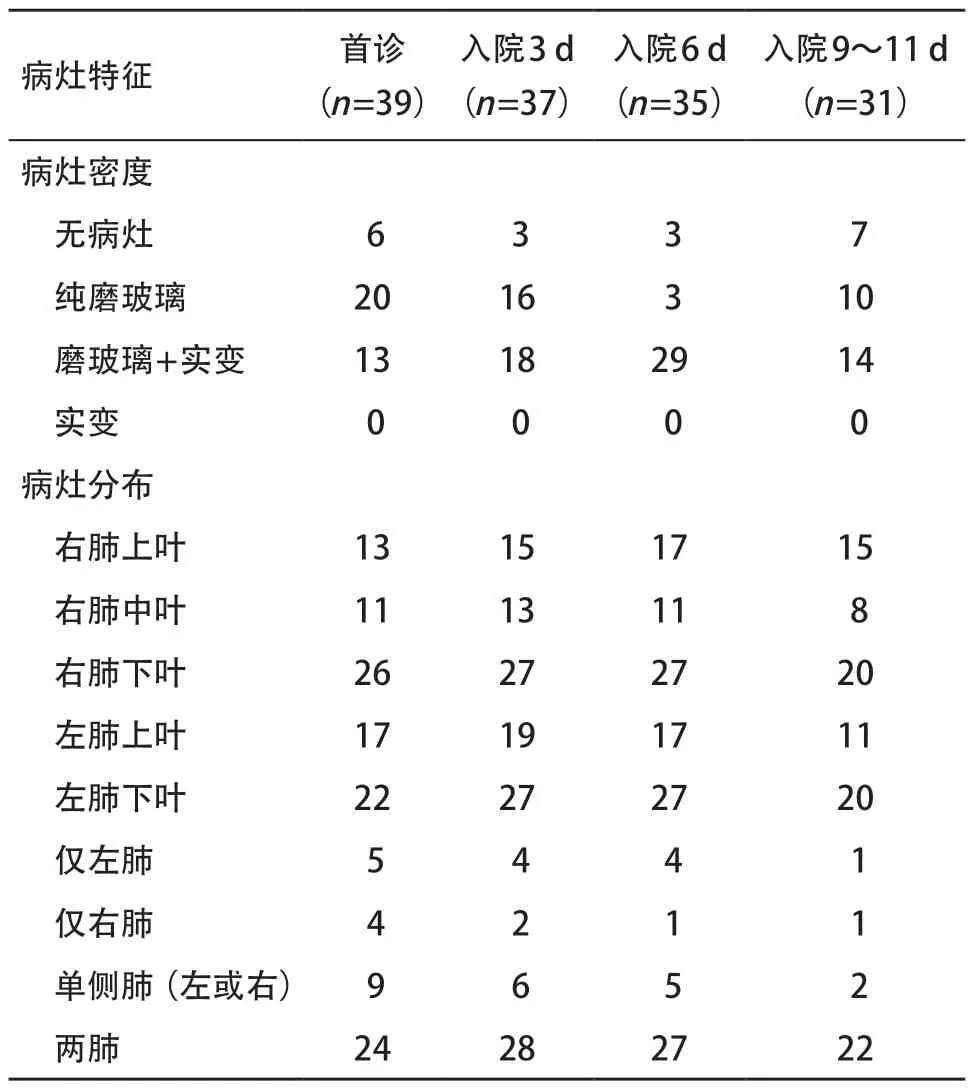
表2 39例COVID-19患者肺内病灶CT动态变化特征(例)
入院6 d复查CT:其间又有2例重症患者转至上级医院治疗,35例患者复查CT,3例肺内未见病灶,15例病灶继续进展,其中3例伴少量胸腔积液,3例进展明显,上肺磨玻璃病灶内见多发细网状影,呈“铺路石征” (见图4),下肺病灶呈蝠翼状磨玻璃伴实性密度影,呈“蝠翼征” (见图4),与相邻胸膜间以弧形透亮影。14例患者较入院3 d CT吸收减少,3例基本无变化。
入院9~11 d复查CT:其间4例COVID-19重症患者转至上级医院治疗外,余31例患者中,3例肺内未见病灶,4例患者病灶完全吸收,24例患者肺内病灶均吸收减少,吸收过程中实变影范围缩小,密度变淡,其中6例见胸膜下线影,3例残留纤维条索影。
3 讨论
COVID-19患者一般以发热、乏力、干咳为主要表现,少数伴有鼻塞、流涕、咽痛和腹泻等症状,重症患者表现为急性呼吸窘迫综合征,脓毒症休克,难以纠正的代谢性酸中毒和凝血功能障碍[3]。多数患者预后良好,少数病情危重,老年人和有慢性基础病者预后较差。本组39例患者中,3例为轻型,28例为普通型,在院期间生命体征稳定,发热程度与呼吸道症状多不成比率,包括1例患者体温升至39.5 ℃,给予对症治疗后恢复正常,除8例重型患者转诊至上级医院治疗,其余患者在院期间临床症状改善好转,但CT表现肺内病变吸收滞后。

图3 武汉返乡,发热4 d伴畏寒、胸闷的52岁COVID-19男性患者CT图像
COVID-19患者起病初期血白细胞计数一般正常或降低,淋巴细胞计数减少,部分患者可出现肝酶、LDH、肌酶和肌红蛋白增高;多数患者CRP和血沉升高[4]。本组除5例重症患者LDH、肌酶升高较明显,其余改变轻微或正常,笔者推断与本组患者多为普通型有关。另外,本研究中89.74%患者(35/39)SAA明显升高,46.15%(18/39)CRP升高,SAA是炎症发生时被高度诱导的急性期蛋白,呼吸道病毒感染者经常在感染后36~48 h出现临床症状,而SAA水平在病毒感染后上升时间早于CRP,且非常明显,一般在3~4 d达到峰值[5],在疾病恢复期SAA水平下降速度也较CRP更快。因此,笔者认为SAA可以作为新型冠状病毒感染和疗效监测的敏感指标。

图4 有武汉返乡人员接触史,发热、干咳4 d伴全身酸痛乏力、纳差的54岁COVID-19男性患者CT图像
COVID-19患者肺部病变CT表现有一定的特征性,常见两肺多发病灶,非对称性、非重力分布,主要分布于肺外带、胸膜下区,此分布特点较典型,与此区域肺小叶发育优势有关,血流和淋巴结构丰富,病变所致炎性反应更加明显;亦可单肺单发或多发病灶,早期多呈小斑片状、球形磨玻璃密度影,内可见增粗血管及小叶间隔增厚,球形病灶内可见“反晕征”,结节样病灶周围见晕征,部分球形病灶边缘见多发细短毛刺影,呈“刺梨征”。上述影像学表现的病理机制可能为新型冠状病毒侵入细支气管上皮细胞导致细支气管炎及其周围炎,进而引起肺泡壁细胞肿胀、炎性充血、微出血等[6];傅钢泽等[7]报道“反晕征”可能与病灶中央渗出,边缘带炎性修复有关。本组首诊CT示33例肺内病灶均表现为磨玻璃影,其中13例合并实变,表明病程尚处于早期阶段。24例为两肺多叶病灶,而9例为单肺病灶,病灶随机分布在各个肺叶,肺下叶较肺上叶略多,右肺较左肺略多,笔者认为可能下叶体积较上叶大,右肺体积较左肺稍大有关。随着病情进展,病灶分布由胸膜下向肺叶中心发展,呈现肺外周向中央浸润的趋势,呈“涂布样”改变,但很少累及肺门区,呈叶、段分布少见,主要表现为随机分布的环带状、扇形磨玻璃伴部分实变,实变区可位于磨玻璃影的边缘或中间,内见支气管充气征,可伴少许胸腔积液,此期可能为肺泡壁细胞肿胀、微出血的基础上,细胞因子风暴、渗液增多,可伴有部分机化或纤维增殖样改变;消散期肺内病灶吸收减少,实变影范围缩小,密度减低,胸膜旁病灶出现胸膜下线,部分残留索条影,常表现为肺内带病灶较外带吸收早,后出现的病灶先吸收,先出现的病灶后吸收,呈现出恢复期病灶与早期病灶表现相似的特点[8-10]。本组39例中,6例在首诊时肺内未见病灶,入院3 d复查其中3例CT出现病灶,26例肺内病灶均有不同程度的范围增大、密度增高、病灶增多,4例显示病灶吸收;入院6 d复查CT,尚有15例患者肺内病灶增多,14例显示病灶吸收减少,3例患者肺内病灶大致相仿。除8例重症外,余31例患者生命体征稳定,临床表现与肺部影像进展无明显相关性。COVID-19与以往已知的病毒性肺炎影像表现存在诸多的重叠性,如呼吸道合胞病毒、鼻病毒、腺病毒、SARS、人感染H7N9禽流感肺炎、流感病毒性肺炎等[11-13],需结合流行病学史及病原学检查进行鉴别。
COVID-19目前没有特异治疗方法,肺内病灶的进展与COVID-19的自然病程有关,对于生命体征稳定的轻型、普通型COVID-19患者,不必频繁复查CT,CT复查时间建议在首诊后6 d左右,用以对疗效的评价。按照最新诊疗指南,RT-PCR检查新型冠状病毒核酸阳性仍然是确诊的金标准[14-15],但检测周期长,结果存在假阴性。而COVID-19的CT表现具有一定特征性,影像结果可以作为“临床诊断病例”的判定依据,弥补病毒核酸检验的假阴性现象,以便早期隔离、早期干预,以防造成家庭聚集感染。

