完全腹腔镜下肝外Glisson鞘内解剖性肝切除术*
金 浩 刘会春 满忠然 王 勇 庞 青 胡小四 周 磊
(蚌埠医学院第一附属医院肝胆外科,蚌埠 233004)
自Reich等[1]报道首例腹腔镜肝切除以来,随着腹腔镜下各种器械的出现,手术技巧的提高,医疗团队协作的加强,腹腔镜下解剖性肝切除的报道逐渐增多[2]。腹腔镜解剖性肝切除早期开展较困难,学习曲线较长,出血、胆漏等并发症较多。我们在腹腔镜肝切除经验的基础上[3],2018年1月~2019年7月采用肝外Glisson鞘内解剖选择性阻断入肝血流技术完成完全腹腔镜下解剖性肝切除34例,操作相对简单,可直视下精准结扎肝动脉及门静脉,阻断预切除肝脏血流,现报道如下。
1 临床资料与方法
1.1 一般资料
本组34例,男23例,女11例。年龄32~76岁,(56.0±11.9)岁。①肝肿瘤29例:主诉上腹部疼痛不适12例,纳差消瘦1例,体检发现肝肿瘤16例。3例体检上腹部轻压痛,其余均无阳性体征。CT提示2个肝肿瘤2例,其中1例肿瘤直径4 cm及1 cm局限于右半肝(行右半肝切除),1例直径3 cm及1 cm局限于左半肝(行左半肝切除);其余均为1个病灶,肿瘤直径2.7~11 cm,(6.29±2.30)cm,位于右后叶3例(行右后叶切除),超出右后叶局限于右肝11例(行右半肝切除),左外叶6例(行左肝外侧叶切除),侵及左肝S2、S3、S4段7例(行左半肝切除)。甲胎蛋白升高9例(23.75~2000 ng/ml),CA19-9升高2例(分别为44.15和272.50 ng/ml)。术前考虑为肝血管瘤6例,均每半年复查1次,至少复查3次,肿瘤增长趋势明显,选择手术切除,其中3例肿瘤位于左肝外侧叶且突出于肝脏表面,直径分别为8、8、9 cm,行左肝外侧叶切除,2例肿瘤位于右肝累及S5、S6、S7、S8段,直径分别为12、13 cm,行右半肝切除,1例瘤体位于S2、S3、S4交界,直径11 cm,行左半肝切除;1例术前诊断右肝巨大肿瘤,排除血管瘤,不能排除恶性肿瘤诊断,累及S5、S6、S7、S8段,直径10 cm,行右半肝切除,术后病理证实为肝细胞局灶性增生;其余22例术前考虑肝脏恶性肿瘤。②肝内外胆管结石5例:主诉发热1例,腹部隐痛不适3例,上腹部饱胀1例。均无阳性体征。CT及MRCP提示肝左外叶胆管、胆总管结石1例,肝左叶胆管、胆总管结石伴左肝萎缩4例。胆红素轻度升高1例(9.9 μmol/L)。34例肝功能Child分级均为A级,吲哚氰绿15分钟潴留率(ICG15)<10%。
纳入标准:肝脏肿瘤术前影像学检查提示肿瘤可以完整切除,无明显胆管及血管变异,肝功能Child分级A、B级,ICG15<10%;结石病人术前MRCP显示结石局限于左外叶或左肝管内,左右肝内三级胆管不同时存在结石。
排除标准:80岁以上高龄患者,有心肺功能障碍无法耐受气腹,肝恶性肿瘤有远处转移。
1.2 手术方法
1.2.1 肝肿瘤右半肝手术方法(12例) 全麻,大字体位,右季肋区抬高30°。10 mm观察孔位于平脐孔上缘中线右侧约2 cm处,12 mm主操作孔位于右锁骨中线肋缘下约2 cm,右腋前线肋缘下置入5 mm trocar,剑突下偏左侧置入10 mm trocar,脐与剑突中点置入5 mm trocar作为辅操作孔。扶镜手站于患者两腿之间,术者及助手站于患者两侧。常规切除胆囊,于胆总管右侧解剖Glisson鞘,沿胆囊动脉解剖出右肝动脉予以结扎后切断(图1)。右肝动脉深面头侧为右肝管,可不予解剖;尾侧为门静脉右支,解剖周围结缔及淋巴组织,完整分离出门静脉右支,门静脉分离过程中注意勿损伤门短静脉,可先予以结扎(图2)。观察肝脏出现明显Demarcation线(图3)。超声刀切断肝圆韧带、镰状韧带、右侧冠状韧带、右侧三角韧带、肝肾韧带,肝裸区不强求游离。为避免对肿瘤挤压,可采用前入路直接离断肝实质。断肝采用超声刀,采用“小口慢咬”、“小步慢走”的方法,超声刀每次不能钳夹过多肝组织,边钳夹边烧灼,逐步断肝。小的静脉属支超声刀直接离断,大的属支超声刀振荡血管周围肝组织,血管裸化后血管夹夹闭离断。断肝过程中应用低中心静脉压技术,右肝蒂及右肝静脉(图4)均用血管闭合器离断。
1.2.2 肝肿瘤左半肝手术方法(8例) 全麻,大字体位。10 mm观察孔位于脐下,12 mm主操作孔位于右侧腹直肌外侧缘脐上约3 cm,右锁骨中线肋缘下约2 cm置入5 mm trocar,左侧腹直肌外侧缘脐上约3 cm置入10 mm trocar,左侧腋前线肋缘下约2 cm置入10 mm trocar作为辅助孔。医生站位同右半肝手术。先离断肝胃韧带,打开小网膜囊,沿肝下缘自肝十二指肠韧带左侧开始解剖Glisson鞘。解剖出的第一支动脉一般为供血左肝外叶动脉(图5),予以结扎离断。继续向右侧分离,可分离出供血S4段肝动脉(图6),予以结扎离断。也有病例在肝外只能分离出1支肝动脉。动脉离断后,其深面可解剖出门静脉左支,予以结扎(图7)。肝脏出现明显Demarcation线。超声刀切断肝圆韧带、镰状韧带、左侧冠状韧带、左侧三角韧带,左肝完全游离。肝脏实质离断、左肝蒂及左肝静脉处理方法同右半肝手术。
1.2.3 肝肿瘤右后叶手术方法(3例) 肝外解剖Glisson鞘,分别解剖出右后叶肝动脉及门静脉右后支,右肝动脉向远心端继续分离出右前叶及右后叶肝动脉,结扎切断右后肝动脉(图8)。沿门静脉右支向Rouviere沟内分离,可分离出门静脉右后支(图9),予以结扎,肝脏右前与右后叶之间可见明显缺血线。其他操作同右半肝手术。

图1 解剖右肝动脉 图2 结扎门静脉右支 图3 Demarcation线 图4 处理右肝静脉 图5 左肝外叶动脉 图6 S4段肝动脉 图7 门静脉左支 图8 右后叶肝动脉 图9 门静脉右后支
1.2.4 肝肿瘤左肝外侧叶手术方法(6例) 沿肝下缘自肝十二指肠韧带左侧开始解剖Glisson鞘。解剖出的第一支动脉一般为供血左肝外叶动脉,予以结扎离断。沿门静脉左支向左侧继续分离,于肝圆韧带入肝处左侧结扎门静脉。其他操作同左半肝手术。
1.2.5 肝内胆管结石手术方法(5例) 本组肝内胆管结石行左半肝切除4例,左肝外侧叶切除1例,手术方法不同于前述在于:不应用腹腔镜切割闭合器同时离断肝蒂,肝动脉和门静脉分别离断后,胆管残端敞开,同时胆总管切开,胆道镜自胆管残端和胆总管切口分别探查,胆管残端予以缝合,如考虑可能有结石残留,胆总管内放置T管引流,术后6周经T管窦道行胆道镜检查取石。
1.3 随访
恶性肿瘤前2个月均住院随访,行彩超及CT检查,第1个月加肝动脉血管造影检查,第2次随访根据检查情况决定是否行肝动脉栓塞化疗,此后延长至2个月后随访;良性肿瘤采用彩超及CT随访,第一次于术后3个月随访,以后每6个月随访;结石术后2周行彩超及T管造影检查,必要时术后6周行胆道镜检查。
2 结果
本组34例均在腔镜下完成肝外Glisson鞘内解剖,肝脏游离,肝实质离断,行右半肝切除12例,左半肝切除12例,右后叶切除3例,左肝外侧叶切除7例,无中转开腹。不同术式的手术指标见表1。手术时间1.5~3.5(2.7±0.6)h,术中出血量100~800(414.7±194.0)ml,9例(26.5%)输血。不留置胃管,术后肛门排气时间2~4(3.3±0.6)d,术后住院时间4~18(8.2±3.4)d。并发症3例:腹水2例,均为肝硬化患者,腹水最大量每天约500 ml,生化常规提示低白蛋白,考虑肝硬化伴低白蛋白导致腹水,给予保肝、营养支持、补充白蛋白、利尿后治愈;肺部感染1例,给予抗感染、雾化吸入辅助排痰治愈。术后病理:肝细胞肝癌20例,肝腺癌2例,肝血管瘤6例,肝细胞局灶性增生1例,肝内胆管结石5例。肝癌巴塞罗那分期0期19例,A期3例。肝癌患者均在术后1个月补充化疗栓塞。肝内胆管结石患者均在术后2周行夹管试验,术后4周行T管造影,其中2例术后6周行胆道镜取石。34例随访1~18个月,平均8.8月,无肿瘤及结石复发。
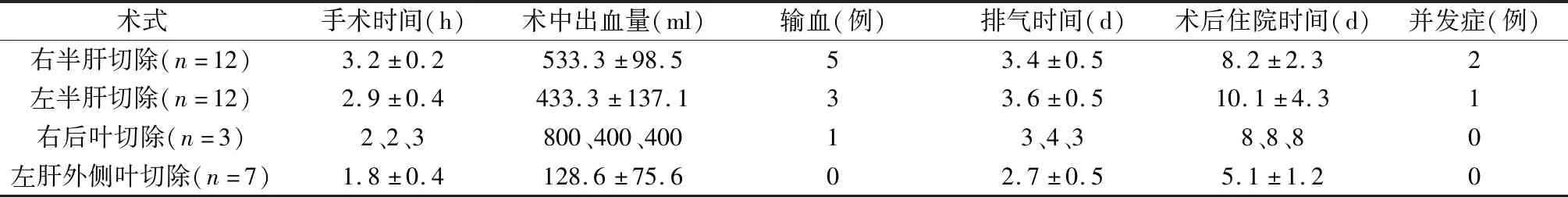
表1 不同术式的手术指标
3 讨论
国内腹腔镜肝切除发展日新月异[4],早期腹腔镜肝切除主要用于肝脏质地较好的良性疾病或转移性肿瘤,控制出血的肝门阻断多采用简单的Pringle法,优点在于简单有效,对于肝硬化患者也可应用[5],但是入肝血流完全阻断,可导致保留肝脏发生缺血再灌注损伤,也可导致胃肠道血流淤滞及内毒素移位,对伴有基础肝病者可加重残肝损害,进而导致术后肝功能恢复延迟甚至肝衰竭。因此,随着腹腔镜肝切除应用范围的扩大,应用区域性肝血流阻断技术的解剖性肝切除应运而生[6]。国内外已有关于腹腔镜下解剖性肝切除的报道[7~9]。腹腔镜解剖性肝切除的优势在于:①减少术中出血。解剖性肝切除优先处理预切除肝脏入肝血流,有利于切肝过程中出血控制,且根据缺血线切肝,有助寻找正常的解剖层面,减少出血[10]。②术后出血及胆漏较少。解剖性肝切除以独立的肝叶或肝段为切除单位,不影响保留肝组织的功能,加之腹腔镜的放大效应,术中容易发现细小的出血及胆漏,故术后并发症发生率降低。③解剖性肝切除切除了肿瘤所在的肝叶及肝段,弥补腔镜下不能触摸的劣势,Kang等[11]报道解剖性肝切除的无瘤生存率高于非解剖性肝切除。
我们在腹腔镜肝切除的基础上开展解剖性肝切除,首先考虑的问题是采用什么入肝血流阻断方法。入肝血流阻断方法有三种:①肝外Glisson鞘内阻断,在肝外将Glisson鞘剖开,将肝动脉及门静脉逐支分离出来,结扎拟切除肝脏的动脉及门静脉;②肝外Glisson鞘外阻断,肝外降低肝门板,紧贴Glisson鞘分离出拟切除肝脏的肝蒂,一并结扎;③肝内Glisson鞘外阻断,切开肝实质,在肝创面上分离出Glisson鞘[12]。我们采用第一种方法,原因在于:①分离右肝蒂时,在胆总管右侧,沿胆囊动脉走行,容易分离出右肝动脉,不易损伤肝总动脉。右肝动脉深面即门静脉右支,沿门静脉右支向肝内分离,可清楚分离出门静脉右前及右后支,门静脉周围组织清楚,在直视下完整游离门静脉壁,避免损伤静脉壁导致大出血。李晓平等[13]的解剖学研究表明,右肝动脉及门静脉右支在肝外有一段走行距离分别为(3.17±1.07)cm和(1.57±0.05)cm,也为这种方法提供了解剖学基础,此处分离可远离肝总动脉及门静脉主干,避免损伤。②左肝蒂分离的关键点在于一定沿肝下缘自左向右逐层打开Glisson鞘,肝胃韧带离断后,肝十二指肠韧带左侧小网膜囊敞开,分离空间较大,沿肝下缘自左向右逐层打开Glisson鞘,首先遇到的一定是进入左肝的肝动脉及门静脉,此处远离主干,损伤的机会较小。③如果采用肝外Glisson鞘外阻断,必须降低肝门,准确找到肝实质Laennec膜与Glisson鞘之间的间隙,以免导致肝实质出血或胆管损伤,对于术者的要求高,不适合早期开展解剖性肝切除的医生应用。④对于胆管有变异者,鞘内准确分离入肝血管,有利于避免胆管损伤。本组无术中门静脉壁损伤导致出血,无肝门胆管损伤,术后无出血,无胆漏。我们认为肝外Glisson鞘内阻断安全、有效,适合刚开展腹腔镜解剖性肝切除的医师应用。
入肝血管妥善处理后,优先处理肝短静脉是腹腔镜右半肝及右后叶切除成功的关键,腹腔镜具有良好的视野,处理肝短静脉优于开放手术[14],术中仔细分离,确保完整分离出肝短静脉,切忌撕扯导致静脉壁损伤出血。肝短静脉近端采用结扎加血管夹夹闭,如右后下静脉较粗大,可采用Prolene线缝扎处理。右肝静脉及左肝静脉不强求分离出来,可在肝实质离断后,应用血管闭合器连同周围少部分实质一并离断。
我们采用超声刀离断肝实质,因入肝血流均已阻断,故断肝过程中的出血由静脉属支损伤导致,尤其是肝中静脉属支出血。术中低中心静脉压可有效减少静脉出血[15]。Kabayashi等[16]提出低气道压也可控制静脉出血。我们通常通过控制输液速度,控制动脉收缩压,必要时静脉应用硝酸甘油将中心静脉压控制在0~5 cm H2O[17]。超声刀断肝,灵活应用超声刀切、凝、分离、振荡作用,要求每次不能钳夹过多肝组织,“小步慢走”,“小口慢咬”,边钳夹边释放超声刀能量,3 mm以下的静脉属支可直接凝闭,较大分支利用“振荡”功能将血管周围的肝组织破碎,裸化血管后夹闭。如遇意外出血,应用Prolene线缝扎止血。
腹腔镜解剖性肝切除已逐步成为常规术式,其开展需要术者具有熟练的腹腔镜操作技能,手术团队稳定,术中良好的麻醉配合。术前充分评估肝功能和各种影像学资料,了解可能存在的解剖变异,术中精细分离,精准处理各种管道,可保证手术安全。

