血清嗜酸性粒细胞阳离子蛋白、嗜酸性粒细胞、免疫球蛋白E及MP-IgM检测在肺炎患者病情监测中的应用分析
张 浩,卢 滨,贾金广
(郑州人民医院呼吸科,河南 郑州 450000)
肺炎发生主要是由于病原微生物通过呼吸道进入肺部,引起感染性肺实质炎症,患者群涉及婴幼儿、青年以及老年,是呼吸内科较为多见的病症之一[1]。患者常常表现咳嗽、咳痰、发热等症状,老年患者一旦感染,极易发展为重症肺炎,是导致老年患者死亡的一种危重病症[2]。社区获得性肺炎是指在医院外罹患的感染性肺实质炎症,具有高死亡率、发病率,发病机制尚不明确[3]。近年来,随着抗菌药物的泛滥使用,致病菌耐药率增加,肺炎临床治疗效果显著下降,同时加重了患者经济负担[4]。传统的细胞学、病原学检查灵敏性、特异性较差,给肺炎患者诊断以及病情监测带来困难[5]。报道发现,血清嗜酸性粒细胞阳离子蛋白(ECP)、嗜酸性粒细胞(EOS)、免疫球蛋白E(IgE)及肺炎支原体抗体(MP-IgM)参与了感染性肺炎的发生、发展,可作为肺炎诊断或辅助诊断的鉴定指标[6,7]。本研究通过检测肺炎患者血清ECP、EOS、IgE及MP-IgM水平,分析ECP、EOS、IgE及MP-IgM水平与患者病情严重程度、疾病结局的关系,旨在为肺炎患者病情监测及预后评估提供理论根据。
1 资料与方法
1.1 一般资料2016年3月至2018年3月我院收治的88例社区获得性肺炎患者。纳入标准:符合有关社区获得性肺炎诊断标准[8],影像学、病原学确诊为肺炎。排除标准:①合并心、肝、脾、肾等脏器严重病变者;②既往肺炎病史;③肺部肿瘤患者。采用CURB-65评分标准按病情严重程度分为轻症组25例、中症组30例与重症组33例,性别(男/女)分别为16/9例、18/12例和20/13例,年龄分别为(52.41±9.62)岁、(51.97±9.50)岁和(53.06±9.71)岁,选择同期我院体检健康成人30例为健康组,男17例,女13例,年龄[(52.68±9.67)岁],各组基线资料比较,差异均无统计学意义(P> 0.05)。所有肺炎患者入院后治疗观察30 d,按疾病结局分为生存组(70例)与死亡组(18例)。所有研究对象知情同意,通过我院医学伦理委员会审批。
1.2 方法抽取所有研究对象空腹静脉血,分别测量其血清ECP、EOS、IgE及MP-IgM水平,ECP、IgE、MP-IgM检测使用购自南京森贝伽生物科技有限公司的ELISA试剂盒,EOS检测使用全自动血细胞分析仪。
1.3 观察指标①比较研究组与健康组血清ECP、EOS、IgE及MP-IgM水平;②比较轻症组、中症组与重症组血清ECP、EOS、IgE及MP-IgM水平;③比较生存组与死亡组血清ECP、EOS、IgE及MP-IgM水平;④分析血清ECP、EOS、IgE及MP-IgM与肺炎患者病情严重程度、疾病结局的相关性;⑤通过ROC曲线计算曲线下面积(AUC)、临界值以及灵敏度、特异度,评价血清ECP、EOS、IgE联合检测对肺炎患者病情监测的价值。
1.4 统计学方法使用SPSS 19.0软件处理数据,计数资料比较采用χ2检验;计量资料比较采用t检验或单因素方差分析及SNK-q检验;相关性采用Pearson相关性分析;诊断价值分析采用ROC曲线。P< 0.05为差异有统计学意义。
2 结果
2.1 研究组与健康组患者血清ECP、EOS、IgE及MP-IgM比较研究组血清ECP、EOS、IgE水平高于健康组,MP-IgM例数多于健康组(P< 0.05),见表1。
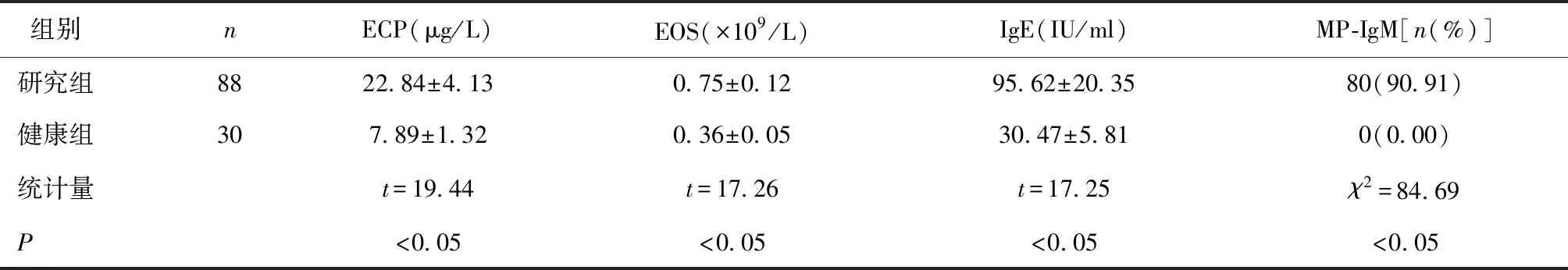
表1 研究组与健康组患者血清ECP、EOS、IgE及MP-IgM比较
2.2 轻症组、中症组与重症组患者血清ECP、EOS、IgE及MP-IgM比较轻症组、中症组与重症组血清ECP、EOS、IgE水平依次升高(P< 0.05),MP-IgM例数比较,差异无统计学意义(P> 0.05),见表2。

表2 轻症组、中症组与重症组患者血清ECP、EOS、IgE及MP-IgM比较
2.3 生存组与死亡组患者血清ECP、EOS、IgE及MP-IgM比较生存组血清ECP、EOS、IgE水平高于死亡组,MP-IgM例数多于死亡组(P< 0.05),见表3。
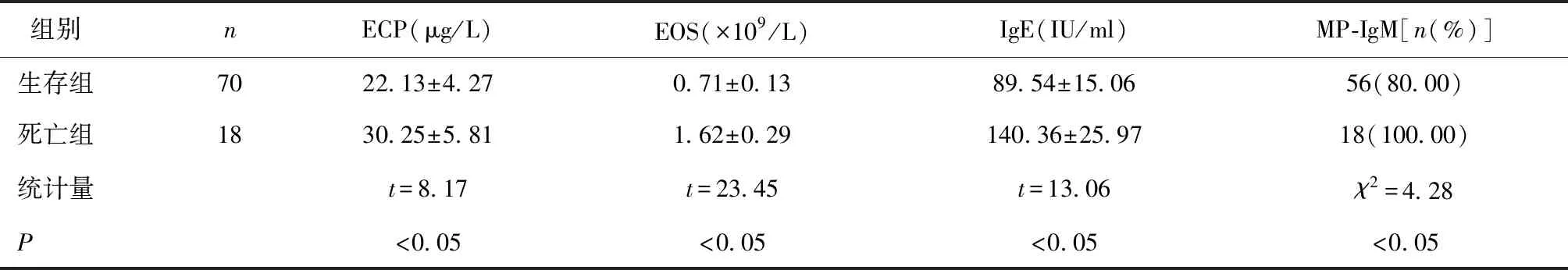
表3 生存组与死亡组患者血清ECP、EOS、IgE及MP-IgM比较
2.4 相关性分析血清ECP、EOS、IgE及MP-IgM与肺炎患者病情严重程度、疾病结局呈正相关(P< 0.05),见表4。

表4 相关性分析
2.5 血清ECP、EOS、IgE及MP-IgM联合检测对肺炎患者病情监测价值ROC曲线分析显示,血清ECP水平AUC为0.675,95%CI为0.538~0.812,取临界值26.50时,血清ECP诊断肺炎的灵敏度为55.60%,特异度为78.60%;血清EOS水平AUC为0.851,95% CI为0.761~0.942,取临界值1.02×109时,血清EOS诊断肺炎的灵敏度为72.20%,特异度为91.40%;血清IgE水平AUC为0.735,95% CI为0.576~0.893,取临界值121.08时,血清IgE诊断肺炎的灵敏度为66.70%,特异度为90.00%,血清MP-IgM水平AUC为0.906,95% CI为0.843~0.968,取临界值729.97 KU/L时,血清MP-IgM诊断肺炎的灵敏度为94.40%,特异度为77.10%,ECP、EOS、IgE及MP-IgM联合检测的AUC为0.967,灵敏度为88.9%,特异性为91.40%,优于各指标单独检测(P< 0.05)。见图1。
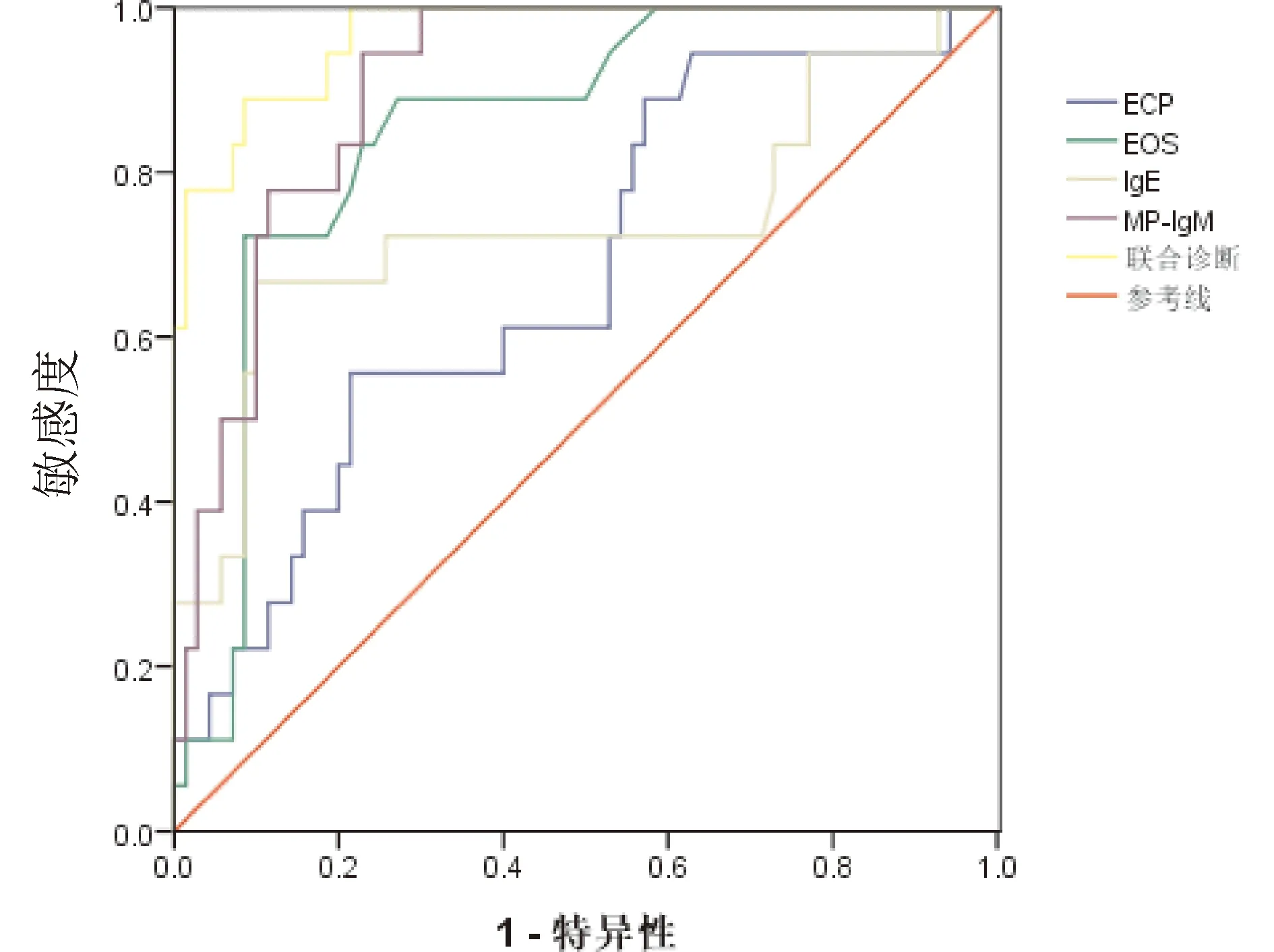
图1 血清ECP、EOS、IgE及MP-IgM联合检测监测肺炎病情的ROC曲线
3 讨论
社区获得性肺炎是临床上最为多见的呼吸系统感染性疾病,早期抗菌药物治疗可缩短患者住院时间,降低患者病死率,但仍有部分患者治疗无效,发展成为难治性肺炎,给家庭以及社会造成巨大的经济压力[9]。该病病死率升高与年龄增加有关,随着我国人口趋于老龄化,社区获得性肺炎已严重威胁人类健康[10]。此外,社区获得性肺炎病死率还与患者病情严重程度紧密相关,入住ICU的重症社区获得性肺炎患者30 d病死率可达23%~47%[11]。因此,对于社区获得性肺炎的早期诊断以及积极进行病情监测具有重要的意义,有助于临床治疗选择敏感的抗菌药物,降低患者死亡风险。传统的生物标志物如中性粒细胞百分比、降钙素原、白细胞介素等因敏感性、特异性不甚理想或检测方法受限,不利于社区获得性肺炎患者病情诊断、评估以及预后判断,临床需探究更加简单易测、敏感可靠的生物标志物[12]。
ECP是一种由EOS分泌释放的细胞毒性蛋白,可导致患者呼吸系统上皮损伤,诱导肥大细胞释放组胺,进而引起气道高反应,其表达水平在肺炎、哮喘、支气管炎等多种疾病患者血清中显著升高[13]。EOS来源于骨髓的造血干细胞,可分泌释放活性氧介质、颗粒介质以及脂质介质等内容物,促进炎症进展。IgE与Ⅰ型变态反应有关,是反映人体过敏的免疫球蛋白,可活化嗜碱性粒细胞以及肥大细胞,进而促进炎症因子分泌释放。MP-IgM指的是机体被支原体感染后,由B细胞特异性识别并合成释放的一类具有免疫功能的球蛋白,是肺炎支原体感染的早期指标,但IgM半衰期较短,影响因素较多,仅可作为肺炎诊断的辅助指标[7]。本文研究结果显示,研究组血清ECP、EOS、IgE水平显著高于健康组,MP-IgM例数显著多于健康组,表明血清ECP、EOS、IgE及MP-IgM在肺炎患者体内异常升高,其有可能作为预测社区获得性肺炎的诊断指标。本文研究结果还显示,轻症组、中症组与重症组血清ECP、EOS、IgE水平依次显著升高,MP-IgM例数依次增多,生存组血清ECP、EOS、IgE水平显著高于死亡组,MP-IgM例数显著多于死亡组,表明血清ECP、EOS、IgE及MP-IgM水平可能与患者病情严重程度及疾病结局有关。相关性分析结果显示,血清ECP、EOS、IgE及MP-IgM与肺炎患者病情严重程度、疾病结局呈正相关。进一步ROC曲线分析结果显示,血清ECP、EOS、IgE及MP-IgM水平AUC分别为0.675、0.851、0.735、0.906,灵敏度分别为55.60%、72.20%、66.70%、94.40%,特异度分别为78.60%、91.40%、90.00%、77.10%,三者联合检测的AUC为0.967、灵敏度为88.90%、特异性为91.40%,优于各指标单独检测,表明血清ECP、EOS、IgE及MP-IgM联合检测对诊断社区获得性肺炎有较高的诊断价值。杜阿妮等[14]报道表明,血清ECP、IgE和外周血EOS联合检测可有效鉴别诊断CVA与哮喘,与本文研究结论具有一致性。
综上所述,肺炎患者血清ECP、EOS、IgE及MP-IgM水平较高,其表达水平与患者病情严重程度、疾病结局呈正相关,对血清ECP、EOS、IgE及MP-IgM进行联合检测有助于监测肺炎患者病情,对肺炎患者预后评估有一定的参考价值。

