碱液浸取土壤中氰化物的动力学特性
杨宗政,杨婷婷,曹晓乐,曹井国,邱 沙,陈志国
(1.天津科技大学化工与材料学院,天津 300457;2.天津华北地质勘查局天津华堪环保科技有限公司,天津 300170)
众所周知,氰化物(如氢氰酸、氰化钾等)具有很强的毒性.它们可通过多种途径进入人体,使人的中枢神经系统瘫痪进而引发呼吸困难,甚至会导致死亡[1].氰化物具有良好的络合性能、表面活性和活化性能,使其在染料涂料、黄金冶炼、金属加工、电镀、有机化工等行业得到了广泛应用,同时也带来了严重的环境污染问题[2].氰化物在土壤中的降解速率远远低于在水体中的降解速率,尤其是在干旱的环境下,土壤中的氰化物会高度富集[3],这对地表环境、土地利用和地面水、地下水具有严重的危害.因此,氰化物污染治理刻不容缓.
目前,氰化物污染土壤的治理方法主要有植物法、生物法、焚烧法、化学氧化法和淋洗技术等.植物法和生物法因具有环境友好的特点而在近年来备受关注,但都存在环境适应性差以及处理周期长等缺点,且目前仍处于实验室研究阶段,无法实现大规模、工业化的应用[4-9].焚烧法虽具有处理效率高的优点,但其反应温度高,能耗大.化学氧化方法是一种应用较为广泛的方法,但在处理过程中因大量使用氧化剂,不仅提高了处理费用,而且会破坏土壤的理化性质,产生二次污染[10-11].淋洗技术采用物理方式将土壤中的污染物溶解或迁移至淋洗液中,再对淋洗液中的污染物进行处理,淋洗液不会破坏土壤结构,且处理后可循环利用,具有适用范围广、见效快、处理容量大、效果显著、处理成本低等特点[12-13].邱沙等[14-15]提出用异位筑堆淋洗-废水解毒工艺处理氰化物污染土壤,采用pH 为10~11 的石灰水对污染土壤进行淋洗,采用碱性氯氧化法处理淋洗液中的氰化物,实验结果表明处理后的土壤和淋洗液均满足排放标准,表明这种工艺对处理氰化物污染土壤具有实际应用的可行性,但对氰化物的结合位点、动力学过程、传质速率等缺乏研究,需从动力学及传质机理上研究污染土壤中氰化物的去除.
土壤中氰化物的浸取效率通常与浸取条件、扩散速率等息息相关,因此研究浸取过程的动力学对提高氰化物浸取效率具有重要意义.因氰化物具有较大的溶解度(20 ℃氰化钠在水中的溶解度为37 g),且在酸性条件下易形成HCN 气体,存在安全隐患,故本文以碱性溶液作为淋洗液,研究碱液浸取污染土壤中氰化物的过程,考察固液比、搅拌强度、浸取温度和土壤粒径对氰化物浸取的影响,为含氰土壤的治理提供科学方法和理论依据.
1 材料与方法
1.1 氰化物污染土壤及试样
实验所用土样取自天津某氰化物污染场地,采用离子色谱法对其中氰化物含量进行多次测定,测得的氰化物含量在5.44~18.3 mg/kg,分布不均匀,平均含量为13.8 mg/kg.污染土壤的含水率为3.04%,密度为 2.24 g/cm3,容重为 1.0 g/cm3,总孔隙度为56.27%,比表面积为43.92 m2/g;污染土壤由0.55%黏粒、83.08%粉粒和16.37%砂粒组成.
污染土壤经标准筛筛分为0.5 mm<r0≤1 mm、1 mm <r0≤2 mm、2 mm <r0≤3 mm 和 3 mm <r0≤5 mm 4 种粒径,为实验提供不同粒径的土样.
1.2 实验方法
用氢氧化钠溶液调节去离子水,调成pH=10.5的碱液,即碱液中OH-浓度为3.16×10-4mol/L,按照一定的固液比(质量比)称取土样和碱液,放入三角瓶;将装有土样的三角瓶置于已设定好转速和温度的恒温振荡器中,并设定浸取时间;浸取完成后用抽滤装置快速分离土样与碱液,采用离子色谱法检测碱液中氰化物的含量,根据式(1)计算氰化物浸取分数,每组实验重复3 次.

式中:mt为时间为t 时浸取出的氰化物总质量,mg;m 为原污染土壤中氰化物总质量,mg;α 为浸取分数.
1.2.1 固液比对氰化物浸取效果的影响
按照固液比(质量比)分别为1∶10、1∶20 和1∶30 称取 0.5 mm<r0≤1 mm 土样和碱液,在20 ℃、150 r/min 的条件下浸取10 h,检测浸出液中氰化物的含量,计算浸取分数.
1.2.2 搅拌强度对氰化物浸取效果的影响
以固液比为1∶10 称取0.5 mm<r0≤1 mm 粒径土样和碱液,搅拌强度分别设置为100、150、200、300 r/min,在20 ℃下浸取10 h 后检测浸出液中氰化物的含量,计算浸取分数.
1.2.3 温度对氰化物浸取效果的影响
以固液比为1∶10 称取0.5 mm<r0≤1 mm 土样和碱液,浸取温度分别设置为20、30、50、60 ℃,在200 r/min 下分别浸取1、2、4、6、8 h,检测浸出液中氰化物的含量,计算浸取分数.
1.2.4 粒径对氰化物浸取效果的影响
以固液比为1∶10 分别称取粒径为0.5 mm<r0≤1 mm、1 mm<r0≤2 mm、2 mm<r0≤3 mm、3 mm<r0≤5 mm 的土样和碱液,在20 ℃、200 r/min条件下浸取1、2、4、6、8 h,检测浸出液中氰化物的含量,计算浸取分数.
1.3 分析检测方法
1.3.1 土壤/水中氰化物浓度
土壤/水中氰化物检测方法为离子色谱法[16],首先通过蒸馏手段将土壤/水中的氰化物全部收集于NaOH 溶液中,以CH3COONa 与NaOH 混合溶液(CH3COONa 的浓度为30 mmol/L、NaOH 的浓度为80 mmol/L)作为淋洗液,检测溶液中氰化物的浓度.
1.3.2 污染土壤基本性质
将采集的土样混合均匀,避光风干,除去杂质,研磨后过孔径2 mm 的标准筛,用于污染土壤基本性质的测定.其中土壤含水率按照HJ 613—2011《土壤·干物质和水分的测定·质量法》方法测定;采用密度瓶法测定土壤密度,环刀法测定容重,总孔隙度按照总孔隙度=(1-容重/密度)×100%计算[17];比表面积采用亚甲基蓝吸附法进行测定[18];使用MS2000 型马尔文激光粒度仪测定土壤粒径分布[19].
1.4 浸取过程及数学模型
污染土壤颗粒可以看作是球形颗粒,其浸取过程可用“收缩未反应芯模型”来描述[20].整个浸取过程(图1)分为以下步骤:(1)浸取剂通过扩散层向土壤颗粒表面扩散,通过围绕土壤颗粒表面的液固界面膜到达土壤颗粒表面(外扩散);(2)到达土壤颗粒表面的浸取剂进一步扩散至颗粒内部(内扩散);(3)颗粒内部的氰化物溶解于浸取剂中;(4)溶解于浸取剂中的氰根离子向颗粒表面扩散(内扩散);(5)溶解于浸取剂中的氰根离子从土壤颗粒表面扩散到溶液中(外扩散).
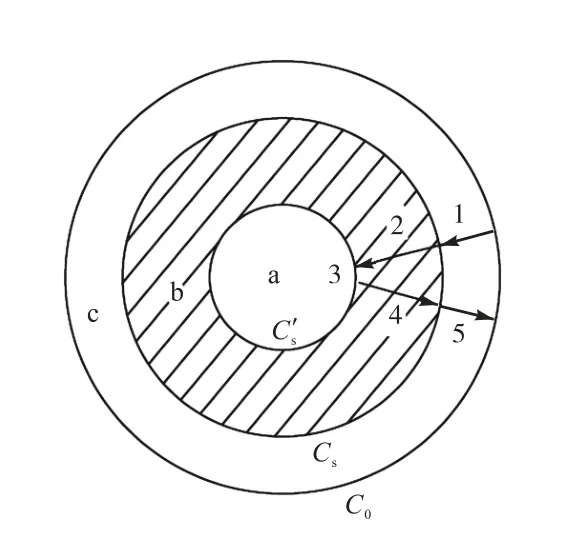
图1 氰化物浸取过程示意图Fig.1 Schema of cyanide leaching process
上述浸取反应动力学由最慢速率步骤控制,该步骤称作限速步骤.浸取过程可分为化学反应控制、外扩散控制、内扩散控制和混合控制4 种模型,其相应的控制动力学方程[20]如下:
(1)化学反应控制的动力学方程

(2)外扩散控制的动力学方程

(3)内扩散控制的动力学方程
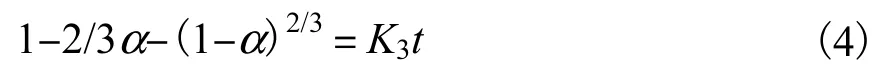
(4)混合控制的动力学方程
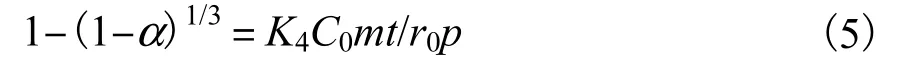
式中:K1、K2、K3、K4分别为不同控制步骤的浸取速率常数;α 为氰化物浸取分数;t 为浸取时间;C0为浸取剂初始浓度;r0为土壤颗粒的初始粒径;p 为土壤样品的摩尔密度;m 为土壤样品颗粒的质量.
污染土壤中氰化物的浸取原理是根据氰化物具有较大溶解度的性质,将土壤中固态氰化物转移至碱液中,在碱液中氰化物以CN-的形态存在,这种浸取过程属于液-固非均相扩散,而淋洗液是pH=10.5 的碱液,故浸取过程不存在化学反应,本文针对内、外扩散动力学进行研究.
2 结果与讨论
2.1 固液比对氰化物浸取效果的影响
不同固液比对氰化物浸取效果的影响如图2 所示.可以看出固液比分别为1∶10、1∶20 和1∶30时,氰化物浸取分数基本相同,约为0.45,由此表明固液比对氰化物浸取效果的影响较小.在后续实验中,固液比均为1∶10.
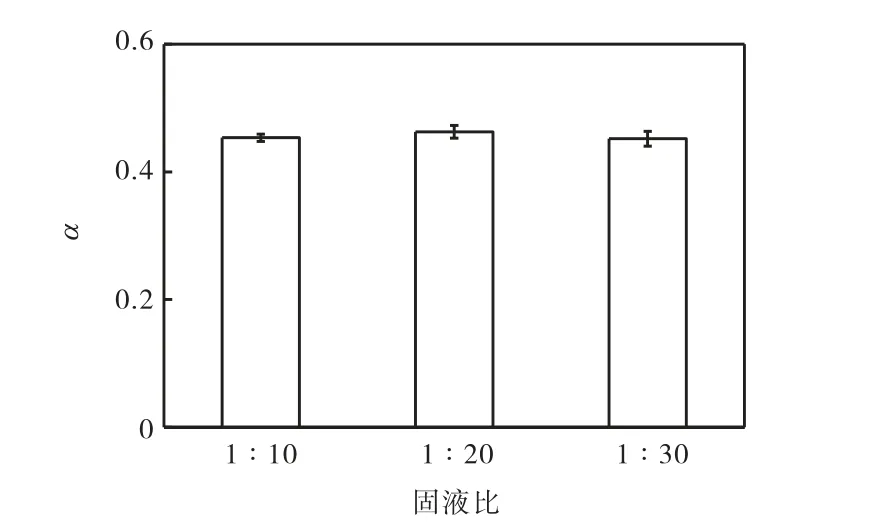
图2 不同固液比下氰化物的浸取分数Fig.2 Leaching fraction of cyanide at different solidliquid ratio
2.2 搅拌强度对氰化物浸取效果的影响
不同搅拌强度对氰化物浸取效果的影响如图3所示.
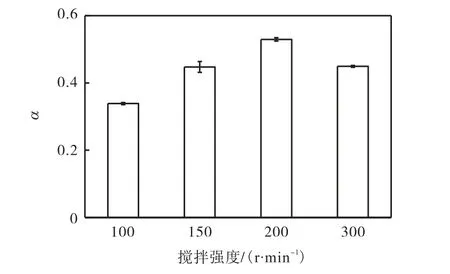
图3 不同搅拌强度下氰化物的浸取分数Fig.3 Leaching fraction of cyanide at different stirring intensity
从图3 中可以看出:搅拌强度不同氰化物浸取分数不同,在100~200 r/min 范围内,氰化物浸取分数随搅拌强度的增大而增大;但当搅拌强度继续增大至300 r/min 时,浸取分数出现下降现象.这表明在浸取过程中进行搅拌可以使固体在液体中充分分散,进而加速传质过程,但搅拌强度过大会出现局部气旋现象,致使液、固不能进行有效接触,从而导致浸取效果变差[21].固液浸取过程中的控速步骤若为液膜扩散(即外扩散),则搅拌强度对浸取效果有很大的影响,通常可将浸取分数提高0.4~0.7[22];从图3 可以看出本文中搅拌强度对氰化物浸取分数的影响在0.08~0.2 之间,由此可以判断氰化物浸取过程的控制步骤为内扩散控制模型.
为进一步验证氰化物浸取过程的控制步骤,分别通过温度和粒径进一步研究浸取动力学特征.
2.3 温度对浸取效果的影响及动力学分析
为了研究碱性溶液浸取土壤中氰化物的过程和机理,在搅拌强度为200 r/min 下考察不同温度对氰化物浸取效果的影响,结果如图4 所示.
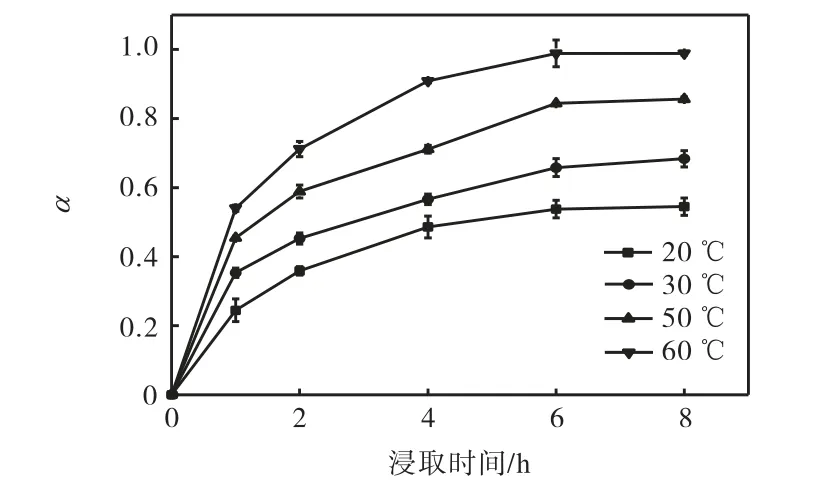
图4 不同温度下的氰化物浸取曲线Fig.4 Leaching curves of cyanide at different temperature
从图4 中可以看出:土壤中氰化物的浸取分数随浸取温度的增加和浸取时间的延长而增加.这表明氰化物浸取过程是受动力学控制.浸取6 h 后,浸取分数趋于平缓,表明浸取过程接近平衡,浸取过程受热力学控制.
将图4 中受动力学控制的实验数据代入动力学模型可以确定浸取过程的控制方程.外扩散模型曲线和内扩散模型曲线分别如图5、图6 所示.对图5和图6 的外、内扩散模型进行线性拟合,得到的不同温度下外、内扩散浸取速率常数K2、K3及其相关系数R2见表1.
从图5 和图6 可以看出:各温度下的外扩散曲线是一系列曲线,内扩散曲线则是一系列接近于过原点的直线.
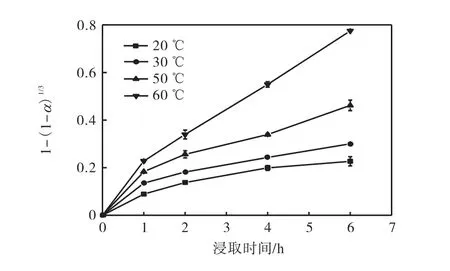
图5 不同温度下外扩散模型曲线Fig.5 Out-diffusion model curves at different temperature
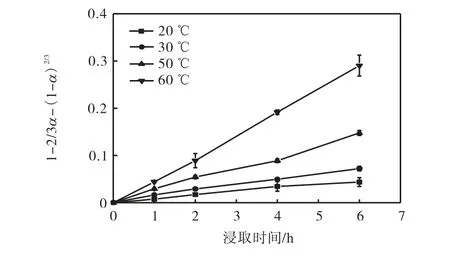
图6 不同温度下内扩散模型曲线Fig.6 In-diffusion model curves at different temperature

表1 不同温度下的K2、K3 和相关系数Tab.1 K2,K3 and correlation coefficients at different temperature
表1 显示了对两种扩散模型的拟合程度,外扩散模型的相关系数R2在0.758 8~0.958 2 之间,而内扩散模型的R2在0.968 0~0.992 9 之间,这表明氰化物浸取过程较好地符合“收缩未反应芯模型”中的内扩散控制模型.
因此,氰化物浸取动力学方程可表示为式(4).
根据表1 中不同温度下的内扩散模型浸取线斜率K3,绘制-lnK3与1/T 曲线,结果如图7 所示.根据Arrhenius 方程:

式中:K3为氰化物浸取速率常数,h-1;A 为指前因子;R 为理想气体常数,8.314 J/(mol·K);T 为浸取温度,K;E 为浸取活化能,J/mol.
根据图7 的直线斜率,计算出浸取活化能为34 400 J/mol,该活化能较小,进一步说明浸取过程受内扩散控制.
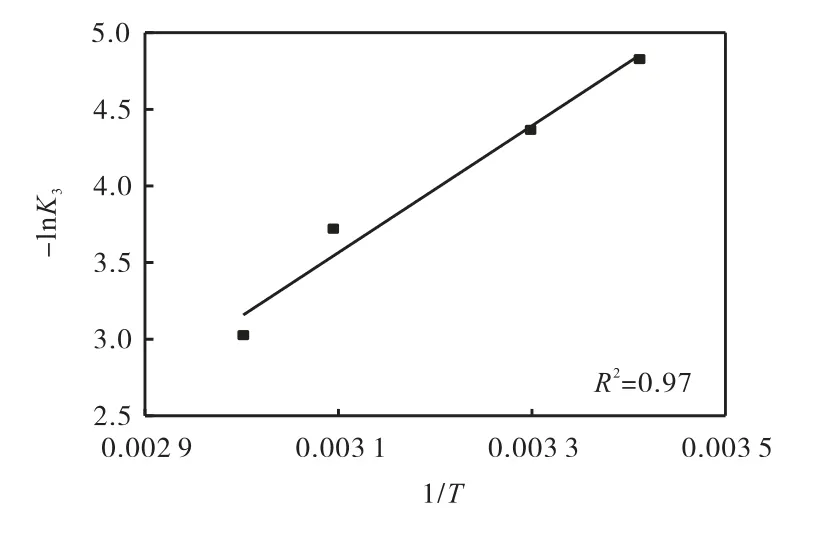
图7 -lnK3 与1/T 的关系图Fig.7 Relationship between -lnK3 and 1/T
2.4 粒径对浸取效果的影响及动力学分析
为了研究碱性溶液浸取土壤中氰化物的过程和机理,考察不同粒径对氰化物浸取效果的影响,结果如图8 所示.
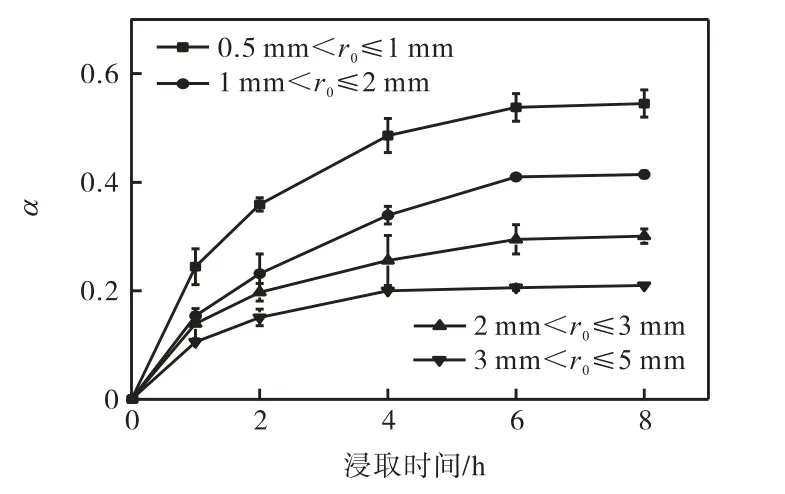
图8 不同粒径下的氰化物浸取曲线Fig.8 Leaching curves of cyanide at different particle size
从图8 中可以看出:土壤中氰化物的浸取分数随土壤粒径的减小和浸取时间的延长而增加.这表明氰化物浸取过程是受动力学控制.浸取6 h 后,浸取分数趋于平缓,表明浸取过程接近平衡.
将图8 中受动力学控制的实验数据代入动力学模型可以确定浸取过程的控制方程.外扩散模型曲线和内扩散模型曲线分别如图9、图10 所示.
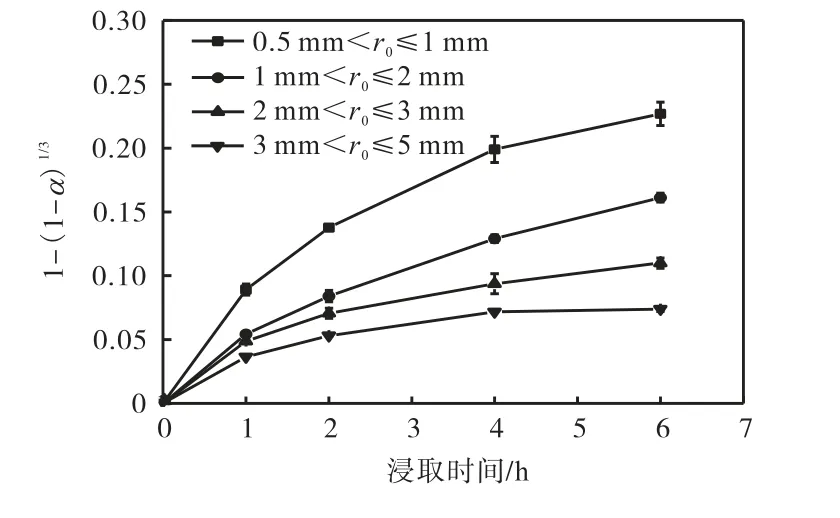
图9 不同粒径下的外扩散模型曲线Fig.9 Out-diffusion model curves at different particle size
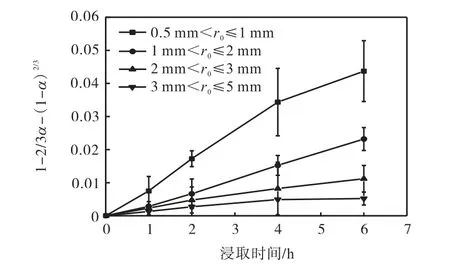
图10 不同粒径下的内扩散模型曲线Fig.10 In-diffusion model curves at different particle size
对图9 和图10 的外、内扩散模型进行线性拟合,得到的不同温度下外、内扩散浸取速率常数K2、K3及其相关系数R2见表2.
从图9 和图10 可以看出:各粒径下的外扩散曲线是一系列曲线,内扩散曲线则是一系列接近于过原点的直线.
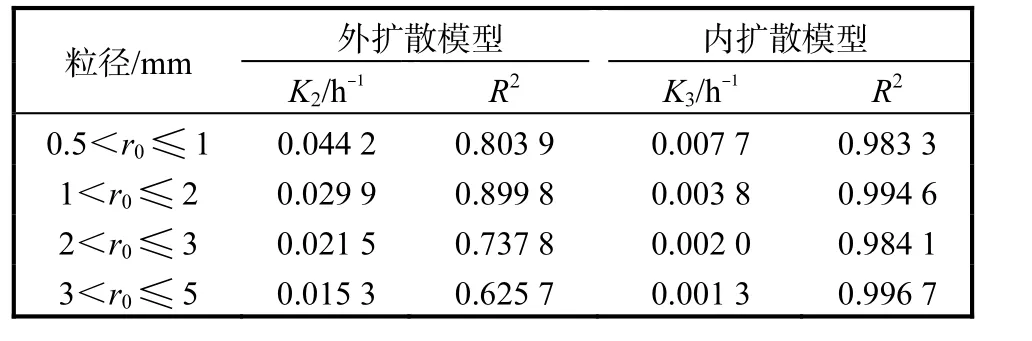
表2 不同粒径下的K2、K3 值和相关系数Tab.2 The K2,K3 values and correlation coefficients at different particle size
表2 显示了对两种扩散模型的拟合程度,外扩散模型的相关系数R2在0.625 7~0.899 8 之间,而内扩散模型的R2在0.983 3~0.996 7 之间,表明氰化物浸取过程较好地符合“收缩未反应芯模型”中的内扩散控制模型.
参考Tian 等[23]的研究,将Arrhenius 方程表示为

通过变形,有:
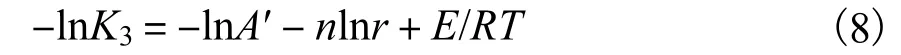
式中:r 为土壤颗粒的粒径;n 为土壤颗粒大小的数量级.
由表2 中各粒径下的浸取速率常数K3,绘制出-lnK3与lnr0的关系曲线,可得到如图11 所示的一条直线.
根据图11 中直线的斜率和截距分别计算n 与A′的值,分别为-1 和7.6×104.由以上结果得到了关于K3的方程:

由以上实验可以获得氰化物浸取动力学的经验方程为
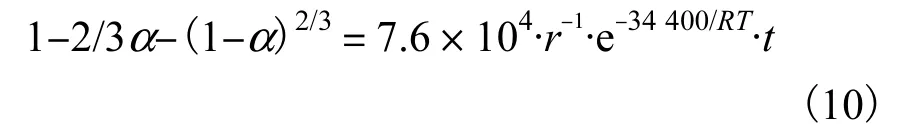
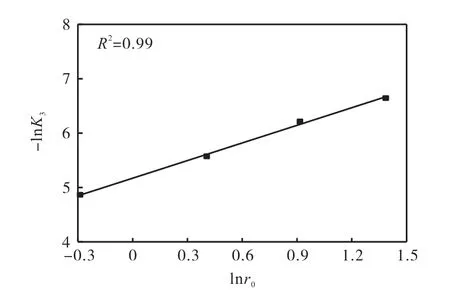
图11 lnr0 与-lnK3 的关系图Fig.11 Relationship between -lnK3 and lnr0
3 结 论
(1)从污染土壤中浸取氰化物的实验表明,固液比对氰化物浸取效果没有显著影响,搅拌强度对氰化物浸取分数的影响在0.08~0.2 之间,对浸取效果影响较小.
(2)从浸取动力学角度考察浸取温度和土壤粒径对氰化物浸取的影响,表明温度和粒径是影响氰化物浸取效果的关键因素.
(3)氰化物在浸取初期受动力学控制,且符合内扩散控制模型.在不同实验条件下氰化物浸取速率常数不同,当温度分别为20、30、50、60 ℃时,浸取速率常数逐渐增大,分别为0.008 0、0.012 7、0.024 2、0.048 5 h-1;当 粒径 分 别为0.5 mm <r0≤1 mm、1 mm <r0≤2 mm、2 mm <r0≤3 mm 和 3 mm <r0≤5 mm 时,浸取速率常数逐渐减小,分别为0.007 7、0.003 8、0.002 0、0.001 3 h-1;氰化物浸取活化能为34 400 J/mol,据此建立出的氰化物浸取经验方程:1-2/3α-(1-α)2/3=7.6×104·r-1·e-34400/RT·t.

