自制复合质控品在α、β-地中海贫血基因检测中的应用价值*
汪文明,马 玲,周 靖,陈 林△
1.重庆市南川区人民医院检验科,重庆 408400;2.重庆市南川区妇幼保健院检验科,重庆 408400
地中海贫血(以下简称“地贫”)是全球最大的单基因遗传病之一,我国南方高发地区人群携带率为1%~23%[1]。基因检测是诊断该病和确定基因型的准确方法[2]。目前临床应用最为广泛的基因检测方法是反向斑点杂交技术,该方法成本低,通量高,适合在基层实验室开展,但检测过程烦琐,手工操作步骤多,检测周期长,缺少阳性质控品,是该方法不可忽视的问题。《医学实验室质量与能力认可准则在基因扩增检验领域的指南》要求,基因扩增实验室的内部质量控制至少需做阴阳性质控[3]。目前,分子检测的商品化质控物有限,且存在检测位点单一,无法覆盖全部突变位点,不能参与整个检测过程等问题,较多实验室使用自制质控品[4]。在病原微生物核酸检测方面,葛燕梅等[5]使用已确认的解脲支原体阳性标本作为单一质控物;另外,部分实验室使用商品化试剂自制复合质控品[6-8]。在遗传性疾病的基因检测项目中,自制复合质控品的使用鲜有报道。本研究探讨使用阳性标本混合制作复合质控品,以期覆盖更多的突变位点,并对该方法的可行性进行验证。
1 材料与方法
1.1材料 收集2017年9月至2018年12月在南川区人民医院行α、β-地贫检测的阳性标本,标本类型为枸橼酸钠抗凝的外周全血。日常检测工作中,选取DNA水平为20~40 ng/μL,纯度A260/A280值为1.5~2.5的单一突变类型的杂合子标本,于-70 ℃冰箱保存,建立阳性标本库。本研究经过南川区人民医院伦理委员会批准,受检者知情同意。
1.2仪器与试剂 α、β-地贫基因检测试剂盒(潮州凯普公司),NanoDrop 2000紫外-可见分光光度计(赛默飞公司),Veriti热循环仪(美国应用公司),HB-2012A型医用核酸分子快速杂交仪(潮州凯普公司)。
1.3方法
1.3.1阳性标本的选择 选择阳性标本时,应根据实验室使用的检测方法及检测基因位点而定,应尽可能覆盖PCR产物的所有片段。南川区人民医院检验科(以下称“本实验室”)采用潮州凯普公司生产的α、β-地贫基因检测试剂,该试剂使用单管法,使用3对半引物扩增α-地贫的3种突变位点和3种缺失型位点(图1)及1对引物扩增β-地贫的17个位点的19种突变类型。因此,本研究制备的复合质控品,使用2种不同的α-地贫突变位点和2种不同的β-地贫突变位点。在制备质控品时,可使用不同的突变位点自由组合,以达到同一批次试剂覆盖所有常见突变位点的目的。
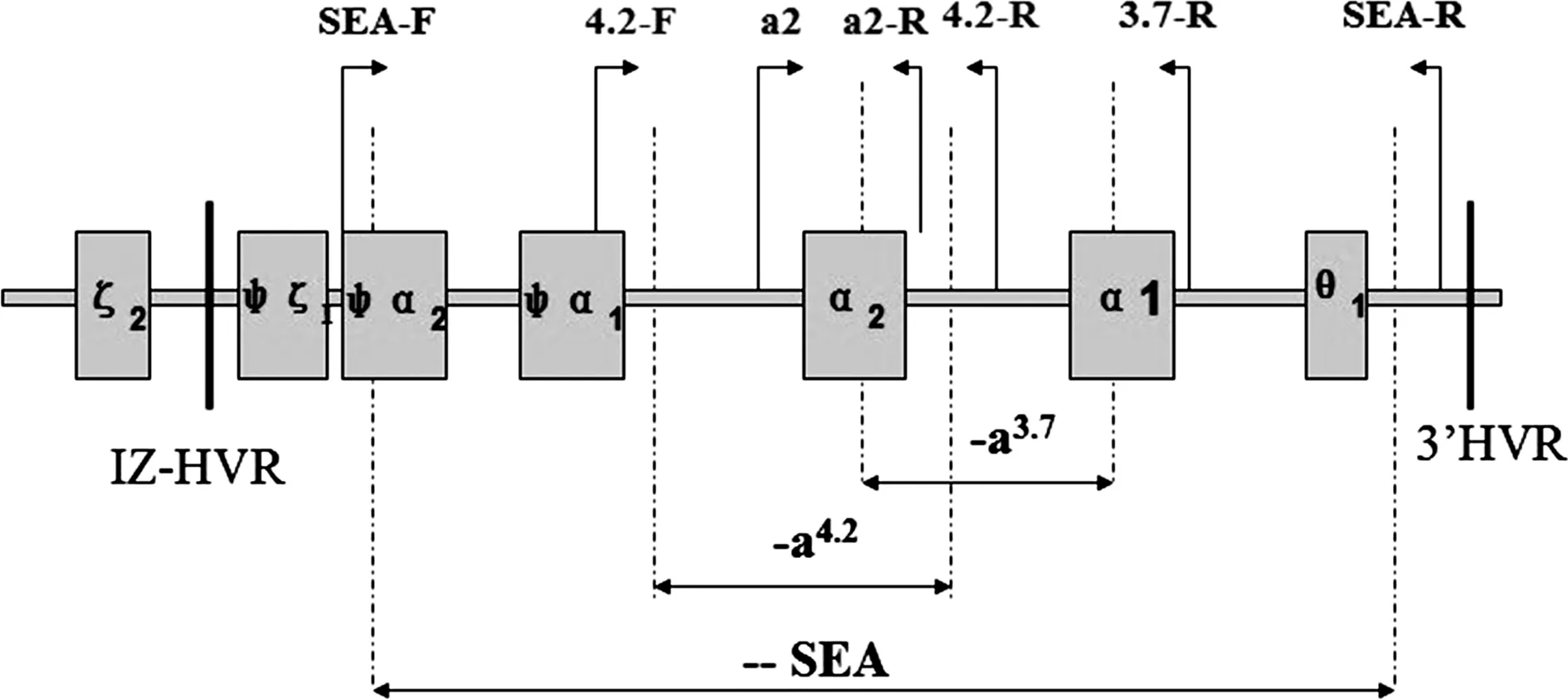
图1 α-地贫基因引物位置模式图(潮州凯普公司提供)
1.3.2复合质控品制备 按照上述要求,从-70 ℃阳性标本库中,选取4种不同突变类型的阳性标本,室温充分融化。分别取1 mL加入10 mL无菌离心管内,震荡混匀,瞬时离心,制成复合质控品,分别分装200 μL于1.5 mL EP管内,-70 ℃冰箱保存备用。每次试验前,取1支在室温下复融20 min,充分混匀后,与待测标本一起检测。
根据α、β-地贫基因试剂的检测要求,全血标本加样量为200 μL时,提取DNA的水平为20~40 ng/μL,DNA纯度A260/A280的值为1.5~2.5,且试剂盒的DNA最低检出限为2 ng/μL。通过等比例混合4种不同突变类型阳性标本的方法,制备复合质控品,每种突变类型阳性标本的加样量为50 μL,混合后总体积为200 μL,理论上每种突变的DNA水平为5~10 ng/μL,此水平符合弱阳性质控品的水平要求(最低检测量的2~5倍)[6-8]。
1.3.3自制质控品检测及结果判读 自制复合质控品与待测标本一起,按照试剂盒说明书要求,使用离心柱法提取DNA,使用NanoDrop 2000紫外-可见分光光度计检测DNA提取液的水平和纯度(试剂盒要求水平为20~40 ng/μL,纯度A260/A280比值为1.5~2.5)。PCR反应体系为50 μL,45 μL PCR混合液,5 μL DNA提取液。使用Veriti热循环仪行基因扩增。使用HB-2012A型医用核酸分子快速杂交仪对扩增产物行导流杂交,扩增产物和杂交膜条上的不同突变类型的探针杂交,通过化学显色对结果进行判读,见图2。因α、β-地贫基因突变位点较多,1个复合质控品最多可监控4个突变位点,为监控更多的突变位点,下次检测可改用与上次不同的复合质控品。
1.4统计学处理 采用Microsoft Excel2010对数据进行整理。
2 结 果
使用自制复合质控品监控126次,同时使用含有单一突变位点(-α3.7)的阳性标本进行对照。126次检测中,使用自制复合质控品和单一突变阳性标本提取的DNA,其水平及纯度均满足试剂盒要求,见表1。反向斑点杂交结果中,每阳性位点对应的斑点均成功显色,见图2。126次检测中,共监测阳性位点数504次,检出率为100.0%,阳性预测值为100.0%,阴性预测值为0。检测阳性位点基本覆盖本地区所有常见突变位点,见表1。
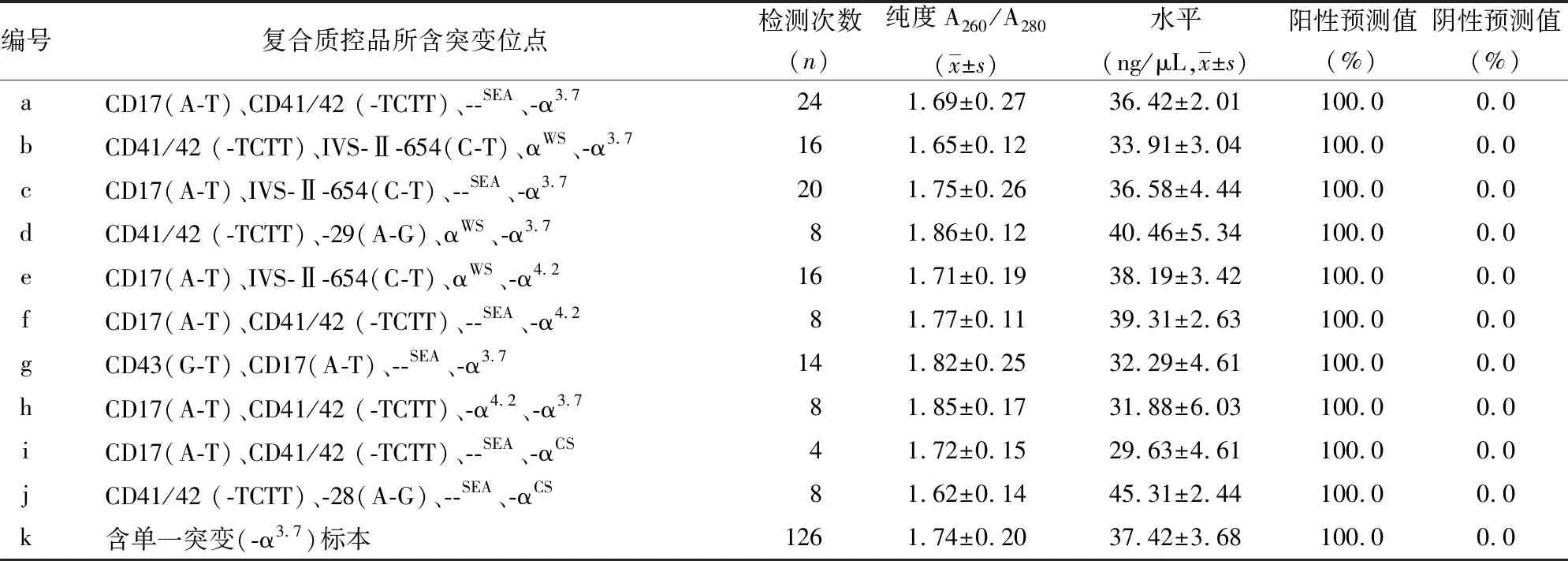
表1 自制复合质控品检测结果
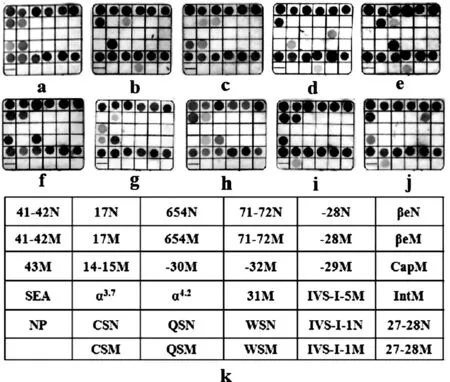
注:k为杂交膜条上不同探针的分布示意图,图中每个小方格内的含有1种探针,左下角1个小方格无探针分布,第1行和倒数第2行有“N”标记的小方格,代表野生型探针,其中 “NP”为“--SEA、-α3.7、-α4.2”共用的野生型对照点,“M”标记的小方格代表突变型探针;a~j为10种自制复合质控品对应的10张不同的杂交膜条,蓝色斑点代表质控品扩增产物与相应的探针行反向斑点杂交的结果。
图2 自制复合质控品反向斑点杂交结果
3 讨 论
室内质控的目的在于监控检测过程,评价检验结果是否可靠,以排除所有阶段中导致不满意的原因。分子检测技术飞速发展,越来越多的医院开设有分子检测项目,然而分子检测的室内质控却未完善[9-10],特别是室内质控物质的缺少,给实验室开展分子检测带来困难。吕荣钰等[11]对反向斑点杂交法检测为阴性的地贫疑似病例,再进一步行基因检测,发现有1.8%的漏诊率,对于漏诊的原因,文章并未详述,笔者认为该方法缺少阳性质控对实验全过程进行有效监控,是该方法存在的缺陷。在缺乏商品化阳性质控品情况下,实验室多采用已确认的阳性标本进行质控,也有部分实验室在进行基因型检测时,常年仅使用一个基因型室内质控品,未对其他有临床决策价值的基因突变进行监控[9]。李艳等[12]提出当同时检测多个突变基因时,可设立2个或3个突变基因的阳性对照,下次改用与上次不同的突变基因,以便覆盖更多突变位点。笔者受到以上研究的启发,结合本实验室积累的质控经验,以α、β-地贫基因检测为例,通过混合阳性标本,自制复合质控品的方法,对检测全过程进行监控。结果显示,2017年9月至2018年12月使用自制质控品检测126次,检测阳性位点数504次,检出率为100.0%,阳性预测值为100.0%,阴性预测值为0。检测阳性位点基本覆盖本地区所有常见突变位点。
与商品化质控品相比,自制质控品原料有限,且每个标本间也存在差异,不同批次质控品间也会存在差异,因此,需要对纳入阳性标本库的标本进行严格的质控,不得使用DNA水平及纯度低,含有凝块等不合格的标本。应用过程发现以下缺陷:(1)质控品4个阳性位点的显色,有时会出现深浅不均一的情况,可能与某一标本产生微小凝块,或冻存标本未完全融化有关。因此,在制备质控品时,每个标本要充分融化,若遇到有较小凝块时,可参照文献[13]的方法,使用无菌小木棍,将凝块捣碎,震荡混匀,然后再与其他不同突变类型的阳性标本混合。(2)阳性标本经冻存、室温溶解、混匀、震荡等操作后,标本物理性状发生较大改变,显微镜下观察,无完整细胞结构,DNA呈游离状态,易降解。因此,选择阳性标本时,建议使用近1~2个月内检出的标本。(3)4元复合质控品,每个阳性标本的加样量约为常规加样量的1/4,若某一阳性标本DNA水平较低,或者因为标本凝集等原因,导致DNA的提取量减少,若低于试剂盒检测下限时,可能会遇到某一位点未检出的情况。若同一批次同一位点多次出现未检出的情况,应属于质控品原因导致的失控。因此,在制备质控品时,可增加同种突变的阳性标本数,等比例混匀后,再与其他不同突变类型的阳性标本混合,以弥补因单一标本的质量不佳造成的影响。(4)多重PCR不同引物间存在着竞争作用[14],某些潜在扩增效率低的引物其扩增效率会有所降低,导致某个突变未检出,或检出比例降低的情况。本研究还未发现未检出的情况,可能与本研究数据较少有关,有待进一步观察。(5)与商品化质控品相比,自制质控品的配置过程相对比较粗糙,在稳定性、瓶间差等方面,无法达到标准化的要求[15],因此,在发现自制质控品未检出等情况时,应首先排除自制质控品本身的原因。(6)因区域性阳性标本类型的限制[16],无法获取一些稀有型突变的标本,本方法仅可监控本地区常见突变类型。
我国α、β-地贫发病率较高,阳性标本易获得,本研究制备的复合质控品,制备方法简单,成本低,可有效监控更多突变位点。本实验室使用该方法进行质控,稳定性良好,在商品化质控品不太成熟的情况下,实验室可根据实际情况自行制备。

