大鼠肝脏再生终止阶段差异基因表达的生物信息学分析
刘一鸣,袁方超,王孟皓
重庆医科大学附属第二医院肝胆外科,重庆 400010
当肝脏发生损伤时,一系列信号通路被激活从而启动肝脏再生(LR),通过剩余肝组织的迅速扩张来满足机体代谢需求。HIGGINS等[1]利用动物实验得出结果,大鼠约70%的肝脏被切除后剩余肝脏可在5~7 d内基本恢复至术前的质量、体积及功能,随后细胞又重新恢复静止。有研究认为,整个LR过程包括3个阶段:启动、增殖和终止[2]。在启动阶段,包括肿瘤坏死因子(TNF)-α及白细胞介素(IL)-6在内的一系列细胞因子作用于肝细胞,增强其对生长因子的敏感性。多种生长因子的刺激使肝细胞重新进入G1期从而进入增殖阶段,当肝组织功能足以维持机体正常的代谢需求后,肝细胞则重新进入G0期停止增殖[3]。目前针对LR研究大多数集中于再生早期的启动信号,而再生晚期所涉及的终止信号尚不完全明确。因此,本研究探讨了LR晚期的负性调控信号及其所涉及的关键基因,旨在加深对LR过程、肝细胞肝癌(HCC)生长调控机制的阐释以及潜在治疗靶点筛选的认识。近年来,伴随高通量测序及计算机科学技术的迅猛发展,综合利用生命科学、计算机及信息技术来解析海量而复杂生物数据背后的潜在意义成为可能。本研究通过生物信息学分析,选取LR终止阶段相关基因芯片,挖掘、筛选出具有统计学意义的差异表达基因(DEGs)并进行分析以寻找出在该过程中发挥重要作用的关键基因及通路。
1 资料与方法
1.1一般资料 利用美国国立生物技术信息中心(NCBI)的高通量基因表达数据库(GEO)为工具,以“liver regeneration”为关键词,选取并下载大鼠肝脏切除(PH)术后肝组织基因表达数据集(GSE63742),该数据集共包含PH术后9个时间点共57个样本,本研究选取PH术后7 d共6个样本(假手术组3个,PH组3个)作为大鼠LR终止阶段基因表达的原始数据。
1.2方法
1.2.1基因芯片质量验证 在R语言(https://www.r-project.org/)中调用“affyPLM”软件包对原始数据回归计算进行质量验证,结果采用相对对数表达(RLE)箱线图、相对标准差(NUSE)箱线图以及RNA降解图进行评估和展示[4]。
1.2.2芯片数据处理及DEGs筛选 利用R语言中“affy”“limma”软件包[5-6]对芯片原始数据做如下处理:(1)背景校正及分位数均一化;(2)筛选DEGs,条件为log2[倍数变化(FC)]绝对值>1.5同时校正P<0.001;(3)通过芯片平台文件将探针ID转为基因名称。分析结果利用R语言“ggplot2”软件包进行可视化。
1.2.3京都基因与基因组百科全书(KEGG)和基因本体(GO)富集分析 用在线工具DAVID数据库(https://david.ncifcrf.gov/home.jsp)[7]对所得DEGs进行KEGG通路以及GO富集分析[8-9]。GO富集分析包括生物学过程、细胞组分以及分子功能共3个部分。分析结果利用R语言“ggplot2”软件包进行可视化。
1.2.4蛋白质互作用网络构建及关键基因筛选 将上述步骤所得到DEGs输入线上蛋白相互作用检索(STRING)数据库(https://string-db.org/),以中度相互作用可信度为条件构建蛋白质互作用网络(PPI网络)。下载PPI网络信息并导入Cytoscape软件中利用cytoHubba插件分析预测该网络中的关键节点及关键基因[10-11]。
1.3统计学处理 GSE63742原始数据利用R语言“affyPLM”及“affy”包对背景进行校正及标准化处理,通过“limma”包进行t检验并根据设定阈值筛选具有统计学差异的DEGs。KEGG及GO富集分析采用DAVID 数据库在线统计学工具进行分析。Cytoscape软件中利用cytoHubba插件进行最大团中心性(MCC)的统计分析[11]。
2 结 果
2.1芯片质量验证 稳定的芯片质量是保证后续分析可靠的基础,RLE和NUES箱线图可反映平行实验的一致性,RNA降解图可反映芯片质量,若某个芯片的箱线图或者降解图出现较大偏差则表明该芯片存在问题。结果表明纳入芯片的REL及NUSE箱线图结果相对稳定,差异无统计学意义(P>0.05),见图1A、1B。RNA降解是影响芯片质量的重要因素,因其从5′开始降解,所以5′的荧光强度要低于3′,利用RNA降解曲线观察各个芯片RNA降解趋势是否存在一致性。图1C显示纳入分析芯片的5′端较3′端降解明显,各组之间趋势相对平行,差异无统计学意义(P>0.05)。上述分析均表明纳入本研究的芯片质量优秀,检测结果稳定,可为后续分析提供可靠数据。
2.2DEGs筛选 对芯片样本进行主成分分析(PCA),结果提示两组差异较大具备明显特异性,见图2A。对DEGs进行聚类分析提示组内差异较小可重复性良好,PH组基因表达模式与假手术组有明显区别,见图2B。将芯片数据归一化处理后共筛选出上调基因70个,下调基因66个,共计136个DEGs,结果用火山图进行展示,见图2C,上调和下调最显著的前10个DEGs具体信息见表1。
2.3DEGs的KEGG和GO富集分析 DEGs的KEGG可视化分析结果表明,LR终止阶段大量DEGs与类固醇激素合成、维生素A代谢、丝裂原活化蛋白激酶(MAPK)信号通路、转化生长因子-β(TGF-β)等共7条信号及代谢通路密切相关。GO富集分析结果表明,在生物学过程中,DEGs主要与Notch信号通路负向调控、环氧酶P450通路以及IL-8分泌正向调控等过程相关;在细胞组分层面,主要与细胞外区域、基底外侧膜、外泌体以及细胞器膜等结构相关;在分子功能上主要和芳香酶活性、小分子结合、花生四烯酸环氧酶活性以及类固醇羟化酶活性等分子功能相关。 见图3。

注:A为RLE箱线图;B为NEUS箱线图;C为RNA降解图。
图1 基因芯片质量验证

注:A为假手术组与PH组的PCA分析;B为火山图,黑色代表非DEGs,红色代表上调DEGs,绿色代表下调DEGs;C为DEGs聚类热图。
图2 PH组与假手术组的PCA分析及DEGs筛选
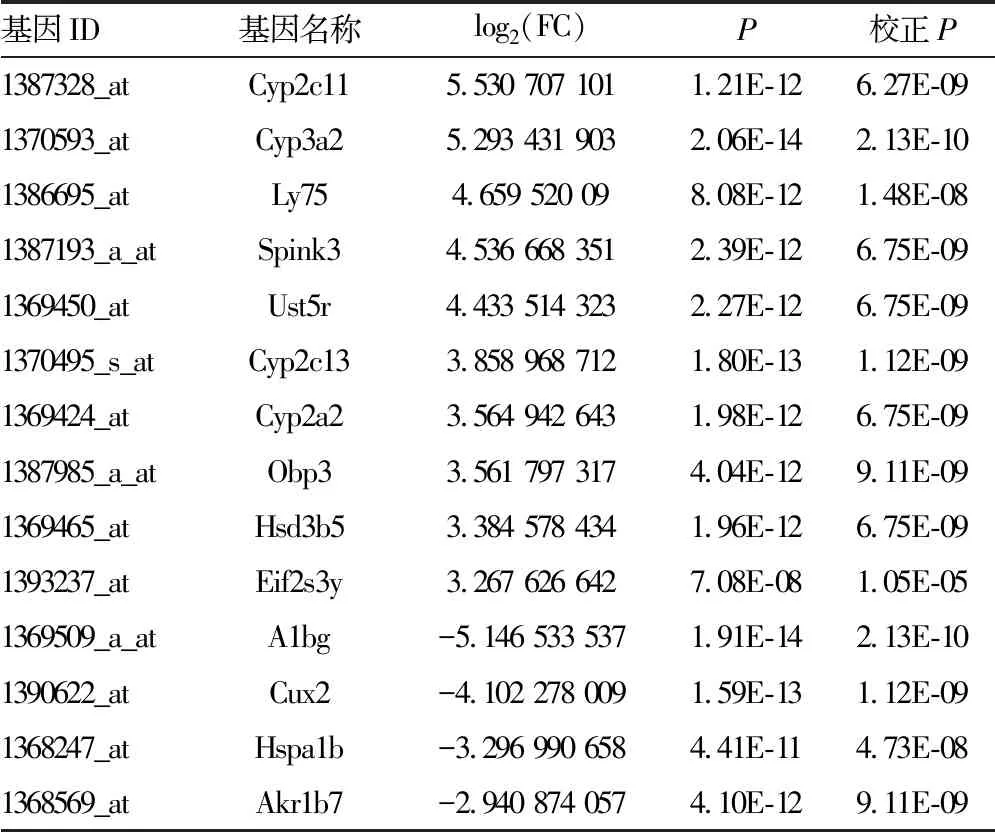
表1 PH组与假手术组DEGs上调和下调最显著的前10个基因详细信息

续表1 PH组与假手术组DEGs上调和下调最显著的前10个基因详细信息
2.4PPI网络构建及分析 通过STRING数据库构建PPI网络以及Cytoscape软件分析可进一步明确DEGs所涉及的蛋白相互作用及其中参与调控的关键基因。结果显示,该PPI网络中包括67个节点蛋白的46种关系,其中多数蛋白间都存在相互作用关系。采用cytoHubba插件在该PPI网络中共筛选关键节点和基因,排名前10位的关键基因依次为Cyp2c13、ste2、Mup5、LOC259244、Rup2、Hsd3b5、UST4r、Btg2、Cyp2c11、Myc。见图4。

注:A为KEGG;B为生物学过程;C为细胞组分;D为分子功能。
图3 DEGs的KEGG及GO富集分析
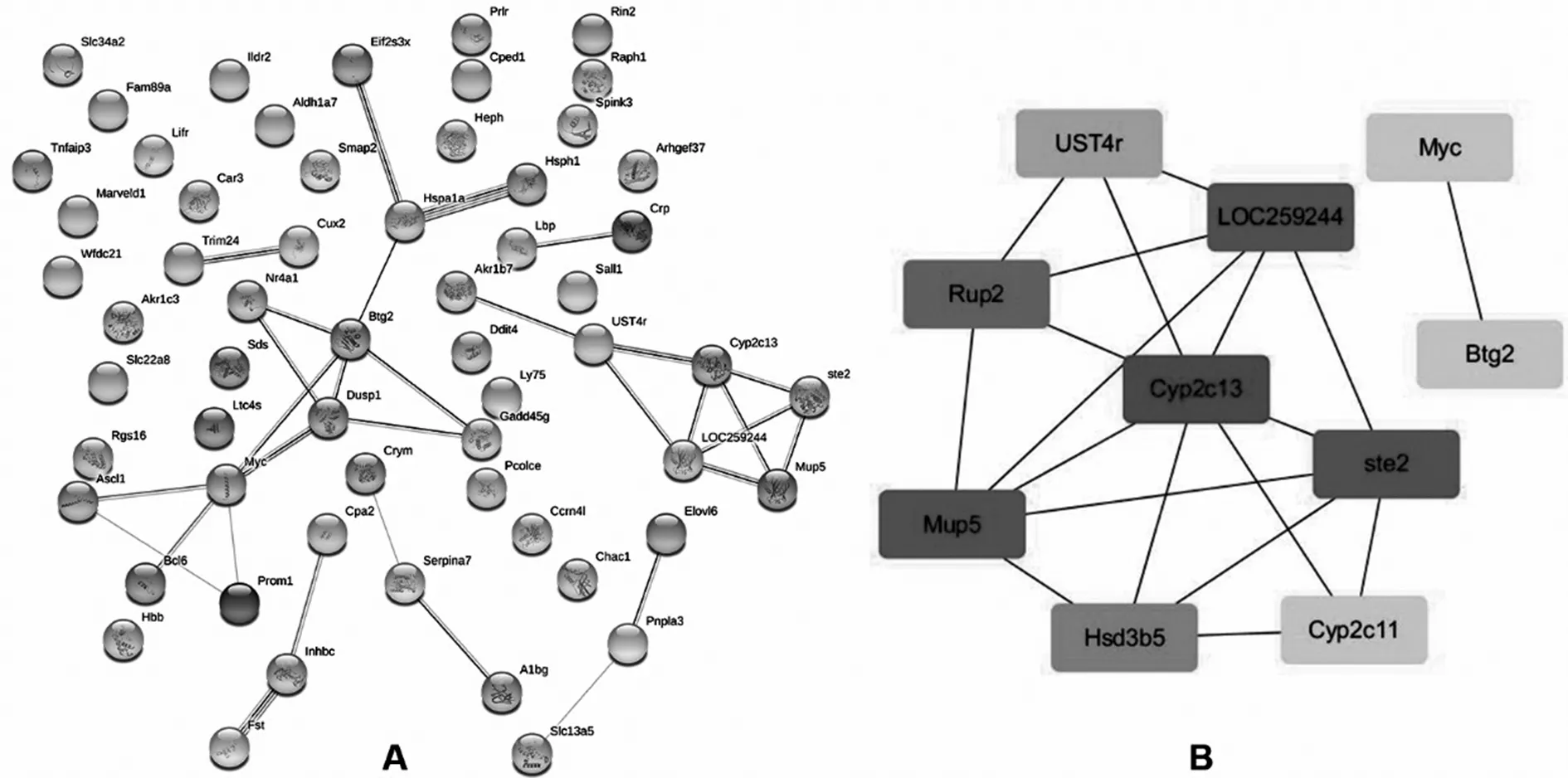
注:A为PPI网络;B为排位前10的关键基因。
图4 PPI网络构建及关键基因筛选
3 讨 论
在增殖阶段,LR与肝脏肿瘤都表现为肝细胞强大的增殖能力。但由于肿瘤细胞缺乏终止的负向调控机制,其细胞可以进行无限分裂。而LR是一个受多因素调节复杂而精密的过程,当再生程度能够满足机体代谢需求时,会触发终止信号停止细胞增殖。本研究选取LR终止阶段的大鼠肝脏基因芯片共筛选136个DEGs并对其进行KEGG和GO富集分析试图揭示上述基因在LR终止阶段所发挥的作用。在KEGG分析所筛选出的7条通路中,MAPK和TGF-β信号通路最值得关注。MAPK家族是一组能被多种细胞外刺激活化的丝氨酸-苏氨酸蛋白激酶,主要参与细胞生长、分化、应激以及炎性反应等多种重要的生理/病理过程。而CAMPBELL等[14]研究报道了p38作为MAPK亚族在增殖中发挥作用与肝细胞所处的病理生理环境密切相关,该研究表明p38α是肝细胞增殖的负向调控因子,在肝细胞特异性敲除p38α的小鼠PH术后LR模型中,LR早期表现为增殖活性增强,其机制可能与p38α拮抗JNK-c-Jun通路活性有关。在慢性胆汁性肝硬化模型中,特异性敲除肝细胞p38α会导致有丝分裂阻滞以及细胞质分裂失败,从而减少肝细胞增殖最终降低了小鼠寿命[15]。FORTIER等[16]通过CCl4碳诱导的急性肝损伤模型表明,特异性敲除肝细胞p38α改变了损伤后免疫微环境使炎性细胞浸润增强,通过CCl2/CCl5细胞因子的趋化作用有利于肝组织修复的免疫微环境形成。有研究表明,TGF-β信号通路是抑制肝细胞增殖的重要信号,因此其与肝星状细胞(HSCs)活化密切相关[13]。HSCs作为肝脏微环境中最重要的非实质细胞,当分化为成肌纤维细胞(MFs)后参与了肝纤维化、HCC以及LR等病理生理过程,抑制TGF-β通路干扰了LR过程中HSCs的上皮-间质转化,减少了β-catenin核聚集以及细胞色素P450表达,最终导致增殖延迟,而该通路活化可直接促进肝纤维化[17-18]。一项关于HCC转录组分析表明,40%样本存在TGF-β信号通路基因突变,该通路上调会促进炎症和纤维化,下调则会降低肿瘤抑制活性,显著缩短患者生存时间[19]。Notch信号通路具有促进肝细胞增殖的作用,过表达Notch-1可以上调cyclin A1、D1、E等细胞周期蛋白表达[20];肝母细胞中Notch通路活化在肝稳态、代谢、再生、血管生理以及胆道形态成形方面发挥了作用[21];PH术后肝脏Notch通路明显活化,抑制该通路可导致细胞周期及其相关蛋白失调,所涉及机制可能与NICD/Akt/HIF-1α通路有关[22]。肝细胞来源的外泌体可在再生过程中促进细胞间通讯,骨髓间充质干细胞来源的外泌体可经Wnt/β-catenin通路抑制HSCs活化从而减轻CCl4诱导的肝纤维化[23-24]。而在LR终止阶段,DEGs的分子功能为激活包括芳香化酶、类固醇羟化酶在内的多种代谢相关酶活性,也预示着肝脏最重要的代谢功能已经恢复。
在PPI网络中筛选出前10 位与LR终止阶段相关的关键基因较假手术组均表达上调。Cyp2c11及Cyp2c13是编码大鼠细胞色素P450酶系统的基因,该系统在哺乳动物细胞中主要存在于线粒体和微粒体,与大量内源性物质及外源性物质的代谢密切相关[25]。上述基因分别与人Cyp2c9及Cyp2c19基因具有高度相似性,而后者是体外培养肝细胞及人工肝组织构建产生生理功能的标记[25-26]。LOC259244是编码大鼠α2u-球蛋白的基因,该蛋白仅在雄性大鼠的肝脏中合成[27]。因此有理由推断Cyp2c11、Cyp2c13以及LOC259244基因表达上调是LR晚期肝脏代谢功能恢复的标志,但目前关于上述基因在LR中的作用少有文献报道,其如何参与LR终止阶段的调控更有待进一步探讨。ste2基因编码雌激素磺基转移酶2,后者通过磺化和灭活雌激素来维持雌激素稳态。研究证实,雌激素可经过G蛋白耦联雌激素受体1(GPER1)经Akt-mTOR通路促进斑马鱼及人类肝细胞增殖[28],因此,该基因在LR终止阶段上调可能是通过加强雌激素灭活从而间接下调Akt-mTOR通路活性来发挥负向调控作用。Hsd3b5基因在所有类固醇激素的生物合成中都发挥至关重要的作用。ZHAO等[29]研究表明,肝脏发育早期阶段的肿瘤样生长受到α2u-球蛋白(细胞外区域)、ppp2r2a-pik3c3(MAPK信号通路)、Hsd3b5(代谢通路)三者的正负协调作用。值得关注的是作为促癌基因的Myc在LR终止阶段表达水平仍然上调,当肝细胞核因子4α(HNF4α)缺失引起的c-Myc持续过表达最终会导致PH术后肝脏无功能的持续增殖[30]。这也间接证实了在该阶段必然存在一系列对抗其促增殖作用的负调节信号。在肝细胞中Btg2作为细胞周期抑制剂可阻止FoxM1活化来抑制DNA合成[31]。MiR-6875-3p可直接抑制Btg2表达来上调FAK/Akt通路活性从而促进HCC浸润与转移[32]。PRMT5可通过ERK通路介导Btg2表达下调来促进肿瘤增殖[33]。上述研究结果证实了部分关键基因在LR终止阶段的正向及负向作用,但关于Mup5、Rup2以及UST4r基因在LR及HCC中作用的相关报道较少,有待进一步探讨。
综上所述,LR是受多因素调控的复杂生物学过程,在终止阶段能根据机体需求停止增殖并产生有功能的肝细胞是其区别于肝脏肿瘤增殖的主要特点。本文成功筛选出大鼠LR终止阶段肝组织DEGs并对其进行分析,初步了解其涉及的相关功能以及信号通路。同时还分析出ste2、Btg2、Hsd3b5等具有负向调控作用的hub基因,为肝脏肿瘤研究靶点的筛选以及病理机制的探讨提供了新的思路。

