革兰阴性菌中分子伴侣在双组分蛋白分泌至周质空间过程中的作用
张艳娟,王 哲,蔡 锟,黄丕英,储引娣,范恩国
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病原生物学系,北京 100005)
双组分蛋白质分泌系统(two-partner-secretion,TPS)是革兰阴性菌分泌病原蛋白质的手段之一[1]。TPS含两个蛋白:分泌到细菌细胞外且具有致病性的毒力因子蛋白TpsA(two-partner-secretion protein A)和特异性负责TpsA蛋白跨外膜分泌的转运子蛋白TpsB(two-partner-secretion protein B)。代表性TPS系统为百日咳杆菌(bordetellapertussis)的FhaB/FhaC[1-2]。TpsA蛋白在由跨细菌细胞周质到跨外膜的过程中,处于非折叠且极易凝集并被降解的状态[3],需有分子伴侣的保护。而对此所涉及的分子伴侣尚知之甚少。
分子伴侣(molecular chaperone)是细胞中的一大类蛋白质,它们介导其他蛋白质的正确装配,但自己不成为最后功能结构中的组分。细菌细胞周质空间中已知的分子伴侣包括SurA、Skp、DegP、PpiD和YfgM等[4]。目前为止,除百日咳杆菌中发现parvulin蛋白家族的Par27蛋白能够与TPS中的FhaB蛋白作用外[5],上述分子伴侣蛋白在TPS中的作用则未见报道。
大肠杆菌中克隆的FhaB*/FhaC可完整重现TPS的跨外膜转运过程[2]。据此,本文通过敲除大肠杆菌周质空间的分子伴侣来探讨其对TPS中FhaB*蛋白[2]的跨内膜及其在周质空间的影响。
1 材料与方法
1.1 材料
1.1.1 细菌菌株:大肠杆菌K12 MC4100、MC4100ΔppiD、MC4100Δskp、MC4100ΔdegP、MC4100ΔsurA、 MC4100Δskp+ΔDegP和 MC4100Δskp+ΔPpiD菌株[6-8](德国弗莱堡大学Matthias Mueller教授提供);大肠杆菌K12 W3110、W3110ΔppiD、W3110ΔyfgM、W3110ΔppiD+ΔyfgM菌株[9](瑞典斯德哥尔摩大学Daniel Daley教授提供)。
1.1.2 主要实验试剂及配制方法:氯化钠、胰蛋白胨、酵母提取物、氨基酸、葡萄糖、蔗糖、Tris碱、IPTG、溶菌酶、EDTA、甘油、SDS、三氯乙酸、牛血清白蛋白V(BSA)、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液[生工生物工程(上海)股份有限公司];甲醇、盐酸、乙酸(国药集团化学试剂有限公司)。
5×E-salts(10 mg/mL一水柠檬酸、1 mg/mL七水合硫酸镁、65.5 mg/mL三水合磷酸氢二钾、17.5 mg/mL四水合磷酸氢铵钠);E1培养基(1×E-salts、除Met/Cys外100 μmol/L的18种氨基酸、0.4%葡萄糖);T/S缓冲液(100 mmol/L Tris-HCl,pH 7.5、0.5 mol/L蔗糖);L/E缓冲液(0.1 mg/mL溶菌酶、8 mmol/L EDTA,pH 8.0);E2培养基(1×E-salts、除Met/Cys外100 μmol/L 的18种氨基酸、2%甘油、0.25 mol/L蔗糖);35S标记的Met/Cys(中国同辐股份有限公司);洗脱液(甲醇∶乙酸=3∶1)。
1.2 方法
1.2.1 原生质球的制备方法:野生菌株(WT)和转化入FhaB*质粒的[2,10]不同分子伴侣敲除菌株的菌液接种到适量E1培养基中,37 ℃、220 r/min过夜培养。第2天取出菌液,8 000 r/min、离心2 min,T/S缓冲液重悬沉淀A580为4的菌液,加入等量L/E缓冲液,置于冰上15 min。取出菌液10 000 r/min、离心10 min,等量E2缓冲液重悬沉淀,得原生质球,置于冰上备用。
1.2.2 FhaB*原生质球分泌实验:原生质球37 ℃孵育15 min。加入终浓度为4 mmol/L的IPTG,1 min 30 s后加入终浓度13.6 μmol/L 35S标记的Met/Cys,37 ℃反应30 min后,13 000 r/min离心6 min,吸上清入新的离心管中,适量水重悬沉淀,分别加入等体积10%TCA来沉淀上清(S)或沉淀(P)中的蛋白。取TCA沉淀后的蛋白进行SDS-PAGE电泳检测。电泳结束后,蛋白胶固定10 min,置于干胶仪上60 ℃、1 h干燥后,压磷屏用Typhoon扫描仪扫描同位素信号。
1.2.3 分子伴侣敲除株的验证:取敲除菌株和野生菌株培养液1 mL,TCA沉淀收集菌体蛋白。另外,将野生菌株、敲除菌株制备成原生质球后,13 000 r/min离心6 min,将上清吸入一个新的EP管中,TCA进行沉淀。取菌体(C)和原生质球(Sph.)沉淀进行SDS-PAGE电泳,然后用PVDF膜进行蛋白质免疫印迹。分别加入相应分子伴侣蛋白的抗体进行检测,用Tanon 5800仪器曝光显色。
2 结果
2.1 部分分子伴侣蛋白敲除菌株的验证
用免疫印迹法对部分分子伴侣蛋白的敲除情况进行检测(图1)。结果表明,主要分子伴侣蛋白如Skp(泳道 3、4)、PpiD(泳道 5、6)、DegP(泳道7、8)和SurA(泳道 9、10)等在对应的敲除菌株细胞(C)和原生质球(Sph.)中均未检测到。验证了相关敲除菌株均为目的菌株。

WT.wild-type strain; △.knock-out strain; C.samples from bacterial cells; Sph.spheroplast samples图1 部分伴侣蛋白敲除菌株的验证Fig 1 Knock-out results of chaperone proteins
2.2 各分子伴侣蛋白对双组分蛋白底物FhaB*分泌至周质空间的影响
所有敲除菌株中FhaB*前体蛋白(pFhaB*)的合成不受细菌周质空间中分子伴侣敲除的影响(图2)。单独敲除SurA或双敲除Skp/DegP后,其原生质球的沉淀中(P)均含有FhaB*前体蛋白,而上清(S)均未见分泌到周质空间中的FhaB*蛋白(图2)。
与野生型相比,当单独敲除分子伴侣蛋白Skp(图2A泳道5、6)、DegP(图2A泳道7、8)、PpiD(图2B泳道3、4)、YfgM (图2B泳道5、6)或双敲除PpiD/YfgM(图2B泳道7、8)时,FhaB*蛋白分泌至周质空间基本不受影响。而单独敲除分子伴侣蛋白SurA(图2A泳道3、4)或者双敲除Skp/DegP(图2A泳道9、10)则显著影响了FhaB*蛋白的跨内膜分泌至周质空间的过程。
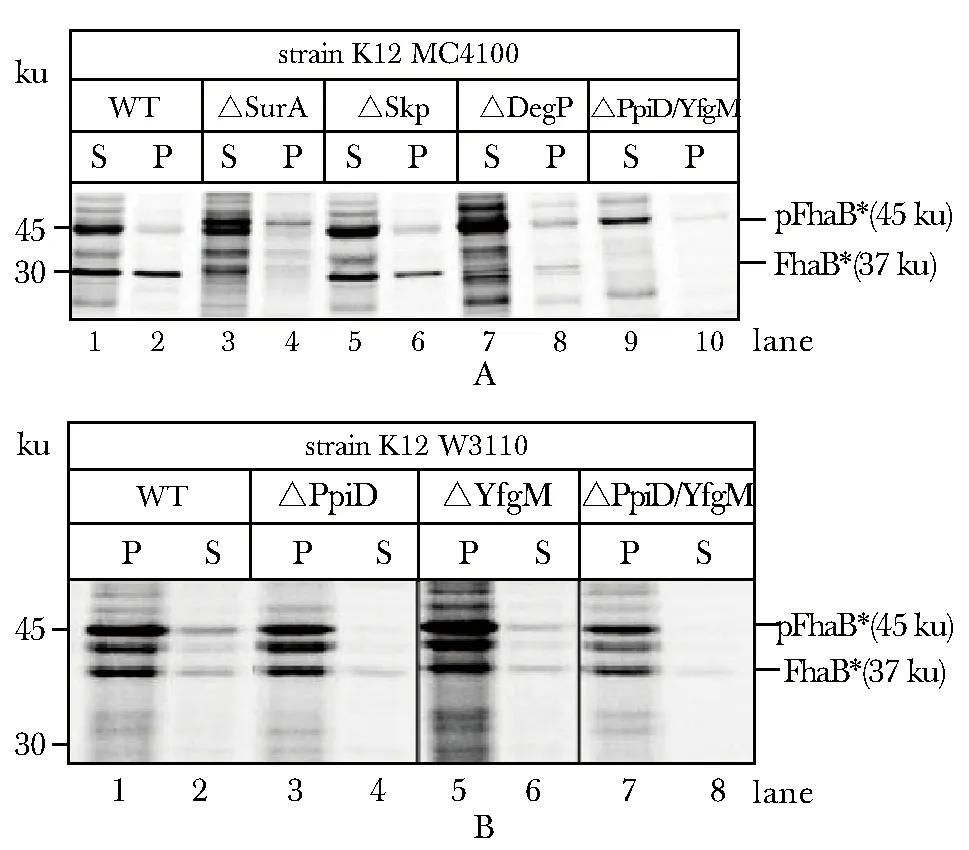
A.effect of chaperones SurA, Skp, Dkp/DegP on the secretion of two-partner proteins into the periplasmic space; B.effect of chaperones PpiD/YfgM on the secrection of two-partner proteins into the periplasmic space; WT.wild-type strain; Δ.knockout strain; pFhaB*.a precursor protein containing a signal peptide; FhaB* .a mature protein without a signal peptide; P.the spheroplast pellet; S.the supernatant after centrifuging the spheroplast图2 SurA、 Skp、DegP、PpiD和YfgM等分子伴侣蛋白对双组分蛋白分泌至周质空间的影响Fig 2 Effect of chaperones SurA, Skp, DegP, PpiD and YfgM on the secretion of two-partner proteins into the periplasmic space
3 讨论
革兰阴性菌细胞的周质空间位于内膜和外膜之间,鉴于外膜上含有大量的非特异性孔道蛋白(porins),分子质量0.6~1 ku的小分子物质可以自由扩散的形式抵达周质空间,因而周质空间的蛋白更易受周围环境的影响。由于β-折叠而形成的淀粉样蛋白的结构特点,又使得含有β-折叠的蛋白在周质空间中更容易形成沉淀[11-13]。因此,这类蛋白在周质空间中必然需要各类分子伴侣蛋白以避免凝集和被蛋白酶降解。
本研究通过敲除周质空间中已知的不同分子伴侣蛋白,以探讨双组分蛋白跨内膜分泌至周质空间对分子伴侣蛋白的依赖情况,从而为充分理解双组分蛋白转运系统的机制提供依据。单独敲除主要分子伴侣蛋白Skp、DegP、PpiD或YfgM时,FhaB*蛋白分泌至周质空间不受影响;而单独敲除SurA蛋白或者同时敲除Skp/DegP两个分子伴侣蛋白时,FhaB*蛋白的跨内膜分泌至周质空间则被阻止,表明SurA蛋白或者Skp/DegP两个蛋白的组合分别参与了双组分蛋白FhaB*的周质空间分泌。也就是说,当SurA或者Skp/DegP分子伴侣缺失时,FhaB*前体蛋白尽管仍在细菌细胞质中合成,但不能有效分泌至细菌周质空间内,表明分子伴侣SurA或Skp/DegP在TPS系统的TpsA蛋白跨内膜分泌具有重要作用,进而对维持TpsA蛋白在周质空间中的稳定性具有重要作用。这一结果也与目前部分学者认为的在周质空间中存在同时作用的两个分子伴侣途径:一条途径由SurA蛋白组成,另一条途径则与Skp和DegP蛋白共同组成的观点相一致[14]。

