沉默NLRP3炎性小体表达降低香烟烟雾提取物导致的人肺动脉内皮细胞凋亡
薛 鸿,林昌建,谢宝松,许能銮,姚秀娟,王 虹,解卫平
(1.福建医科大学省立临床医学院 福建省立医院 呼吸与危重症医学科,福建 福州350000 2.福建省呼吸四病研究室,福建 福州 350000; 3.南京医科大学附属第一医院 呼吸与危重症医学科,江苏 南京 210029)
吸烟是众多慢性气道疾病的“元凶”,其中慢性阻塞性肺疾病(chronic obstructive pulmonary diseases, COPD)是目前最常见且有高致残/致死率的疾病[1-2],COPD可继发肺动脉高压甚至肺源性心脏病,直接影响疾病预后,其主要机制是肺血管重塑[3]。人肺动脉内皮细胞(human pulmonary artery endothelial cells, HPAECs)内衬于肺血管内层,是肺血管重塑的主要效应细胞[4]。本研究通过以香烟烟雾提取物(cigarette smoke extract,CSE)刺激HPAECs模拟吸烟的病理过程,重点研究NLR家族pyrin结构域蛋白3(NLR family pyrin domain protein 3,NLRP3)炎性小体在其中的作用。
1 材料与方法
1.1 细胞、试剂及药物
原代人肺动脉内皮细胞HPAECs(Cell Science实验室),NLRP3 siRNA(Dharmacon公司),LipofectamineTM2000 Reagent(Invitrogen公司),NLRP3抗体(Abcam公司)、caspase-1抗体(Cell Signaling Technology公司)、二抗(北京中杉金桥生物技术有限公司)、乙酰半胱氨酸(N-acetylcysteine,NAC)(Sigma公司)、内皮细胞培养液ECM(Hyclone Laboratories公司)、香烟(Marlboro公司)。
1.2 方法
1.2.1 香烟烟雾提取物的制备及实验:吸引1支香烟燃烧5 min的烟雾溶于10 mL PBS溶液中,过滤除菌后作为CSE原液,再用内皮细胞培养液稀释(公式:CSE浓度=CSE原液体积/总体积×100%)[5]。根据本课题组前期研究选用10% CSE为实验条件。
1.2.2 细胞的培养及分组处理:用含1%抗生素,1%内皮生长因子,10%胎牛血清的ECM内皮细胞培养液,置于37 ℃及饱和湿度的培养箱中培养HPAECs。取对数增殖期的第3~6代HPAECs进行实验,接种细胞为1×105个/mL左右,待细胞铺板面积汇合度达 80%~90%后进行后续处理。
分别转染siNLRP3以及阴性对照siNC至HPAECs。siNLRP3序列为5′-GGTGTTGGAATTAG ACAAC-3′。按 LipofectamineTM2000 说明书的操作要求配制质粒和脂质体复合物,转染后继续在37 ℃、5% CO2、饱和湿度的恒温下培养,转染6 h后无血清培养基继续培养。转染后的细胞分别为siNC组(转染阴性对照siNC)、siNLRP3组(转染siNLRP3),以10% CSE刺激12 h后进行各组后续流式细胞仪检测。
再将正常培养的细胞分为:对照(control)组、CSE组(加入10%CSE液)、NAC+CSE组(以10 mmol/L NAC预处理1 h后再以10% CSE培养液处理)及NAC组(以10 mmol/L NAC单独处理1 h),各组均于37 ℃及饱和湿度的培养箱中培养12 h后进行检测。
1.2.3 CCK-8法检测细胞活力:将经常规消化、洗涤、重悬后的细胞种于96孔板,设置6个复孔,加入不同浓度的CSE液体,经12~24 h培养后,每孔加入10 μL CCK-8溶液继续培养2 h,测定吸光值(波长450 nm),分析、记录实验结果。
1.2.4 Annexin V/PI 流式细胞术检测细胞凋亡:用胰蛋白酶消化收集经相应处理后的转染RNA前后的细胞,PBS重悬细胞达1×106个/mL,1 000×g离心5 min(4 ℃),弃上清,用annexin V结合液(1∶10 稀释)重悬细胞后,每管加入 5 μL annexin V-FITC及10 μL PI,轻微摇匀后,室温避光孵育15 min,随即流式细胞仪检测各组细胞凋亡情况。
1.2.5 细胞内ROS的检测: 细胞汇合度达70%~80%时,弃去上清液,PBS洗3遍,以含DCFH-DA(终浓度50 μmol/L)的内皮细胞培养基在37℃下避光孵育30 min,PBS洗去残留液以免干扰结果,避光条件下用4%多聚甲醛固定30 min,后在激光扫描共聚焦荧光显微镜下每组细胞选择6个视野摄片(摄片激光激发波长488 nm,发射波长525 nm),用软件分析计算各组荧光强度。
1.2.6 Western blot检测蛋白:用PBS洗涤3次处理后的各组细胞,用含PMSF及酶抑制剂的RIPA裂解液提取总蛋白。制备SDS-PAGE后各组蛋白上样60 μg,120 V恒压电泳后转PVDF膜(湿300 mA 恒流),TBST洗涤PVDF膜后用5%胎牛血清常温处理1 h,再分别加入NLRP3 抗体(1∶1 000)、caspase-1 抗体(1∶1 000)、GADPH抗体(1∶1 000),4 ℃孵育过夜,TBST 洗涤后,GADPH直接用 ECL化学发光试剂显影,其余加入兔二抗(1∶8 000)37 ℃孵育 1 h,TBST洗涤后再用ECL化学发光试剂显影,条带用 Quality One software 计算机软件分析,结果均至少重复3次[6]。
1.3 统计学分析

2 结果
2.1 CSE暴露引起的 HPAECs 活性下降
10% CSE 处理12 h后细胞活性明显降低(P<0.05)。故后续实验条件为10% CSE处理细胞12 h(图1)。
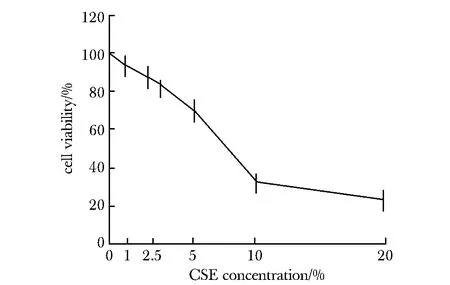
图1 不同浓度CSE对细胞活性的影响Fig 1 Effects of different CSE concentrations on cell activity
2.2 siRNA抑制NLRP3表达减少CSE刺激所致HPAECs凋亡
siNC组在CSE刺激后,HPAECs存活率下降,凋亡率较CSE刺激前明显增加(P<0.05),SiNLRP3组在CSE刺激后,细胞凋亡率较siNC组同等CSE刺激后有所减少(P<0.05)(图2)。
2.3 CSE暴露导致HPAECs细胞内活性氧(reactive oxygen species,ROS)水平增加,NAC共孵育可有效逆转CSE暴露诱导的ROS水平增加
CSE组细胞内ROS表达水平较对照组明显上升(P<0.05)。NAC干预后同等10%CSE作用12 h(CSE+NAC组)可见细胞内的ROS表达水平较CSE组有明显下降(P<0.05)(图3)。
2.4 CSE暴露导致HPAECs胞内NLRP3 炎性小体表达增加,NAC共孵育可缓解CSE暴露诱导的NLRP3 炎性小体表达增加
CSE组胞内NLRP3和caspase-1蛋白表达水平较对照组均增加(P<0.05),CSE+NAC组HPAECs胞内NLRP3和caspase-1蛋白表达水平较CSE组均下降(P<0.05)(图4)。
3 讨论
本研究报道了CSE引发肺动脉内皮细胞凋亡,NLRP3炎性小体的活化是其中重要分子过程,抑制NLRP3可以减少CSE刺激后的肺动脉内皮细胞凋亡。
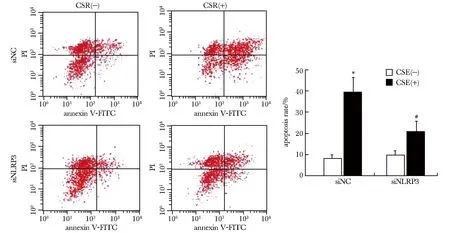
*P<0.05 compared with CSE(⁃) in siNC group;#P<0.05 compared with CSE(+) in siNC group图2 siRNA 沉默NLRP3表达后对CSE诱导HPAECs凋亡的影响Fig 2 Effects of NLRP3 siRNA interferencen on CSE-induced apoptosis of HPAECs
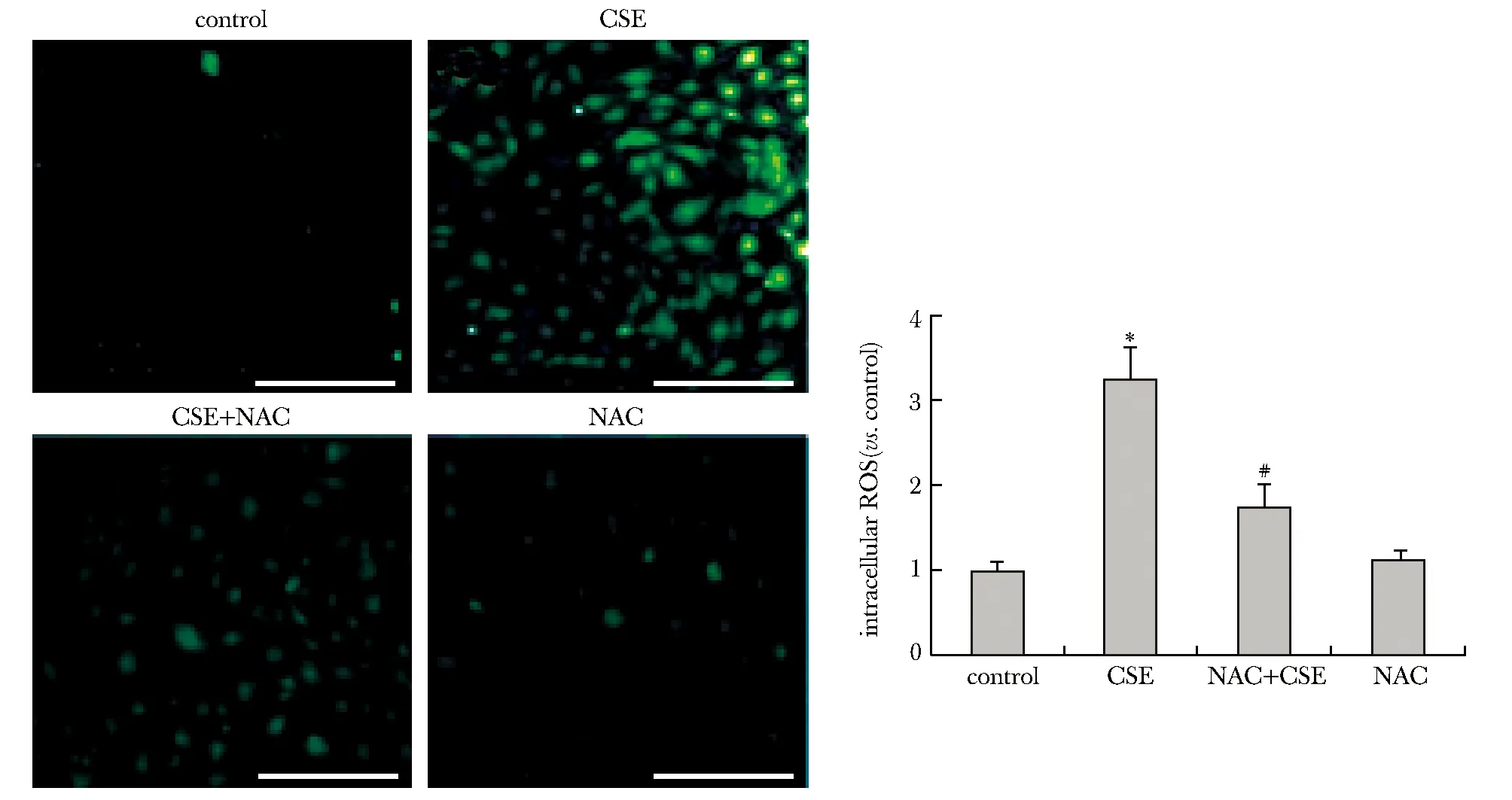
*P<0.05 compared with control group;#P<0.05 compared with CSE group; scale bar=100 μm图3 香烟烟雾提取物刺激对HPAECs胞内ROS的影响Fig 3 Effects of cigarette smoke extract on HPAECs intracellular
吸烟是肺部损伤的重要原因[7-9],肺血管内皮细胞在感染、烟雾暴露等情况下容易发生损伤[4,8]。肺动脉内皮功能障碍甚至在轻度COPD患者或肺功能正常的吸烟者中发生,是肺动脉高压发生发展的始动环节[3, 8]。香烟烟雾提取物成分复杂,被认为包含对人体最有害的烟焦油、烟碱、CO和多芳香烃等,用香烟烟雾提取物刺激细胞较好地模拟了吸烟的病理过程。CSE刺激后HPAECs细胞活力下降,凋亡增加,提示香烟烟雾可引发肺动脉内皮损伤,这应是防治吸烟相关肺部疾病的治疗点。

*P<0.05 compared with control group;#P<0.05 compared with CSE group图4 ROS清除剂NAC对NLRP3 炎性小体表达的影响Fig 4 Effect of ROS scavenger NAC on the expression of NLRP3
细胞内多蛋白复合体炎性小体是参与免疫应答和应激的重要角色[10]。其中被最深入研究的是NLRP3炎性小体。其主要成分是 NOD 样受体蛋白 3(NLRP3)、凋亡相关斑点样蛋白(apoptosis-associ-ated speck-like protein, ASC)以及半胱氨酸天冬氨酸特异性蛋白酶-1(caspase-1)。研究已证实NLRP3炎性小体/caspase-1/IL-1β信号通路与哮喘、COPD等气道慢性疾病的发病密切相关[11-12]。但香烟烟雾刺激下肺血管内皮细胞凋亡仍未见报道。本研究首次将NLRP3炎性小体作为烟雾暴露损伤的研究重点。结果发现CSE刺激后NLRP3蛋白表达显著上调,表明CSE刺激激活了HPAECs内的NLRP3。激活的NLRP3可通过参与炎性小体的装配和成熟,随后完成caspase-1的招募、剪切、成熟[13]。而caspase-1作为主要的效应分子可以参与到细胞炎性凋亡[11]。本研究发现CSE刺激后caspase-1表达也显著上调,侧面证实这个过程。本实验结果表明,CSE暴露可引发细胞凋亡,抑制NLRP3后可对细胞凋亡起保护作用。NLRP3炎性体活化可能是CSE诱导的细胞凋亡中的重要机制。
NLRP3炎性小体具体活化机制仍有待于深入研究,可能和ROS的过量产生有关[14]。在病理情况下,高水平ROS可干扰胞内信号传导,诱导细胞凋亡[14]。本研究发现CSE诱导HPAECs中NLRP3炎性小体活化时,细胞内ROS水平显著上升;应用ROS清除剂NAC,同等程度CSE刺激后NLRP3炎性小体活化明显减弱,表现为NLRP3表达减少,相关的蛋白caspase-1表达水平显著下降,提示抑制细胞内ROS可有效地阻止NLRP3炎性小体活化。
本研究首次报道了NLRP3炎性小体在CSE促进人肺动脉内皮细胞凋亡中扮演着关键角色,应用siRNA技术沉默NLRP3可显著减少capase-1蛋白表达,减少CSE暴露诱导的细胞凋亡。胞内ROS对CSE刺激HPAECs中NLRP3炎性小体活化有重要作用。本研究结果为进一步研究吸烟相关肺部疾病的新策略提供了实验室数据。

