重组人基质金属蛋白酶12的原核表达与纯化
孙卫国,张灵霞,史阅韩,翟斐,孙雯娜,侯江厚
1.解放军总医院第八医学中心 结核病研究所,全军结核病防治重点实验室,结核病诊疗新技术北京市重点实验室,北京 100091;2.昆明市妇幼保健院,云南 昆明 560013
基质金属蛋白酶(matrix metalloproteinase,MMP)是一类结构中含有锌离子和钙离子的蛋白水解酶,能降解细胞外基质(extracellular matrix,ECM)成分,包括基膜胶原质、间质胶原蛋白、纤维蛋白和各种蛋白聚糖[1],在诱导肿瘤血管生成,细胞迁移、增殖、凋亡和结缔组织退化中发挥核心作用。MMP-12 是MMP 中的重要成员,又称为人巨噬细胞基质金属蛋白酶,由活化的炎症巨噬细胞分泌,与许多疾病的病理过程关系密切。MMP-12 与直肠癌疾病进展和癌细胞转移相关;在皮肤基底细胞和鳞状细胞癌组织中,MMP-12的mRNA 表达水平明显比癌前病变高,且参与肿瘤分化和侵袭;在肝切除术后肝癌患者中,MMP-12 成为总生存率和肿瘤复发的一个可靠的预后标志物[2]。MMP-12 与肺部疾病密切相关,在肺鳞癌中MMP-12 过度表达,明显高于肺腺癌[3-4]。MMP-12 可促进病毒、细菌的侵入及癌细胞转移,促进一些急性和慢性肺部疾病如过敏性哮喘、肺气肿、肺癌和肺部感染等的宿主免疫反应和发病机制,是肺部疾病活动的标志[5]。本课题组在前期研究中发现,耐药性结核病患者相对于药敏患者而言,由于长期服用抗结核药,造成肺部损伤,MMP-12 特异性表达上调,因此我们认为特异性抑制MMP-12 的功能将有可能减轻肺部组织损伤。MMP-12 自 N 端至 C 端依次有 3 个功能区,即前肽区、催化区和血红素结合蛋白区域,催化区行使该蛋白的酶学功能。我们通过原核表达并采用肠激酶酶切和二次纯化的方法获得了高纯度的MMP-12 蛋白,包含其催化区和血红素结合蛋白区域,全长365 个氨基酸残基,拟以此为靶标进行MMP-12 特异性抗体和抑制剂筛选。
1 材料与方法
1.1 材料
大肠杆菌Rosetta(DE3)及其感受态细胞、原核表达载体pET-24a 由本室制作保存;全基因由华大基因公司合成,PCR、质粒提取、核酸回收等常规分子生物学实验试剂盒购自天根生化科技(北京)有限公司;限制性内切酶、T4DNA 连接酶购自NEB 公司;蛋白质相对分子质量marker 购自Sigma 公司;重组肠激酶由本室表达纯化;Ni-Sep⁃harose Chelating Sepharose Fast Flow 亲和树脂填料购自GE 公司,本室装填纯化柱;LB 培养基、PBS 缓冲液配制试剂等其他试剂为进口或国产分析纯产品。
1.2 全基因合成
参照NCBI Pubmed 登录号NP002417.2,选定MMP-12 蛋白的氨基酸序列为 Gly106~Cys470,N端加入6×His 标签和肠激酶序列DDDDK。融合蛋白对应的核酸序列按照利于原核表达系统表达的原则进行优化和全基因合成,合成编号为WHC195480,同时3′端加入大肠杆菌终止密码子taa,5′端和3′端分别引入限制性内切酶NdeⅠ和XhoⅠ位点序列。
1.3 pET-MMP-12表达载体的构建与鉴定
用限制性内切酶NdeⅠ和XhoⅠ对全基因合成的克隆载体pMV-MMP-12 以及表达载体pET-24a 分别进行双酶切,回收酶切后的MMP-12 核酸片段和pET-24a,与T4DNA 连接酶按摩尔比3∶1混合后于16℃连接过夜,取5 μL 连接产物转化感受态大肠杆菌Rosetta(DE3),次日挑选10 个克隆转接 5 mL 含 50 μg/mL 卡那霉素的 LB 培养基,振荡培养3 h,加入IPTG 至终浓度为0.2 mmol/L,37℃振荡诱导5 h,12% SDS-PAGE 分析各菌落的表达情况,选择表达量高的菌落进行测序鉴定,获得表达工程菌株。
1.4 重组MMP-12融合蛋白的原核表达与纯化
取阳性工程菌株于37℃振荡培养8 h 进行活化,隔日按 1∶50 的比例转接至含 50 μg/mL 卡那霉素的2 L LB 培养基中扩大培养,当菌液D600nm值约为0.4 时加入IPTG 使其终浓度为0.2 mmol/L,37℃振荡诱导7 h;菌液离心,对沉淀的菌体进行冰浴,4℃条件下超声波破碎,取上清和沉淀加入变性上样缓冲液,SDS-PAGE 分析重组蛋白的表达形式。超声沉淀以1%的Triton X-100 充分洗涤2 次,洗涤后的沉淀用6 mol/L 尿素+PBS 溶液充分溶解,12 000 r/min 离心30 min,上清以1 mL/min 的速度结合镍离子螯合的亲和层析柱,PBS 缓冲液缓慢平衡层析柱5 个柱积,用30 mmol/L 咪唑除去菌体自身杂蛋白,150 mmol/L 咪唑洗脱收集目的蛋白,150 mmol/L 咪唑+6 mol/L尿素洗脱未复性蛋白,12% SDS-PAGE 分析重组蛋白的纯度。纯化的MMP-12 融合蛋白水透析后,冰冻保存。
1.5 重组MMP-12融合蛋白的肠激酶酶切
取纯化的MMP-12 重组蛋白用PBS 稀释至1 mg/mL,按1∶3000 加入重组肠激酶充分混匀,分别于4℃和25℃条件下进行酶切。每8 h 取酶切后的样品加入上样缓冲液,煮沸10 min,SDSPAGE 分析酶切效率,选取最佳酶切条件。优化最佳酶切条件后,取20 mg MMP-12 融合蛋白于4℃酶切过夜备用。
1.6 重组MMP-12蛋白的二次纯化
融合蛋白酶切后,N 端切除部分带有6×His 标签,同时所用肠激酶也带有6×His 标签,因此采用镍离子螯合的亲和层析方法对酶切后的蛋白混合液进行分离提纯。取酶切后的MMP-12 融合蛋白混合液,以1 mL/min 的速度重复结合镍离子螯合的亲和层析柱2 次,小心收集穿过液,用PBS 缓冲液缓慢平衡层析柱2 个柱积,用150 mmol/L 咪唑进行洗脱,纯化后的MMP-12 蛋白用HPLC 进行纯度测定,充分水透析后,冻干保存。
2 结果
2.1 全基因合成
选定MMP-12 蛋白催化区和血红素结合区Gly106~Cys470 氨基酸序列进行原核重组表达,同时在该肽段的N 端加入6×His 标签和肠激酶序列DDDDK。合成的序列全长376 个氨基酸残基,按照利于原核系统表达的原则进行核酸序列优化,进行全基因合成,氨基酸序列如下:
HHHHHHDDDDKGPVWRKHYITYRINNYTPDMNREDVDYAIRKAF QVWSNVTPLKFSKINTGMADILVVFARGAHGDFHAFDGKGGILA HAFGPGSGIGGDAHFDEDEFWTTHSGGTNLFLTAVHEIGHSLGL GHSSDPKAVMFPTYKYVDINTFRLSADDIRGIQSLYGDPKENQR LPNPDNSEPALCDPNLSFDAVTTVGNKIFFFKDRFFWLKVSERP KTSVNLISSLWPTLPSGIEAAYEIEARNQVFLFKDDKYWLISNL RPEPNYPKSIHSFGFPNFVKKIDAAVFNPRFYRTYFFVDNQYWR YDERRQMMDPGYPKLITKNFQGIGPKIDAVFYSKNKYYYFFQGS NQFEYDFLLQRITKTLKSNSWFGC
2.2 MMP-12原核表达载体的构建与诱导表达
将合成的全核酸表达序列克隆构建表达载体 pET-MMP-12,转化大肠杆菌 Rosetta(DE3),次日挑选10 个克隆进行常规诱导表达,12% SDSPAGE 分析各菌落表达情况,选择表达量高的菌落进行测序鉴定。结果如图1,在获得的10 个克隆中,9 个菌株有外源蛋白重组表达。对测序正确的菌株加入20%甘油混匀后超低温保存,获得表达工程菌株pET-MMP-12。
2.3 MMP-12融合蛋白的原核表达与纯化
取阳性工程菌株扩大培养,优化诱导温度、时间和IPTG 浓度。取诱导后的工程菌高速离心,收集沉淀后在冰水混合条件下超声波破碎,取上清和沉淀煮沸10 min,SDS-PAGE 分析重组蛋白的表达形式。结果如图2,重组蛋白表达量占菌体总蛋白40%以上,相对分子质量为42×103,和预期一致,但几乎都以包涵体形式存在,高表达量为后期的复性纯化提供了保证。

图1 MMP-12 表达菌株的表达筛选电泳分析

图2 MMP-12 原核表达产物表达形式分析
超声沉淀用1%的Triton X-100 洗涤除去脂类物质,然后用6 mol/L 尿素+PBS 充分溶解,上清以缓慢速度流经镍离子螯合的亲和层析柱,再用PBS 缓冲液缓慢平衡层析柱5 个柱积,进行缓慢柱上复性。分别用150 mmol/L 咪唑洗脱收集目的蛋白,150 mmol/L 咪唑+6 mol/L 尿素洗脱梯度未复性蛋白。12% SDS-PAGE 结果显示(图3),经过柱上复性后,MMP-12 包涵体复性率将近50%,亲和纯化后,复性后的MMP-12 融合蛋白纯度在95%以上。
2.4 MMP-12融合蛋白的肠激酶酶切条件优化
MMP-12 融合蛋白的N 端带有肠激酶位点DDDDK,将肠激酶与重组蛋白按1∶3000 充分混合,分别于4℃和25℃条件下酶切。分别取8 h 间隔样品进行SDS-PAGE 分析,结果见图4,肠激酶对MMP-12 重组蛋白具有较高的酶切效率,4℃条件下,8 h 内几乎完全酶切。

图3 MMP-12 融合蛋白的复性与纯化电泳分析
2.5 重组MMP-12蛋白的二次纯化
采用镍离子螯合的亲和层析方法对酶切后的蛋白混合液进行分离提纯。将酶切后MMP-12融合蛋白混合液以缓慢的速度重复结合镍离子螯合的亲和层析柱,收集穿过液进行12%的SDS-PAGE,发现纯化后的MMP-12 相对分子质量为40.8×103,符合预期,考马斯亮蓝染色纯度在95%以上(图5)。对纯化后的MMP-12 蛋白用HPLC 进行纯度测定,纯度为97%(图6)。
3 讨论

图4 MMP-12 融合蛋白的肠激酶酶切电泳分析

图5 MMP-12 蛋白二次亲和纯化的电泳分析
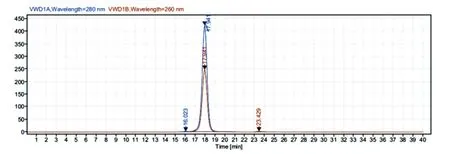
图6 纯化后MMP-12 蛋白的HPLC 纯度测定图
MMP-12 作为弹性蛋白的降解者,是慢性阻塞性肺疾病(COPD)形成过程中的重要损伤性因子,导致肺泡壁的破坏并导致肺气肿发展,可作为减缓肺气肿进展的潜在靶点[6]。MMP-12 特异性抑制物基质金属蛋白酶抑制剂(TIMP)能选择性抑制蛋白酶活性,减轻肺组织的损伤,可能为抗感染治疗提供新途径[7]。目前国内外有关MMP-12 的研究报道较少,MMP-12 的功能、调节及致病机制等尚不完全明确。对MMP-12 及其抑制剂更多的科学性研究,可以为肿瘤、肺部疾病以及动脉粥样硬化等疾病提供新的诊断和治疗方向,因而具有重大的临床意义。MMP-12 没有特异性强的抑制剂,这就需要通过体外筛选或分子模拟方法去获得其化合物抑制剂或生物抑制剂,普遍存在的缺陷是获得的MMP-12 抑制剂效价偏低,缺少系统的虚拟筛选方法。我所在研究中也发现,长期用药导致的肺损伤中,MMP-12 呈特异性高表达,通过体外获得MMP-12 治疗性抗体或生物抑制剂,有望限制MMP-12 活性,达到抑制肺损伤的作用,而获得高纯度的MMP-12 蛋白是后期实验成功的前提。目前通过原核重组获得高表达和易纯化的重组蛋白,大都采用融合表达和亲和标签的方法,其弊端是引入了冗余氨基酸序列,影响后期筛选获得抑制分子的特异性。我们在本研究中,采用肠激酶酶切的方法通过二次纯化获得高纯度的MMP-12 蛋白,剔除了冗余氨基酸短肽,获得了纯度97%以上的目的蛋白,方法可靠、稳定。本方法的建立,为大规模获得高纯度重组蛋白奠定了基础,也为随后开展以MMP-12 为靶标的相关抑制剂筛选以及更深层次的MMP-12 相关机制研究提供了可靠保证。

